N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-芳基噻唑-2-基)腙类化合物的合成*
阿布拉江·克依木,王立举,萨特瓦尔迪·赫力力
(新疆大学化学化工学院石油天然气精细化工教育部新疆维吾尔自治区重点实验室,新疆 乌鲁木齐 830046)
吡唑类化合物是一类具有广泛生物活性的杂环化合物,因其作用谱广、药效强烈等特点而受到越来越多的关注[1]。研究发现吡唑类化合物具有消炎、止痛、抑菌、杀菌、杀虫和除草等活性,并且表现出高效、低毒和结构多样性[2~5]。噻唑类化合物广泛存在于自然界中,因其具有抗细菌[6]、抗 HIV[7]、抗肿瘤[8]等生物活性,在过去的几十年里,已经有许多文献报道了不同噻唑环衍生物的合成[9~11]。腙类化合物是一类合成杂环化合物的重要中间体,同时,腙基团(-C=N-N-)也是医药和农药化合物中的重要结构。研究表明,腙类化合物具有抗菌、杀虫、抗病毒以及抗癌等多种生理活性[12,13],可以抑制体内诸多生理生化过程[14],在农药、医药、材料和分析试剂等方面备受关注[15,16]。根据药物设计的拼合原理,将吡唑环和噻唑环引入到腙类化合物的分子中,很可能拼合出具有更强生物活性的化合物。
N-(4-芳基噻唑-2-基)腙类化合物是同时具有席夫碱和噻唑环结构单元的一类化合物,其合成一般经两步反应制得。首先,芳香醛或酮与氨基硫脲发生缩合反应,生成芳香醛(或酮)缩氨基硫脲,然后与α-溴代芳基乙酮发生环化反应生成含有噻唑环的腙类化合物[17]。与传统的合成方法相比,一锅法具有降低能耗、节省时间、减少废液的排放、减少分离和纯化步骤、提高产品产率和环境友好等特点,在有机合成、组合化学及农药研究等领域被广泛应用。至今,一锅法已被广泛应用于合成多取代苯基噻唑腙类化合物及其衍生物[18~21]。
为了寻找含有潜在生物活性的先导化合物并为此类杂环类化合物的合成提供简便及有效的方法与途径,本文分别采用常规方法和三组分一锅法设计并合成了一系列未见文献报道的杂环化合物——N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-芳基噻唑-2-基)腙(4a~4h)。常规法:1-苯基-5-甲基吡唑-4-乙酮(1)与氨基硫脲(2)发生缩合反应制得中间体1-苯基-5-甲基吡唑-4-乙酮缩氨基硫脲(5);5再与α-溴代芳基乙酮(3a~3h)反应,环化合成4a~4h(Scheme 1)。一锅法:1与2反应后不分离,直接与3a~3h反应环化合成4a~4h(Scheme 1)。其结构经1H NMR,IR和MS表征。并对两种方法的实验结果进行比较。
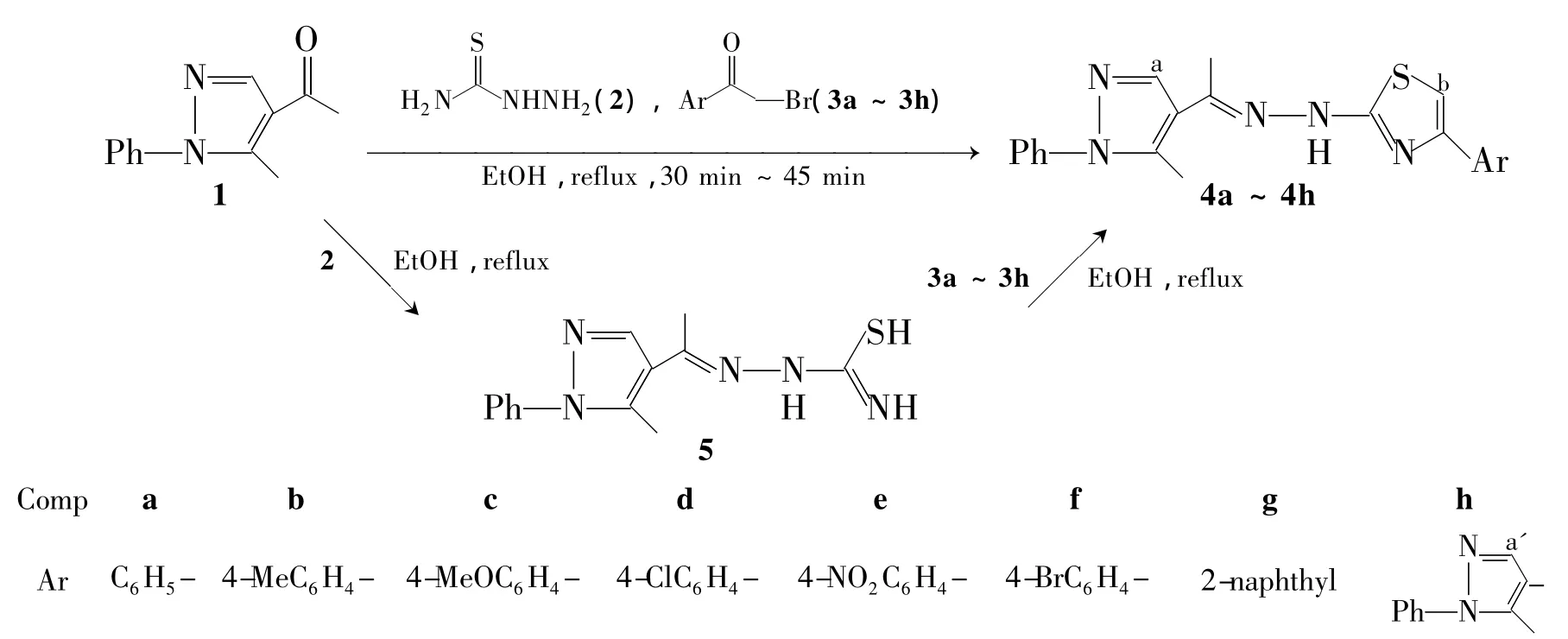
Scheme 1
1 实验部分
1.1 仪器与试剂
Yanaco MP-S3型熔点仪(温度未校正);INOVA-400型核磁共振(CDCl3为溶剂,TMS为内标);HP 1100 LC-MS(ESI)型质谱仪。
1[23]和 3a~ 3h[22]按文献方法合成;其余所用试剂均为分析纯。
1.2 常规法合成
(1)5的合成
在反应瓶中依次加入1 2.00 g(10 mmol),2 0.91 g(10 mmol),无水乙醇 30 mL 及冰乙酸 0.5 mL,搅拌下回流反应24 h(TLC跟踪)。冷却至室温,过滤,滤饼用95%乙醇重结晶得白色晶体5,产率83%,m.p.220 ℃~222 ℃;1H NMR δ:10.21(s,1H,SH),8.25(s,1H,C=NH),7.36(s,1H,NH),8.04(s,1H,ArH),7.46~7.58(m,5H,PhH),2.47(s,3H,CH3),2.30(s,3H,CH3)。
(2)4a~4h的合成
在反应瓶中依次加入5 0.273 g(1 mmol)和无水乙醇25 mL,加热搅拌使其溶解;加入3a~3h 1 mmol,回流反应 10 min~20 min[TLC 跟踪,展开剂:V(甲醇)∶V(氯仿)=1 ∶3,下同]。冷却至室温,过滤,滤饼用NaHCO3溶液洗涤,用溶剂[V(DMF)∶V(H2O)=5 ∶1]重结晶得4a~4h。
1.3 一锅法合成
在反应瓶中依次加入1 200 mg(1 mmol),2 91 mg(1 mmol),无水乙醇10 mL及冰乙酸0.5 mL,搅拌下回流反应 5 min。加入 3a~3h 1 mmol,回流反应25 min~40 min(TLC跟踪)。冷却至室温,过滤,滤饼用95%乙醇重结晶得4a~4h。
N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-苯基噻唑-2-基)腙(4a):砖红色晶体,m.p.223 ℃~225 ℃;1H NMR δ:12.79(s,1H,NH),7.93(s,1H,a-H),7.45~7.76(m,10H,ArH),6.72(s,1H,b-H),2.58(s,6H,CH3);IR ν:3 390(NH),3 031,2 914(Ar-H),1 618,1 597,1 554,1 503(C=C,C=N),1 395,1 279(C-N),695(C-S)cm-1;ESI-MS m/z:396{[M+Na]+},374{[M+H]+}。
N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-对甲苯基噻唑-2-基)腙(4b):深砖红色晶体,m.p.202 ℃~204 ℃;1H NMR δ:12.73(s,1H,NH),2.57(s,6H,CH3),6.67(s,1H,b-H),2.40(s,3H,CH3),7.90(s,1H,a-H),7.27~7.63(m,J=8.0 Hz,9H,ArH);IR ν:3 385(NH),3 021,2 910(Ar-H),1 615,1 589,1 551,1 507(C=C,C=N),1 391,1 273(C-N),692(C-S)cm-1;ESI-MS m/z:410{[M+Na]+},388{[M+H]+}。
N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-对甲氧基苯基噻唑-2-基)腙(4c):深砖红色晶体,m.p.208 ℃~210 ℃;1H NMR δ:12.67(s,1H,NH),2.56(s,3H,CH3),2.58(s,3H,CH3),3.65(s,3H,OCH3),6.73(s,1H,b-H),7.90(s,1H,a-H),7.44~7.70(m,J=6.8 Hz,9H,ArH);IR ν:3 305(NH),3 0241,2 904(Ar-H),1 608,1 587,1 557,1 510(C=C,C=N),1 385,1 289(C-N),689(C-S)cm-1;ESI-MS m/z:427{[M+Na]+},405{[M+H]+}。
N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-对氯苯基噻唑-2-基)腙(4d):黄色色晶体,m.p.248 ℃~ 250 ℃;1HNMR δ:12.67(s,1H,NH),2.58(s,6H,CH3),6.73(s,1H,b-H),7.90(s,1H,a-H),7.44~7.56(m,J=8.8 Hz,9H,ArH);IR ν:3 394(NH),3 030,2 919(Ar-H),1 619,1 599,1 553,1 502(C=C,C=N),1 393,1 276(C-N),698(C-S)cm-1;ESIMS m/z:430{[M+Na]+},408{[M+H]+}。
N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-对硝基苯基噻唑-2-基)腙(4e):砖红色晶体,m.p.252 ℃~254 ℃;1H NMR δ:12.70(s,1H,NH),2.56(s,3H,CH3),2.58(s,3H,CH3),6.74(s,1H,b-H),7.92(s,1H,a-H),7.44~ 7.65(m,J=8.8 Hz,9H,ArH);IR ν:3 332(NH),3 031(Ar-H),1 634,1 601,1 555,1 518(C=C,C=N),1 387,1 286(C-N),687(C-S)cm-1;ESI-MS m/z:441{[M+Na]+},419{[M+H]+}。
N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-对溴苯基噻唑-2-基)腙(4f):淡黄色晶体,m.p.266 ℃~267 ℃;1HNMR δ:12.55(s,1H,NH),2.26(s,3H,CH3),2.56(s,3H,CH3),6.96(s,1H,b-H),7.96(s,1H,a-H),7.86~8.38(m,J=8.8 Hz,9H,ArH);IR ν:3 324(NH),3 023(Ar-H),1 617,1 567,1 547,1 509(C=C,C=N),1 399,1 276(C-N),679(C-S)cm-1;ESI-MS m/z:475{[M+Na]+},453{[M+H]+}。
N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-[4-(2-萘基噻唑)-2-基]腙(4g):淡黄色晶体,m.p.238 ℃~240 ℃;1H NMR δ:12.73(s,1H,NH),2.50(s,6H,CH3),6.84(s,1H,b-H),8.28(s,1H,a-H),7.72~8.01(m,5H,ArH),7.44~7.57(m,7H,nap-H);IR ν:3 290(NH),3 030,2 919(Ar-H),1 614,1 562,1 543,1 502(C=C,C=N),1 391,1 274(C-N),692(C-S)cm-1;ESI-MS m/z:446{[M+Na]+},424{[M+H]+}。
N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-[4-(5-甲基-1-苯基吡唑-4-基)-噻唑-2-基]腙(4h):黄色晶体,m.p.>300 ℃;1H NMR δ:12.81(s,1H,NH),2.58(s,9H,CH3),6.44(s,1H,b-H),7.97(s,1H,a-H),7.92(s,1H,a'-H),7.41~7.56(m,10H,ArH);IR ν:3 380(NH),3 039(Ar-H),1 611,1 570,1 546,1 507(C=C,C=N),1 388,1 271(C-N),688(C-S)cm-1;ESI-MS m/z:477{[M+Na]+},454{[M+H]+}。
2 结果与讨论
2.1 合成
在常规合成法中,甲氧亚甲基乙酰丙酮首先与苯肼反应得到中间体1;1与2发生缩合反应生成5。以乙醇做溶剂,在回流状态下5分别与3a~3g反应环化合成了4a~4h。
实验中我们发现,1与2反应后不经分离可直接与3反应也可以得到目标化合物。在此基础上,我们设计了三组分一锅法合成目标化合物的方法,即1,2与3在无催化剂条件下回流反应合成了4a~4h。
与常规的合成路线相比,三组分一锅法操作相对简单,产率(表1)也稍高。
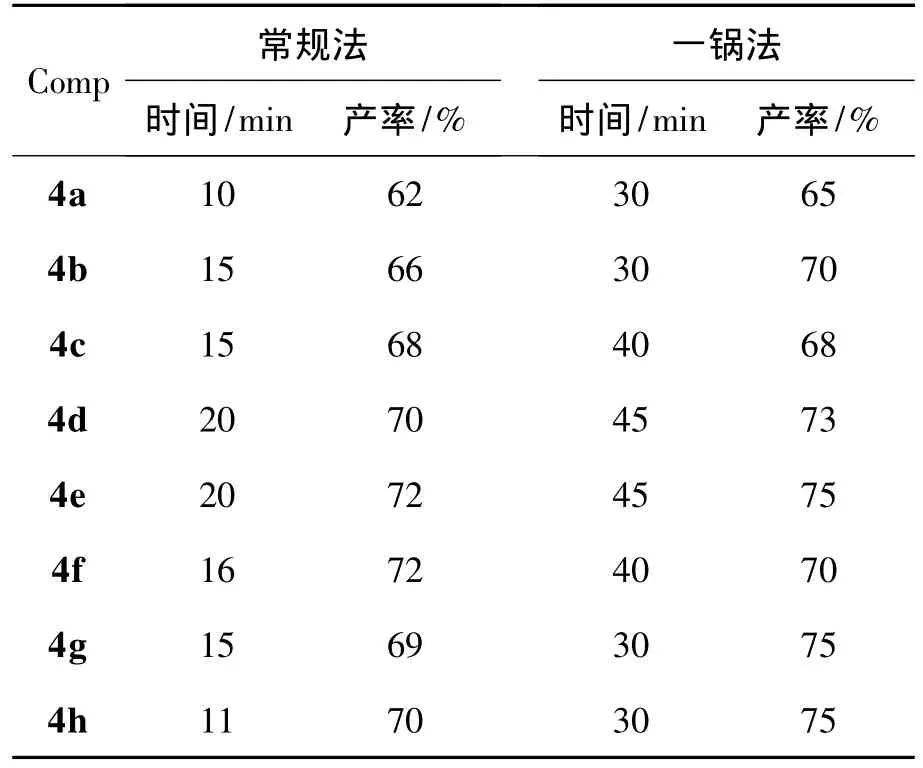
表1 两种合成方法比较Table 1 Comparison of two synthesis method
2.2 波谱解析
在5的1H NMR 谱中,10.21,8.25 和 7.36处吸收峰分别对应SH,C=NH和NH的质子信号;吡唑环C5位上质子信号出现在8.04处;苯环上5个H在7.46~7.58处呈现为多重峰,两个甲基的质子信号分别在2.47和2.30处出现单峰。
在4a~4h的1H NMR 谱中,12.55~12.81处的单峰为 NH的质子信号,a-H的质子信号在6.44~6.96 出现单峰,b-H 的质子信号在 7.90~8.28出现单峰。Ar-H的质子信号在7.27~8.38出现多重峰,2.26~2.59 出现的单峰为甲基的质子信号。另外,4c甲氧基的质子信号在3.65处出现单峰;4h的萘-H质子信号在7.44~7.57处以多重峰的形式出现。
从IR谱中发现,3 390 cm-1左右出现N-H的伸缩振动吸收峰,在1 630 cm-1~1 502 cm-1左右四组峰为C=N和C=C吸收峰为芳环和吡唑环的骨架振动吸收峰。另外,ESI-MS谱给出了[M+H]+和[M+Na]+离子峰,可以确定产产物的分子量。
3 结论
分别采用常规方法和三组分一锅法设计合成一系列未见文献报道的腙类化合物——N-[1-(5-甲基-1-苯基吡唑-4-基)-亚乙基]-N'-(4-芳基噻唑-2-基)腙。实验结果表明,经三组分一锅法较常规方法合成目标化合物具有优势。
[1] Mohamed S A,Sherif A F.3-Methyl-2-(4-substituted phenyl)-4,5-dihydronaphtho[1,2-c]-pyrazoles:Synthesis and in-vitro biological evaluation as antitumour agents[J].Arch Pharm Chem Life Sci,2008,(341):181-190.
[2] Kishnaiah A,Narsaiah B A.Novel approach to the synthesis of trifluoromethyl-3-sibstituted pyrazoles[J].J Fluorine Chem,2002,(115):9-11.
[3] Bekhit A A,Ashour H M A,AbdelGhany Y S,et al.Synthesis and biological evaluation of some thiazolyl and thiadiazolyl derivatives of 1H-pyrazoles as anti-inflammatoey antimicrobial agents[J].Eur J Med Chem,2008,(43):456-463.
[4] Paul S,Gupta M,Gupta R,et al.Microwave assisted solvent-free synthesis of pyrazolo[3,4-b]quinolines and pyrazolo[3,4-c]pyrazoles using p-TsOH[J].Tetrahedron Lett,2001,42:3827-3829.
[5] Abdel-Hafez E M N,Abuo-Rahma G A A,Abdel-Aziz M,et al.Design,synthesis and biological investigation of certain pyrazole-3-carboxylic acid derivatives as novel carriers for nitric oxide[J].Bioorg Med Chem,2009,17:3829-3837.
[6] Wilson K J,Illig C R,Subasinghe N,et al.Synthesis of thiophene-2-carboxamidines containing 2-aminothiazoles and their biological evaluation as urokinase inhibitors[J].J Bioorg Med Chem Lett,2011,11:915-918.
[7] Bell F W,Cantrell A S,Hogberg M,et al.Phenethylthiazolethiourea(PETT)compounds,a new class of HIV-1 reverse transcriptase inhibitors.1.Synthesis and basic structure-activity relationship studies of PETT analogs[J].J Med Chem,1995,38(25):4929-4936.
[8] Jiang B,Gu X H.Syntheses and cytotoxicity evaluation of bis(indolyl)thiazole,bis(indolyl)pyrazinone and bis(indolyl)pyrazine:Analogues of cytotoxic marine bis(indole)alkaloid[J].Bioorg Med Chem,2000,8:363-371.
[9] Potewar T M,Ingale S A,Srinivasan K V.Efficient synthesis of 2,4-disubstituted thiazoles using ionic liquid under ambient conditions:A practical approach towards the synthesis of Fanetizole[J].Tetrahedron,2007,63:11066-1069.
[10] Oberlander H,Silhacek D L.Mode of action of insect growth regulators in Lepidopteran tissue culture[J].Pestic Sci,1998,54:300-302.
[11] Gaikwad N D,Patil S V,Bobade V D.Synthesis and biological evaluation of some novel thiazole substituted benzotriazole derivatives[J].Bioorg Med Chem Lett,2012,22:3449-3454.
[12] Ahmed M E,Abdel B A,Ghattas M T.Synthesis of some new biologically-activecoumarin derivatives[J].Il Farmaco,1999,54:56-63.
[13] 范志金,钟滨,王素华,等.1,3-二甲基-5-甲硫基-4-苯腙基羰基吡唑的合成及抑菌活性[J].应用化学,2003,20(4):365-367.
[14] Salem A A.Spectrophotometric and potentiometric characterization of some arylhydrazone derivatives and their applications in lanthanide determination[J].Microchem J,1998,60:51-66.
[15] Sayed L E,Iskander M F.Coordination compounds of hydrazine derivatives with transition metals[J].J Inorg Nucl Chem,1971,33:435-443.
[16] 聂丽,胡蕾,傅绪成,等.N-(2,4-二硝基苯基)-N-取代苯腙衍生物对阴离子识别研究[J].化学学报,2011,69(01):71-76.
[17] Chimenti F,Bizzarri B,Bolasco A,et al.Synthesis and biological evaluation of novel 2,4-disubstituted-1,3-thiazoles as anti-Candida spp.agents[J].Eur J Med Chem,2011,46:378-382.
[18] Kamble V T,Davane B S,Chavan S A,et al.An efficient and green procedure for the preparation of 2-{2-[N'-(2-hydroxybenzylidene)hydrazino]thiazol-4-yl}phenols[J].Aust J Chem,2007,60:302-304.
[19] 阿布拉江·克依木.新型含三唑及噻唑环的腙类化合物的合成及生物活性研究[J].有机化学,2011,31(5):724-727.
[20] Zhang D N,Li J T,Song Y L,et al.Efficient onepot three-component synthesis of N-(4-arylthiazol-2-yl)hydrazones in water under ultrasound irradiation[J].Ultrason Sonochem,2012,19:475-478.
[21] Pundeer R,Kiran V,Sushma O P,et al.An efficient synthesis of N-(1-arylethylidene)-N'-(4-arylthiazol-2-yl)hydrazones from α,α-dibromoacetophenones and N-(1-arylethylidene)thiosemicarbazones[J].Der Pharma Chemica,2011,3(3):109-114.
[22] Xing R J,Pan L,Wen X,et al.A practical and efficient procedure for the α-bromination of arylethanones[J].J Chin Phar Sci,2010,19:400-402.
[23] 阿布拉江·克依木.超声辐射下几种腙类化合物的合成研究[J].化学研究与应用,2011,23(8):1078-1082.

