丙酸质量浓度对丙酸富集培养物降解特性的影响
班巧英,李建政,张立国,张玉鹏,Ajay Kumar Jha,艾斌凌
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨;2.山西大学环境与资源学院,030006太原)
有机废水厌氧生物处理过程是一个复杂的微生物学过程,需要在水解发酵菌群、产氢产乙酸菌群和产甲烷菌群的协同作用下才能完成[1-2].丙酸是废水厌氧生物处理过程中重要的中间代谢产物之一,其厌氧氧化是一个高度吸能的生化反应,需要在丙酸氧化菌群和产甲烷菌群的协同作用下才能完成[1].因此,当厌氧消化系统遇到如有机负荷提高、pH下降等冲击时,丙酸很容易在厌氧生物处理系统中积累,导致厌氧生物处理系统运行效能和稳定性下降,严重时将导致系统的“酸化”[3-4].目前,关于导致厌氧生物处理系统中丙酸积累因素报道较多的是氢分压和pH值[3-4].也有研究者发现,当厌氧生物处理系统中丙酸质量浓度超过一定临界值后,系统内会出现丙酸的大量积累,进而导致厌氧反应器的“酸化”[5].为此,本文利用丙酸富集培养物,研究了不同丙酸质量浓度条件下丙酸富集培养物的降解特性,并通过静态摇瓶实验研究不同丙酸质量浓度对丙酸氧化菌和产甲烷菌代谢活性的影响,以期为阐明厌氧反应器中丙酸积累与反应器“酸化”之间的因果关系提供理论支持,为厌氧反应器运行提供参考.
1 实验
1.1 种泥来源
接种污泥是取自本实验室正在运行的处理制糖废水的厌氧折流板反应器(ABR)第3格室厌氧颗粒污泥.ABR第3格室为典型的丙酸氧化功能格室,其进水丙酸平均质量浓度为1 250 mg/L,出水丙酸平均质量浓度为240 mg/L,丙酸去除率为81%,污泥的比丙酸降解率为0.51 g/(g·d).
1.2 富集培养
富集培养在150 mL的血清瓶中进行.液体培养基由丙酸(唯一碳源)加基础培养基构成[6],其中丙酸质量浓度为1 000 mg/L.培养基初始pH控制在7.5.在氮气保护下将种泥接种到培养基中,然后置于35℃、150 r/min的空气浴恒温摇床中进行富集培养.当培养基中的丙酸去除率达95%以上时,将富集培养物转入到新鲜培养基.如此反复进行传代富集培养.
1.3DNA提取和PCR-DGGE分析
采用DNA提取试剂盒(MO Bio Laboratories,Inc.,Carlsbad,CA,USA)提取厌氧活性污泥总DNA;PCR及DGGE分析参照文献[7]进行.PCR所用引物分别为真细菌通用引物和古细菌通用引物,真细菌引物序列为:341F,5'-CCTACGGGAGGCAGCAG-3',带GC夹;907R,5'-CCGTC AATTCMTTTGAGTTT-3'.古细菌引物序列为:344F,5'-ACGGGGYGCAGCAGGC GCGA-3',带GC夹;915R,5'-GTGCTCCCCCGCCAAT TCCT-3'.测序结果与NCBI的BlastX进行序列比对,并挑选目标序列用MEGA 3.1软件构建系统发育树.
1.4 静态摇瓶实验
静态摇瓶实验采用间歇培养方式进行,实验容器采用150 mL的血清瓶.液体培养基由丙酸(唯一碳源)加基础培养基构成,其中丙酸质量浓度共设有1 000、1 500、2 000、2 500、3 000 mg/L 5个质量浓度梯度.每个血清瓶中加入40 mL培养基,10 mL丙酸富集培养物(MLVSS为1.1 g/L),培养基和接种物的体积比为4∶1.在35℃、150 r/min的空气浴恒温摇床中进行静态摇瓶实验.每个丙酸质量浓度梯度做3个平行样,数据分析取其平均值.每12 h测定一次产气量、气体组成,每24 h测定一次挥发酸组成及pH.
1.5 分析项目及方法
pH、生物量(以挥发性悬浮固体总量MLVSS计)采用国际标准方法测定[8],发酵产气量采用10~50 mL的玻璃注射器排气计量,并折算为标准状态体积(0℃,101.325 kPa).发酵气组分和挥发酸组成分别采用山东鲁南瑞虹化工仪器有限公司的SP-6800A型(TCD检测器)和SP6890型(FID检测器)气相色谱测定.累计产甲烷量参照Owen法进行计算[9].
2 结果与分析
2.1 富集培养物的菌群组成解析
丙酸是有机废水厌氧生物处理过程中重要的中间代谢产物之一,复杂有机物转化成甲烷时30%左右的甲烷来自丙酸的氧化[10].因此,强化厌氧消化系统中丙酸氧化菌群的代谢活性对于提高厌氧反应器运行效能及稳定性具有重要意义.本研究以丙酸为唯一碳源,经过15代连续传代富集培养后,得到一个中温互营丙酸氧化菌群.
如图1所示,富集之后的培养物以梭菌、杆菌和竹节状丝状菌为优势菌.为了进一步了解富集培养物中微生物的系统发育地位及其功能,采用PCR-DGGE指纹分析技术对富集前后微生物样品进行了群落结构解析(图2).从真细菌的DGGE图谱(图2(a))可以看出,富集培养后的微生物多样性有所下降.随着富集培养的进行,条带B1和B2的信号显著增强,表明这两个条带所代表的微生物被富集.条带B1和B2分别与Syntrophobacter sulfatireducens和S.wolinii的相似性为97%和95%(图3(a)).已有研究表明:在甲烷发酵系统中,S.sulfatireducens和S.wolinii可以与产甲烷菌构成产甲烷互营菌群,实现对丙酸的高效氧化[11-12].这个结果暗示了条带B1和B2所代表的微生物可能也可以与产甲烷菌互营共生降解丙酸.
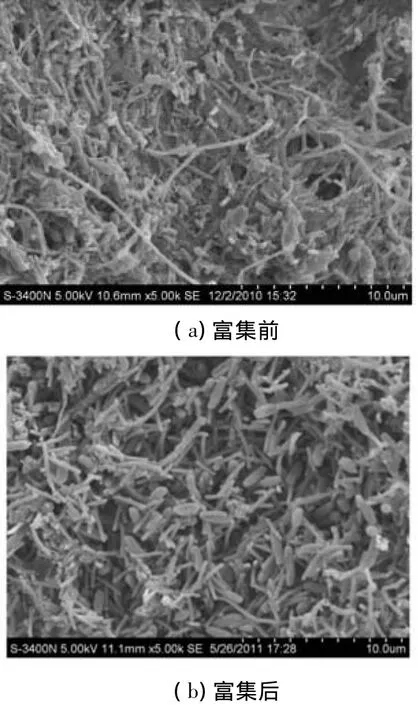
图1 丙酸富集前后污泥样品扫描电镜图片
在厌氧生物处理系统中,作为中间代谢产物的丙酸需要在产甲烷菌群的互营作用下转化为甲烷[1].因此,对富集前后的微生物样品也进行了古菌的16S rDNA PCR-DGGE指纹分析(图2(b))并构建了系统发育树(图3(b)).如图2(b)所示,在丙酸富集培养物中,条带A1、A2、A3和A4所代表的产甲烷菌为该富集培养物中的优势菌.其中,条带A1和A2与甲烷丝状菌Methanosaeta concilii的相似性在98%以上(图3(b)).M.concilii只能利用乙酸产生甲烷,是厌氧消化系统中优势产甲烷菌之一[13-14].而条带A3和A4与甲烷杆菌Methanobacterium beijingense高度相似,该菌只能利用氢气或甲酸产甲烷[15].
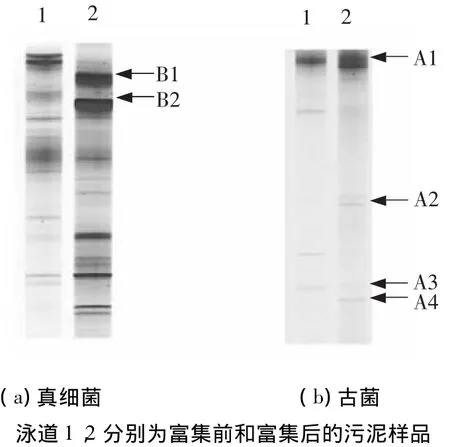
图2 丙酸富集前后污泥DGGE指纹分析
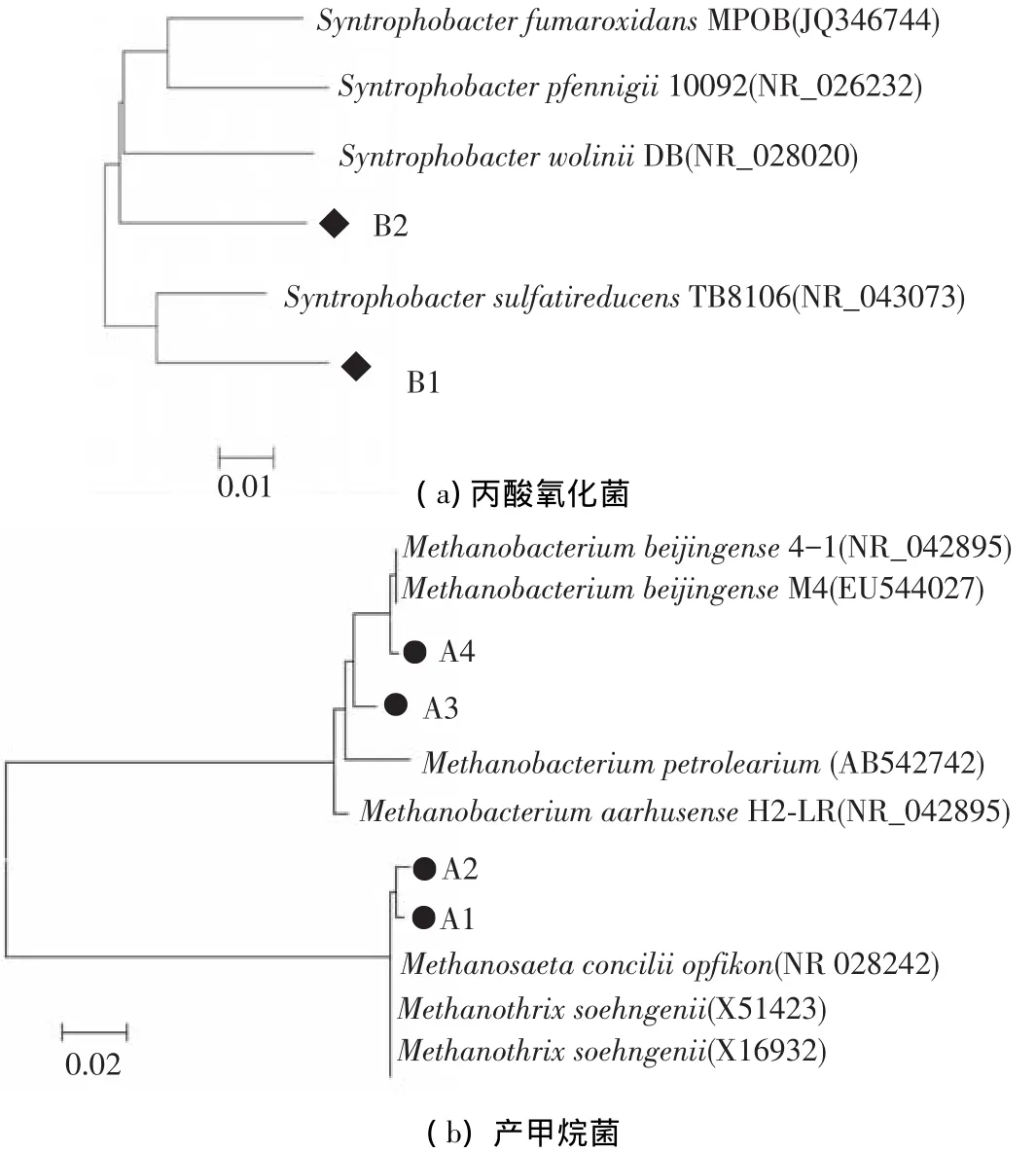
图3 富集培养物中丙酸氧化菌与产甲烷菌的系统发育关系
2.2 丙酸质量浓度对富集培养物降解特性的影响
如图4所示,在接种生物量(MLVSS)为0.81 g/L的条件下,当丙酸质量浓度小于2 000 mg/L时,该富集培养物表现出较强的降解丙酸的能力,在接种后的第8~10 d时,培养液中95%以上的丙酸被转化.然而,当丙酸质量浓度为2 500 mg/L时,富集培养物对丙酸的降解出现了明显的停滞期.在接种后的前6 d,丙酸降解速率很低,直到第8 d丙酸降解速率才逐步提高,在14 d后培养液中95%的丙酸才被降解.当丙酸质量浓度为3 000 mg/L时,该富集培养物对丙酸的降解速率显著下降,停滞期进一步延长.直到接种后的第14 d,培养液中丙酸质量浓度仍然保持在2 000 mg/L以上,丙酸去除率低于35.5%.该结果与Amani等[16]的研究基本一致,Amani等发现,在丙酸质量浓度为2 986 mg/L条件下的丙酸去除率较1 543 mg/L条件下降低了17%[16].本研究还发现丙酸质量浓度为3 000 mg/L条件下培养14 d后,丙酸降解速率逐渐恢复并在第20 d几乎降解完毕.
以上结果表明,培养液中较高丙酸质量浓度(≥2 500 mg/L)会对系统中丙酸氧化菌群的代谢活性产生抑制作用,导致系统中丙酸去除率明显下降.另外,在较高的丙酸质量浓度下,富集培养物对丙酸的降解具有明显的停滞期且随着丙酸质量浓度的提高而延长.在较高的丙酸质量浓度下,随着培养液中丙酸质量浓度的缓慢下降,丙酸质量浓度对互营丙酸氧化菌代谢活性的抑制会逐步解除.由此可见,较高质量浓度的丙酸对丙酸氧化菌代谢活性的抑制作用属于可逆抑制.
为了考察不同丙酸质量浓度下,培养液的pH变化可能对丙酸降解产生的抑制作用,对不同丙酸质量浓度培养液的pH随培养时间的变化进行了分析.由图5可以看出,在整个丙酸降解过程中,各丙酸质量浓度下的pH均维持在7.4~7.8.已有研究表明,pH7.4~7.8是多数丙酸氧化菌最适pH范围[12,17-18].由此可见,即使在适宜的pH范围内,较高的丙酸质量浓度也会对丙酸氧化菌的代谢活性产生直接的抑制作用.
2.3 累计产甲烷量
在产甲烷环境中,丙酸的转化主要依赖丙酸氧化菌群和产甲烷菌群的协同作用来完成.丙酸氧化菌将丙酸转化为产甲烷菌可利用的底物乙酸、H2/CO2;反过来,产甲烷菌通过清除丙酸降解的终产物推动丙酸氧化的进行[19].因此,产甲烷活性的高低对于丙酸的氧化十分重要.如图6所示,累计产甲烷量的变化趋势与丙酸降解过程一致.当丙酸质量浓度为1 000,1 500和2 000 mg/L时,在培养的前1 d就表现出较高的活性,并且分别在第5、第8、第10天时累计产甲烷量达到最大值.当丙酸质量浓度为2 500~3 000 mg/L时,培养前期产甲烷速率较其他实验组低,随着培养时间的延续逐渐提高.
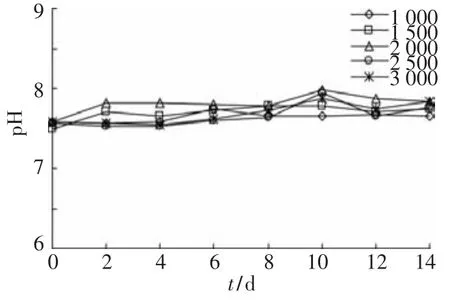
图5 不同丙酸质量浓度下pH变化
产甲烷菌根据可利用底物的不同分为嗜氢产甲烷菌和嗜乙酸产甲烷菌.在整个实验过程中,几乎检测不到H2积累,可见丙酸质量浓度的高低对于嗜氢产甲烷菌的活性没有显著的影响.当丙酸质量浓度为2 500和3 000 mg/L时,乙酸发生了短暂的积累(图6),表明高质量浓度的丙酸(>2 500 mg/L)会对嗜乙酸产甲烷菌的代谢活性产生抑制作用,且该抑制作用也属于可逆抑制,而高质量浓度的丙酸对嗜氢产甲烷菌代谢活性的影响不显著.
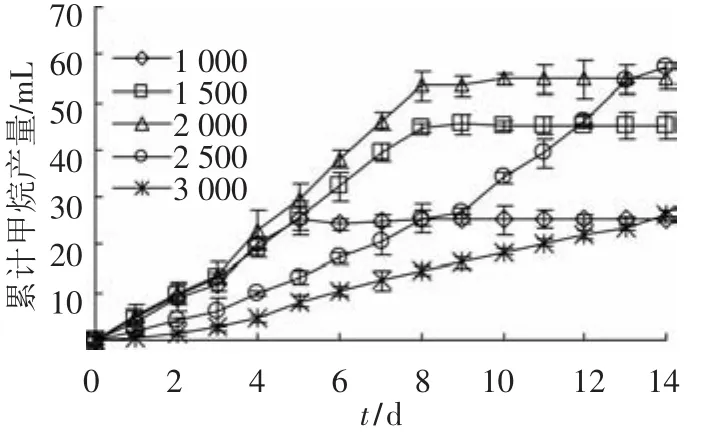
图6 不同丙酸质量浓度下累计甲烷产量历时曲线
结合图4~7可以看出,在pH适宜的条件下,较高质量浓度的丙酸会抑制丙酸氧化菌群的活性,同时会对嗜乙酸产甲烷菌群的活性造成影响.因此,在厌氧消化过程中必须尽可能避免丙酸的积累.另外,在pH适宜的条件下高质量浓度丙酸只能在一定程度上抑制丙酸氧化菌群的活性,但不会完全抑制,随着丙酸质量浓度的降低这种抑制会被解除.由此可见,高质量浓度的丙酸(>2 500 mg/L)对互营丙酸氧化菌代谢活性的抑制作用属可逆抑制.
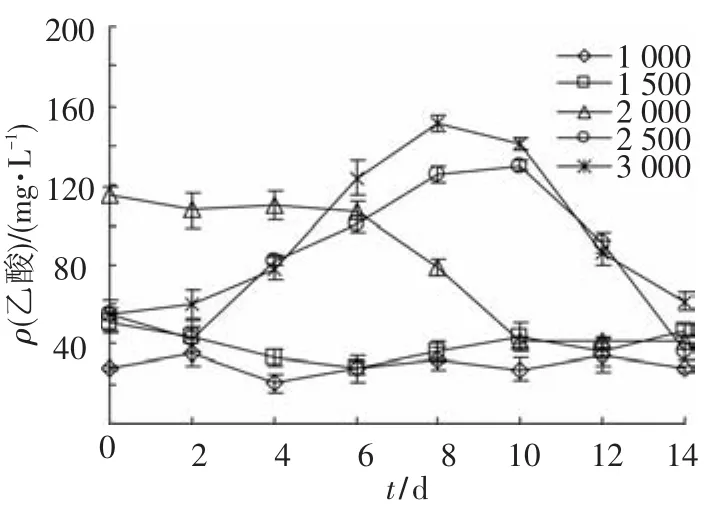
图7 不同丙酸质量浓度下乙酸的变化
3 结论
1)以ABR反应器第3格室厌氧颗粒污泥为种泥,丙酸为唯一碳源,在35℃条件下经过15代的连续传代培养,富集到以丙酸氧化菌(Syntrophobacter)和产甲烷菌(Methanosaeta concilii和Methanobacterium beijingense)为优势菌的富集培养物.
2)在中温(35℃)和中性(pH 7.4)条件下,高质量浓度的丙酸(>2 500 mg/L)会对丙酸氧化菌的代谢活性产生显著的抑制作用,且该抑制作用属于可逆抑制.而高质量浓度的丙酸对产甲烷菌代谢活性的影响不明显.
[1]LI J,BAN Q,ZHANG L,et al.Syntrophic propionate degradation in anaerobic digestion:a review[J].International Journal of Agriculture and Biology,2012,14(5):843-850.
[2]JHA A K,LI J,LORING N,et al.Research advances in dry anaerobic digestion process of solid organic wastes[J].Africa Journal of Biotechnology,2011,10(65):14242-14253.
[3]INANC B,MATSUIS,IDE S.Propionic acid accumulation and controlling factors in anaerobic treatment of carbohydrate:effects of H2and pH[J].Water Science and Technology,1996,34:317-325.
[4]任南琪,赵丹,陈晓蕾,等.厌氧生物处理丙酸产生和积累的原因及控制对策[J].中国科学:B辑,2002,32(2):83-89.
[5]DHAKED R K,WAGHMARE C K,ALAM S I,et al.Effect of propionate toxicity on methanogenesis of night soil at phychrophilic temperature[J].Bioresource Technology,2003,87:299-303.
[6]ANGELIDAKI I,SANDERS W.Assessment of the anaerobic biodegradability of macropollutants[J].Reviews in Environmental Science and Biotechnology,2004,3:117-129.
[7]WAN C,DU M,LEE D,et al.Electrokinetic remediation and microbial community shift of βcyclodextrin-dissolved petroleum hydrocarboncontaminated soil[J].Applied Microbiologyand Biotechnology,2011,89(6):2019-2025.
[8]American Public Health Association.Standard methods for the examination of water and wastewater[M].Washington,DC:[s.n.],1995.
[9]OWEN W F,STUCKEY D C,HEALY J B,et al.Bioassay for monitoring biochemical methane potential and anaerobic toxicity[J].Water Research,1979,13:485-492.
[10]R.E.斯皮斯,著.工业废水的厌氧生物处理技术[M].李亚新,译.北京:中国建筑工业出版社,2001.
[11]BOONE D R,BRYANT M P.Propionate-degrading bacterium,Syntrophobacter woliniisp.nov.gen.nov.,from methanogenic ecosystems[J].Appliedand Environmental Microbiology,1980,40:626-632.
[12]CHENS,LIUX,DONGX.Syntrophobacter sulfatireducenssp.nov.,anovelsyntrophic,propionate-oxidizing bacterium is olated from UASB reactors[J].International Journal of System and Evolutionary Microbiology,2005,55:1319-1324.
[13]KEYSER M,WITTHUHN R C,LAMPRECHT C,et al.PCR-based DGGE fingerprinting and identification of methanogens detected in three different types of UASB granules[J].System and Applied Microbiology,2006,29:77-84.
[14]LIU Y,WHITMAN W B.Metabolic,phylogenetic,and ecological diversity of the methanogenic archaea[J].Annals of the New York Academy of Sciences,2008,1125:171-189.
[15]MA K,LIU X,DONG X.Methanobacterium beijingensesp.nov.,a novel methanogen isolated from anaerobic digesters[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(1):325-329.
[16]AMANI T,NOSRATI M,MOUSAVI S M,et al.Study of syntrophic anaerobic digestion of volatile fatty acids using enriched cultures at mesophilic conditions[J].International Journal of Environmental Scienceand Technology,2011,8:83-96.
[17]WALLRABENSTEIN C,HAUSCHILD E,SCHINK B.Syntrophobacter pfennigiisp.nov.,new syntrophically propionate-oxidizing anaerobe growing in pure culture with propionate and sulfate[J].Archives of Microbiology,1995,164:346-352.
[18]HARMSEN H J M,KUIJK van B L M,PLUGGE C M,et al.Syntrophobacter fumaroxidanssp.nov.,a syntrophic propionate-degrading sulfate-reducing bacterium[J].International Journal of Systematic Bacteriology,1998,48:1383-1387.
[19]WORM P,STAMS A J M,CHENG X,et al.Growth and substrate-dependent transcription of for mate dehydrogenase and hydrogenase coding genes inSyntrophobacter fumaroxidansandMethanospirillum hungatei[J].Microbiology,2011,157:280-289.

