金属离子对冷冻法生产大豆蛋白的影响
谭顺丹,韩建春,刘敬媛,姜 帆
(东北农业大学食品学院,黑龙江哈尔滨150030)
我国是大豆的故乡。据报道,早在公元前2560年就已有大豆种植[1]。大豆有很高的营养价值,含有约40%的蛋白质、居各类植物蛋白质之首,大豆蛋白质中含有18种氨基酸,其营养价值很高,有“完全蛋白质食物”之称。由于大豆蛋白质的营养性,催生了大豆深加工,如分离蛋白、浓缩蛋白等[2]。目前大豆蛋白加工方法大多为物理或化学方法,如:通过加热、酸法、醇法来破坏其蛋白质的二级键,达到分离、沉淀的效果[3-4]。但这些工艺,对蛋白质的功能性影响较大且产量较低[5-6]。有国外报道:当大豆蛋白被冷冻或酸沉,其蛋白质变得部分不溶[5]。这是由于二硫键的存在,使蛋白质分子的内部结构发生改变,从而蛋白质分子生产聚合,最终蛋白质颗粒加强,沉淀生产[7-8]。冷冻能从积极方面促进蛋白质的沉淀。有研究表明,在大豆蛋白溶液中加入某些金属无机盐,会增加蛋白的沉淀量,提高蛋白质的含量[9]。因此本实验是对不同种类、不同浓度的金属离子对冷冻大豆蛋白溶液生产大豆蛋白含量的影响研究,并对其产品的溶解性和持水性影响做了分析讨论。
1 材料与方法
1.1 材料与仪器
低温脱脂豆粕 过100目筛,水分7.8%,蛋白质48.75%,哈高科;氯化钙、氯化钠、氯化镁 均为分析纯。
电子天平 上海民桥精密仪器有限公司;数字式搅拌机 金坛市医疗仪器厂;恒温水浴锅 上海一恒科技有限公司;pH计 梅特勒-托利多仪器有限公司;低温高速离心机 日本日立(HITACHI)公司;冰箱 青岛澳柯玛股份公司;凯氏定氮仪 福斯公司。
1.2 实验方法
1.2.1 大豆蛋白的制备工艺 称取一定量的低温脱脂豆粕,粉碎过筛后,与一定比例的蒸馏水混合配成蛋白质溶液,将该溶液加热至温度为50℃时,加入盐酸将溶液的pH调至5。然后放入-18℃的冰箱中冷冻24h,再在5℃的冰箱中将其完全融化,离心分离后,测量沉淀物中蛋白质的含量。
选取单因素条件为:温度50℃,脱脂豆粕∶水的固液比分别为1∶10、1∶20、1∶30、1∶40、1∶50时,加入盐酸调节pH5后,测定蛋白质含量。
固液比1∶20,温度分别为为30、40、50、60、70、80℃时,加入盐酸调节pH5后,测定蛋白质含量。
固液比1∶20,温度50℃,加入盐酸调节pH为4.5、5、5.5、6、6.5、7、7.5、8后,测定蛋白质含量。
1.2.2 不同金属离子对大豆蛋白含量的影响 在固液比为1∶20、温度50℃、pH5.5的条件下,分别加入不同浓度的NaCl、CaCl2、MgCl2溶液后,放入-18℃的冰箱中冷冻24h,再在5℃的冰箱中将其完全融化,离心分离后,测量沉淀物中蛋白质的含量。
1.2.3 功能性测定
1.2.3.1 溶解性的测定[10]蛋白质的溶解性用氮溶解指数(NSI)表示。准确称取1.0g的沉淀蛋白质,加入20mL蒸馏水,用pH调节至7.0(调节液为0.2mol/L的HCl溶液或者0.2mol/L的NaOH溶液),之后搅拌45min,过滤并用蒸馏水冲洗,用常量凯氏定氮法测定滤液中蛋白质的含氮量。总氮含量用凯氏定氮法测定,并按以下公式计算NSI:

1.2.3.2 持水性的测定[11]持水性也叫保水性,通常用水分残存率来表示。准确称取1.0g的沉淀,溶于一定量的蒸馏水中,定容至100mL。然后量取1mL样液,将其平铺在10cm的培养皿中,置于恒温恒湿的培养箱中,每隔10min测一次样液的水分残存率。
2 结果与分析
2.1 大豆蛋白制备方法的确定
2.1.1 不同固液比对冷冻法生产大豆蛋白的影响固液比影响着大豆蛋白从溶液中分离时的效率,也影响着最终蛋白质的回收率。由图1可知,随着固液比的增加,蛋白质含量没有明显的变化,但是考虑到生产成本和有利于实验操作,因此,本实验选取低温脱脂豆粕和水的固液比为1∶20。

图1 固液比对大豆蛋白含量的影响Fig.1 Effect of solid-liquid ratio on soybean protein content
2.1.2 不同加热温度对冷冻法生产蛋白质的影响调节加热温度,观察冷冻法生产大豆蛋白质的影响情况,结果表明,温度越高,生产的蛋白质沉淀量越多。由图2可知,随着温度的增加,蛋白质含量增加,由于温度55℃时蛋白质开始变性,温度每提高10℃,蛋白质变性速度加速600倍。温度的提高,蛋白质的热变性程度逐渐增加。且当温度升高到60℃以上,蛋白质极易发生热变性,且加热变性是不可逆过程,会影响蛋白质的功能特性。因此,本实验选取加热温度为50℃。

图2 加热温度对大豆蛋白质含量的影响Fig.2 Effect of heated temperature on soybean protein content
2.1.3 不同pH对冷冻法生产蛋白质的影响 当pH处于等电点时,大豆蛋白分子不带电荷,分子之间的作用力大于与水的作用力,相互聚集沉淀。由图3可知,随着pH慢慢降低,蛋白质的含量逐步增加。在pH4.5和pH5时,蛋白质的含量相差不大,但考虑到实验实际操作性,因此,本实验选取pH为5。

图3 pH对大豆蛋白质含量的影响Fig.3 Effect of pH on soybean protein content
通过以上实验,确定了冷冻法生产大豆蛋白的最佳条件:固液比1∶20、加热温度50℃、pH为5。
2.2 金属离子对大豆蛋白的影响
2.2.1 NaCl对大豆蛋白含量的影响 分别选择加入0、0.02、0.04、0.06、0.08、0.10mol/L NaCl在冷冻前加入,采用2.1的实验条件,观察测定生产沉淀的蛋白质含量。NaCl对大豆蛋白含量的影响见图4。

图4 NaCl添加量对大豆蛋白含量的影响Fig.4 Effect of NaCl addition on soybean protein content
由图4可知,金属离子的加入一定程度上增加了蛋白质分子的电荷密度,影响了氢键作用,从而影响肽链对水的束缚,使水分子更多地以可自由移动的自由水和中间水形态存在;另一方面,对蛋白的静电屏蔽作用增强,从而使得大豆蛋白分子之间的斥力进一步降低,引力增加,相互结合的速率加快,快速聚集沉淀。由图4可知,随着NaCl浓度的增加,沉淀蛋白质含量逐渐提高,由29.6%提高到60.9%。
2.2.2 CaCl2对大豆蛋白含量的影响 分别选择加入0、0.1、0.02、0.03、0.04、0.05mol/L CaCl2在冷冻前加入,采用2.1的实验条件,观察测定沉淀生产的蛋白质含量。结果如图5所示。

图5 CaCl2添加量对大豆蛋白含量的影响Fig.5 Effect of CaCl2addition on soybean protein content
由图5可知,在CaCl2无添加的情况下,冷冻沉淀后的蛋白质含量很少。随着CaCl2添加量的增加,蛋白质含量随之提高。由于大豆蛋白溶液对于Ca2+非常敏感,显著降低其的溶解度,因此在Ca2+浓度达到一定程度时,大豆蛋白将会聚集沉淀下来。由图5和图4比较可以看出,CaCl2对蛋白质的聚集沉淀作用较NaCl强,其结果基本符合霍夫曼斯特离子序。
2.2.3 MgCl2对大豆蛋白含量的影响 分别选择加入0、0.1、0.02、0.03、0.04、0.05mol/L MgCl2在冷冻前加入,采用2.1的实验条件,观察测定沉淀生产的蛋白质含量。MgCl2对大豆蛋白含量的影响见图6。
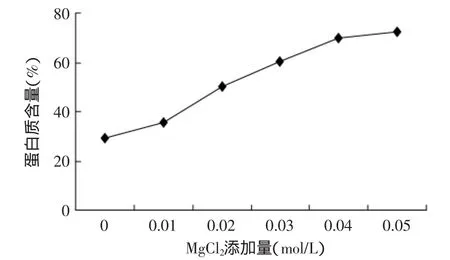
图6 MgCl2添加量对大豆蛋白含量的影响Fig.6 Effect of MgCl2addition on soybean protein content
由图6可知,随着金属离子的加入,逐渐打破蛋白质分子间的斥力和引力的平衡,过多的负电荷被屏蔽,分子间静电斥力相当小,疏水相互作用、氢键相互作用等引力占明显优势,因此蛋白分子相互结合的速率相当快,容易聚集在一起,很快沉淀。由图6可以看出,随着MgCl2的添加量的增加,蛋白质含量也随之增大。从图6和图5对比可以看出,MgCl2的添加和CaCl2的添加效果类似,随着浓度的增加,其蛋白质含量逐步的提高。
2.3 三种金属离子对产物蛋白质功能性的影响
2.3.1 三种金属离子对产物大豆蛋白溶解性的影响
本实验中三种金属离子加入到大豆蛋白溶液中冷冻处理并生产蛋白质,考察他们对产物大豆蛋白溶解性的影响。结果见图7。
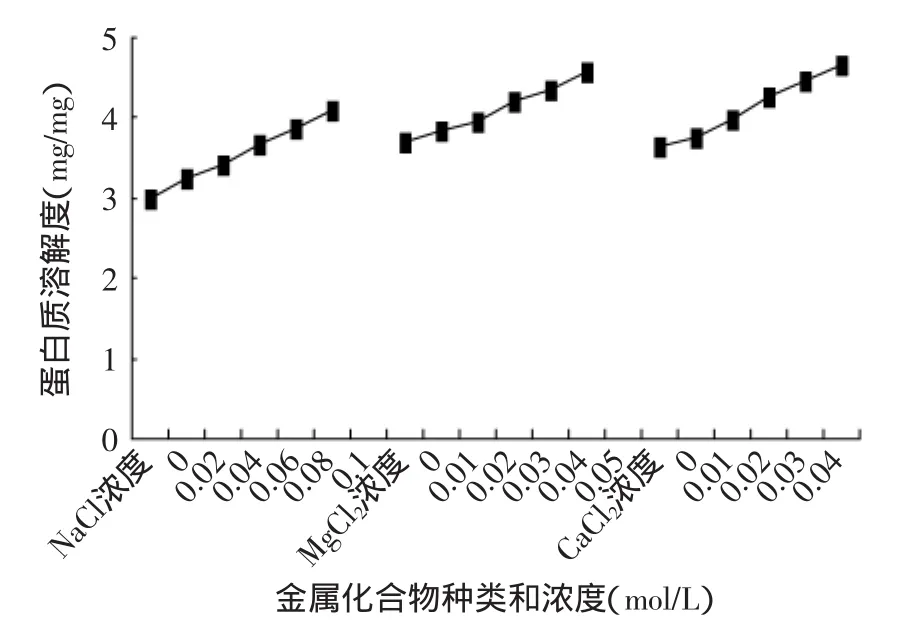
图7 三种金属化合物对产物蛋白质溶解性的影响Fig.7 Effect of three kinds of metal compound on solubility of protein
由图7可以看出,金属离子的加入能提高蛋白质的溶解度,随着金属离子浓度增加,其溶解度增大。在0.02mol/L和0.04mol/L添加量时,添加氯化钠生产的蛋白质溶解小于氯化镁和氯化钙的蛋白质。这是因为金属盐对蛋白质溶解度具有特异的离子效应,具有相同离子强度的盐溶液对蛋白质溶解度的相对影响遵循了霍夫曼斯特离子序。
2.3.2 三种金属离子对产物大豆蛋白持水性的影响
本实验加入三种金属离子到大豆蛋白溶液中并生产蛋白质,考察他们对大豆蛋白持水性的影响。具体结果见图8。

图8 三种金属化合物对产物蛋白质持水性的影响Fig.8 Effect of three kinds of metal compound on water-retaining property of protein
由图8可以得出,添加NaCl生产的蛋白质持水性随着浓度的增大而减小,而MgCl2和CaCl2的添加随着浓度的增加持水性增加。在相同的浓度下,MgCl2生产的蛋白质持水性均高于CaCl2。金属离子可以影响蛋白质与水的结合能力。在金属离子浓度较低时,可以提高蛋白质结合水的能力,这是由于水合盐离子与蛋白质分子上带电荷基团微弱结合而造成的。添加NaCl生产的蛋白质持水性随着浓度的增大而减小的原因,可能是由于钠离子的离子半径与其他两种离子的不同,导致与蛋白质与水的结合强度不同。
3 结果与讨论
有研究表示,当大豆蛋白溶液被冷冻后,其蛋白质变得不溶。由于二硫键的形成,使蛋白质分子内部结构发生改变,从而蛋白质分子生产聚合,最终蛋白质颗粒加强,沉淀生产。很多国外研究发现,冷冻大豆蛋白溶液能够从积极方面促进大豆蛋白质的沉淀。而如果在冷冻大豆蛋白溶液中添加某些无机盐,会增加大豆蛋白的沉淀数量,即提高蛋白质含量。一般来说,金属离子在适当浓度条件下,有利于中和大豆蛋白表面负电荷,降低肽链间静电斥力,使得大豆分离蛋白分子间相互排斥力大于吸引力,有利于肽链之间相互接近和凝聚,因此适当金属离子浓度可以提高大豆蛋白含量[12]。
本实验显示,随着金属离子的加入,冷冻大豆蛋白溶液生产蛋白质的含量提高,与不加入金属离子相比,其含量有了显著的增加。以加入NaCl的大豆蛋白溶液为例,冷冻沉淀蛋白质含量由29.6%提高到60.9%。且添加不同金属例子的加入,其沉淀的蛋白质含量也有所不同。功能性实验表明,产物蛋白质的溶解性随着金属化合物溶液浓度的增加而增大,持水性方面是氯化钠随着浓度的增大而降低,氯化镁和氯化钙随着浓度的增大而增加。
[1]赵文伟,吴东根.大豆的营养价值和加工利用[J].现代农业科技,2007,24(6):124-126.
[2]谭荫初.大豆的价值与豆腐的食用[J].中国土特产,2000,12(4):30-32.
[3]左进华,董海洲,侯汉学.大豆蛋白生产及应用现状[J].粮食与油脂,2007,18(5):12-14.
[4]E J Noh,C Kang,S T Hong,et al.Freezing of soybean influences the hydrophobicity of soy protein[J].Food Chemistry,2006,97(10):212-216.
[5]J Noh,S Y Park,S T Hong,et al.Coagulation of soymilk and quality of tofu as affected by freeze treatment of oybeans[J].Food Chemistry,2005,91(12):715-721.
[6]Hashizume,K Kakiuchi,K Koyama,et al.Denaturation of soybean by freezing[J].Agriculture and Bilogical Chemistry,1971,35(8):449-459.
[7]Maria C P,Maria C A.Structural properties of heat-induced soy bean gels as affected by ionic strength and pH[J].J Agric Food Chem,1998,46(6):3583-3589.
[8]王南,韩建春.冷冻对于大豆蛋白溶液的影响[J].食品工业,2011,12(3):50-51.
[9]江苏新医学院编.中药大辞典[M].上海:上海科技出版社,1986:1439-1441.
[10]胡志河,安涛.金属离子和pH对菜籽蛋白溶解性及持水性的影响[J].食品科学,2000,10(2):12-14.
[11]连喜军,鲁晓翔.pH和金属离子对大豆分离蛋白凝胶形成的影响[J].肉品工业,2006,12:30-33.
[12]翁迪,段文达.金属离子对大豆蛋白凝胶形成的影响[J].食品工业科技,2009,14(3):71-74.

