氯化血红素对大鼠肺微血管内皮细胞氧化损伤的保护作用
宗俊青 马 捷
1.山西医科大学,山西太原 030001;2.山西医科大学第二医院心胸外科,山西太原 030001
氯化血红素对大鼠肺微血管内皮细胞氧化损伤的保护作用
宗俊青1马 捷2▲
1.山西医科大学,山西太原 030001;2.山西医科大学第二医院心胸外科,山西太原 030001
目的 探讨氯化血红素(hemin)对过氧化氢(H2O2)诱导大鼠肺微血管内皮细胞(PMVECs)氧化应激损伤的保护作用。 方法①应用SD雄性大鼠的肺组织,进行大鼠PMVECs的原代培养并传代培养;通过倒置显微镜观察其形态,Ⅷ因子相关抗原免疫荧光鉴定。②应用H2O2构建PMVECs氧化应激损伤模型,并用hemin与H2O2共同孵育PMVECs。③采用MTT比色法检测各组细胞活力变化,用比色法检测内皮细胞培养上清液中乳酸脱氢酶(LDH)的含量,Western-blot检测各组内皮细胞微管相关蛋白1轻链3(LC-3)含量。 结果 ①体外培养的大鼠PMVECs呈梭形或多角形,形成单层后呈典型的鹅卵石样或铺路石样排列,免疫荧光检测FITC标记的Ⅷ相关抗体呈阳性,阳性率90%以上,成功建立了PMVECs的原代培养方法;②H2O2使内皮细胞活力下降,且呈剂量依赖性,200 μmol/L H2O2内皮细胞活力下降50%左右;③H2O2组LDH含量均高于hemin组及正常对照组(P<0.05),hemin组LC-3的表达显著低于H2O2组。 结论 低浓度hemin对H2O2诱导的PMVECs氧化应激损伤有保护作用,这种作用可能与hemin抑制H2O2诱导内皮细胞过度自噬有关。
氯化血红素;肺微血管内皮细胞;过氧化氢;自噬
肺损伤常发生在体外循环、心肺联合移植、肺切除、肺栓塞、复张性肺水肿、休克及心肺复苏等多种临床情况下。在各种原因引起的肺损伤中,肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs)是活性氧类的重要靶细胞之一。PMVECs构成半选择性屏障,该屏障对于肺气体交换,调节液体和可溶物在血液与肺间质之间的流动具有重要意义。虽然肺微血管内皮和肺大血管内皮之间有一定相似的功能和表型,但是并不完全相同。文献报道微血管和大血管表型和功能有显著不同[1]。因此,发现和探讨一种新的保护PMVECs的方法,对治疗内皮损伤以及由此引发的各种疾病具有重要意义。研究经证实低浓度的氯化血红素(hemin)可诱导细胞产生血红素氧合酶,从而起到抗氧化损伤及抗凋亡的作用。
近年来自噬(autophagy)的研究不断升温且研究也在逐渐深入。自噬是细胞将受损、变性的蛋白质以及损伤细胞器运输到溶酶体进行消化降解,以胞质内出现自噬体为特征的细胞自我消化过程,是细胞应激情况下用来维持细胞内环境稳定和存活的重要机制[2-3],同时过度的自噬也会对细胞有损伤作用最终使细胞凋亡。因此,对影响血管内皮细胞过度自噬相关因素的了解及其相关机制的研究,对维持血管内皮细胞的存活及功能有重要的作用。本实验通过建立大鼠PMVECs体外培养模型,观察H2O2在RPMVECs氧化应激损伤中的作用及hemin的保护作用,并对其自噬水平进行了初步探讨。
1 材料与方法
1.1 材料与试剂
内皮细胞特制培养体系(含500 ml基础培养基,25 ml胎牛血清及5ml内皮细胞生长添加物和5 ml青霉素/链霉素)购于ScienCell公司;兔抗鼠Ⅷ相关抗原购于北京中杉金桥公司;低糖DMEM培养基购于Hyclone公司;FITC标记的羊抗兔IgG购于北京博奥森公司;特级胎牛血清购于GIBCO公司;乳酸脱氢酶(LDH)试剂盒为碧云天产品;二甲基亚砜(DMSO)、氯化高铁血红素购于Sigma公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG和兔抗鼠β-actin抗体购于中杉金桥公司;兔抗鼠内皮细胞微管相关蛋白1轻链 3(LC-3)B 抗体购于 Cell Signaling Technology(CST)公司。
1.2 内皮细胞的培养和鉴定
选重150~200 g健康SD雄性大鼠。10%的水合氯醛腹腔注射麻醉。将整个大鼠泡于75%的乙醇中5~10 s,在超净工作台上,剪下心肺组织放入盛有含青霉素和链霉素各100 U/ml的D-Hanks中冲洗。洗净血迹。用眼科剪尽量剪去肺脏表面的脏层胸膜。剪成1 mm3大小的组织块。将剪好的组织块接种于25 cm2的无菌培养瓶中,将培养瓶倒置放入培养箱中,干贴壁2 h左右后,翻转培养瓶加入约3 ml含20%血清的完全培养液。培养12~16 h时轻轻换液,以去除血细胞。继续培养约40 h后取出组织块,同时换液,继续培养2~3 d待细胞融合成单层约80%时传代。取用3~4代细胞进行后续实验。内皮细胞鉴定采用免疫荧光法鉴定,抗体为兔抗鼠Ⅷ因子一抗和FITC羊抗兔二抗对细胞鉴定。
1.3 MTT法测定H2O2对内皮细胞的损伤
实验分 5 组(对照组,H2O2100 μmol/L 组,H2O2200 μmol/L组,H2O2500 μmol/L 组,H2O2800 μmol/L 组),每组 6 个复孔,各组都孵育4 h后,弃去原培养基,每孔加入5 mg/ml的MTT 20 μl,继续培养 4 h,吸出原液。 加入 100 μl的 DMSO原液,振荡10 min,待结晶完全溶解后用酶标仪于490 nm波长处测定吸光值(OD值),实验重复3次。
1.4 乳酸脱氢酶的测定
实验分 5 组(对照组,200 μmol/L H2O2组,2.5 μmol/L hemin+200 μmol/L H2O2组 ,5 μmol/L hemin+200 μmol/L H2O2组,10 μmol/L hemin+200 μmol/L H2O2组)取 2~4 代生长良好的内皮细胞,同步化12 h后。取上清液,按乳酸脱氢酶测试盒的方法测定培养液中的LDH释放量。
1.5 细胞LC-3表达水平的测定
分组及处理同前,Western-blot测定各组细胞LC-3蛋白表达情况。提取各组细胞中的总蛋白,调整上样量100 μg/孔,用5%浓缩胶和12%的分离胶电泳分离蛋白质,转移至硝酸纤维素膜上,5%的脱脂奶粉封闭后依次加入兔抗鼠 LC-3B 抗体(1∶1000)和兔抗鼠 β-actin 抗体(1∶1000)。4℃过夜,洗涤后加入辣根过氧化物酶标记羊抗兔二抗(1∶2500),洗膜后超敏发光液显色。
1.6 统计学方法
采用SPSS 16.0统计软件进行数据分析,实验数据均以均数±标准差(±s)表示,采用单因素方差分析,多重比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肺微血管内皮原代细胞的鉴定
倒置相差显微镜下观察肺组织块贴于培养瓶壁后,血细胞立即从肺组织块边缘向四周游出,24 h左右PMVECs游出,60 h左右去掉组织块可以获得只有少量血细胞和血管内皮细胞的混合物。原代细胞生长3~6 d后可融合形成细胞单层,细胞呈鹅卵石镶嵌状排列(图1),再培养3 d时见有血管腔样结构形成(图2)。

图1 大鼠PMVECs去除组织块第5天(×100)

图2 再培养3 d时见有血管腔样结构形成(×200)
2.2 免疫荧光鉴定
Ⅷ因子相关抗原免疫荧光染色后细胞浆内有绿色荧光,证实所培养的细胞为内皮细胞(图3)。
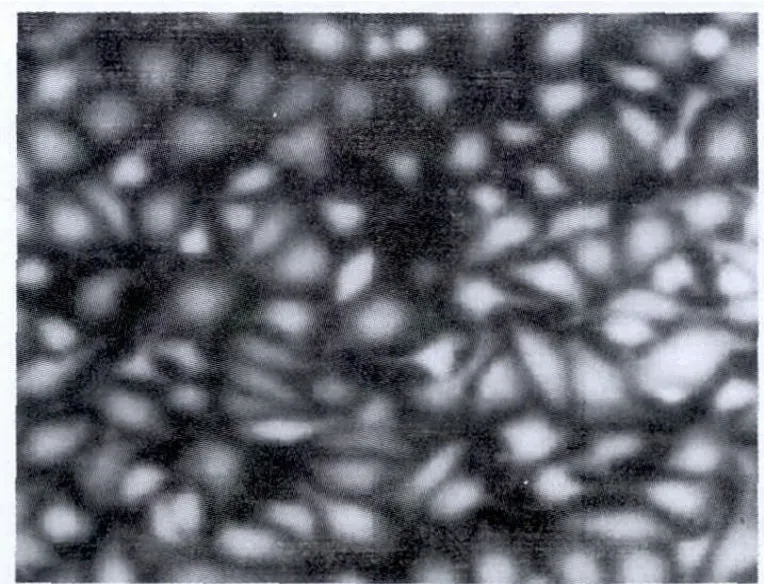
图3 第3代肺微血管内皮细胞免疫荧光染色阳性(×200)
2.3 内皮细胞生长抑制率的比较
MTT测定半数抑制率,细胞抑制率随H2O2浓度增大而增大(测3次取平均值)(表1)。
表1 内皮细胞生长抑制率的比较(%,±s)

表1 内皮细胞生长抑制率的比较(%,±s)
选取200 μmol/l H2O2作后续实验
组别抑制率100 μmol/L H2O2 组200 μmol/L H2O2 组500 μmol/L H2O2 组800 μmol/L H2O2 组34.0±7.2 49.0±8.4 73.0±11.7 80.0±8.2
2.4 各组内皮细胞LDH的比较
H2O2组LDH释放量较正常组明显升高(P<0.05),经hemin处理后的内皮细胞LDH释放量明显低于H2O2组(P<0.05)(表 2)。
表2 各组内皮细胞LDH的比较(U/L,±s)

表2 各组内皮细胞LDH的比较(U/L,±s)
与对照组比较,#P<0.05,与 200 μmol/L H2O2组比较,*P<0.05
组别LDH对照组200 μmol/L H2O2 组200 μmol/L H2O2+2.5 μmol/L hemin 组200 μmol/L H2O2+5 μmol/L hemin 组200 μmol/L H2O2+10 μmol/L hemin 组71.31±11.54*516.45±20.59#446.77±26.19#*361.69±27.12#*307.14±17.35#*
2.5 Western-blot检测细胞LC-3蛋白的表达
H2O2组LC-3Ⅱ/LC-3Ⅰ的表达量明显高于对照组(P<0.05),经各浓度hemin组处理的内皮细胞蛋白LC-3Ⅱ/LC-3Ⅰ的量明显低于H2O2组,且有一定的剂量依赖性(P<0.05)。5,10 μmol/L hemin 组 LC-3Ⅱ/LC-3Ⅰ表达量明显低于2.5 μmol/L 组(P<0.05)(图 4、表 3)。

图4 Western-blot检测细胞LC-3蛋白表达结果

表3 各组LC-3Ⅱ/LC-3Ⅰ蛋白表达情况的比较
3 讨论
目前,用于血管内皮细胞培养的方法主要有酶消化法、组织块法、机械刮取法等,其中酶消化法主要用于大血管内皮细胞的培养且常混有成纤维细胞、平滑肌细胞等杂细胞[4]。组织块种植法培养大鼠PMVECs,因其简便、高效而在国内应用较广。本研究采用大鼠肺组织贴块法成功地培养出PMVECs。通过应用内皮细胞专用培养基和加用肝素使内皮细胞纯化,差速消化法等措施来防止杂细胞的污染。此法能避免机械损伤和化学损伤,且不需特殊设备,操作简单。研究结果显示培养5~7 d内皮细胞可达一定的细胞密度,融合成片状,这与相关文献[5-6]报道一致。通过组织块的来源,倒置相差显微镜下观察细胞生长情况、细胞形态以及免疫荧光鉴定证实,培养获得的细胞为大鼠肺微血管内皮细胞。
自噬是指细胞内受损、变性或衰老的蛋白质和细胞器被运输到溶酶体,溶酶体对其消化降解的过程。Ashford等[7]在小鼠肝细胞中观察到细胞自噬现象。通常情况下细胞保持着轻度自噬以保持内环境的稳态,维持生存;但过度自噬会破会这种平衡使细胞死亡[8]。同时凋亡和自噬保持着动态平衡,即自噬可能为凋亡所需,自噬通常先于凋亡,进而启动凋亡;自噬亦可能抑制凋亡作用,可保护细胞免于发生凋亡和坏死;自噬还可能向凋亡转化,共同促进细胞死亡;以上都说明自噬与细胞生存有密切联系。最近研究发现自噬在肺动脉高压及乳腺癌中也起着重要作用[9-10],同时越来越多的研究证实自噬在许多疾病的发生和发展中起着重要的作用。
自噬形成过程中,多种自噬相关基因(ATG)参与自噬泡的形成,而LC-3修饰过程对自噬泡的形成必不可少,均与自噬泡的形成息息相关。而LC-3Ⅱ是自噬体的标志分子。所以本实验把LC-3Ⅱ作为评价自噬水平的标志分子。
hemin属于血红素的一种,目前发现其具有广泛的生物学效应。有研究发现hemin可以降低原发性高血压大鼠的血压[11],也可以减轻由于缺氧导致的肺动脉高压[12]。Togane[13]等人发现hemin可以对抗球囊损伤模型对血管平滑肌的损伤。hemin对血管系统的保护作用机制未明确,可能与其诱导HO-1的合成有关。HO-1可以明显的抑制炎症因子MMP-9、IL-6和TNF-α等的表达。HO-1的抗炎作用很大程度上是由HO-1分解血红素的产物一氧化碳介导的[14]。但是,其对H2O2诱导损伤的内皮细胞是否具有保护作用以及对细胞自噬水平的影响并不完全清楚。
H2O2能够穿透细胞膜进入细胞,从而造成DNA链断裂,导致细胞损伤以及使细胞凋亡[15],过度的H2O2能诱导自噬性细胞死亡,H2O2诱导的自噬性细胞存活和死亡之间的关系仍待于进一步研究。本实验中H2O2损伤组中LDH及LC3-Ⅱ含量均明显升高,表明H2O2有引起内皮细胞损伤,抑制细胞的增殖代偿的能力。同时可以诱导内皮细胞提高自噬活性。而用低浓度hemin处理可降低其LDH及LC-3Ⅱ含量,表明hemin可明显减轻 H2O2引起的活性氧簇,对内皮细胞损伤有保护作用,而这种保护作用可能是与hemin抑制了内皮细胞的过度自噬有关。
[1]Magee JC,Stone AE,Oldham KT,et al.Isolation,culture,and characterization of rat lung microvascular endothelial cells[J].Am J physiol,1994,267(4Pt1):L433-L441.
[2]Lee J,Giordano S,Zhang J.Autophagy,mitochondria and oxidative stress:cross-talk and redox signaling[J].Biochem J,2012,441(2):523-540.
[3]Mizushima N,Komatsu M.Autophagy:renovation of cells and tissues[J].Cell,2011,147(4):728-741.
[4]Sobczak M,Dargatz J,Chrzanowska-Wodnicka M.Isolation and culture of pulmonary endothelial cells from neonatal mice[J].J Vis Exp,2010,14(46):2316.
[5]孟革,赵建,吕新怀,等.大鼠肺微血管内皮细胞原代培养方法的改进[J].军事医学科学院院刊,2009,33(6):567-569.
[6]李敏,杨明会,刘毅.大鼠肺微血管内皮细胞培养方法的对比和改进[J].中国组织工程研究与临床康复,2008,12(31):6141-6144.
[7]Ashford TP,Porter KR.Cytoplasmic components in hepatic cell lysosomes[J].J Cell Biol,1962,12(1):198-202.
[8]Bursch W.The autophagosomal lysosomal compartment inprogrammed cell death[J].Cell Death Differ,2001,8(6):569-581.
[9]Fraidenburg DR,Yuan JX.Hungry for more:autophagy in the pathogenesis of pulmonary arterial hypertension[J].Circ Res,2013,112(8):1091-1093.
[10]Liu JL,Chang KC,Lo CC,et al.Expression of autophagy-related protein beclin-1 in malignant canine mammary tumors[J].BMC Vet Res,2013,9(1):75.
[11]Leve RD,Martasek P,Escalante B,et al.Effect of heme arginate administration on blood pressure in spontaneously hypertensive rats[J].J Clin Invest,1990,86(l):213-219.
[12]Christou H,Morita T,Hsei CM.Prevention of hypoxia-induced pulmonary hypertension by enhancement of endogenous heme oxygenase-1in the rat[J].Circ Res,2000,86(12):1224-1229.
[13]Togane Y,Morita T,Suematsu M,et al.Protective roles of endogenous carbon monoxide in neointimal development elicited by arterial injury[J].Am J Physiol Heart Circ Physiol,2000,278(2):H623-H632.
[14]Hualin C,Wenli X,Dapeng L,et al.The anti-inflammatory mechanism of heme oxygenase-1 induced by hemin in primary rat alveolar macrophages[J].Inflammation,2012,35(3):1087-1093.
[15]Jiang J,Zou J,Zhu L,et al.Degradation of methylene blue with H2O2activated by peroxidase-like Fe3O4magnetic nanoparticles[J].J Nanosci Nanotechnol,2011,11(6):4793-4799.
The protective effects of hemin against H2O2-induced rat pulmonary microvascular endothelial cells injury
ZONG Jun-qing1MA Jie2▲
1.Shanxi Medical University,Taiyuan 030001,China;2.Department of Cardiothoracic Surgery,the Second Hospital of Shanxi Medical University,Taiyuan 030001,China.
ObjectiveTo study the protective effects of hemin against H2O2-induced rat pulmonary microvascular endothelial cells(PMVECs)oxidative stress injury.Methods①The modified tissue block pasted culture method was used to isolate and culture male Sprague-Dawley rat PMVECs.The morphous of cultured cells were observed by microscopy.The cultured cells were identified by immunofluorescence staining of factorⅧ related antigen.②To establish the rat PMVECs oxidative stress injury modle by H2O2treatment.Rat PMVECs were incubated with hemin and H2O2.③cell viability was detected by MTT assay.Levels of lactate dehydrogenase(LDH)were measured by supernatant,western-blot was used to evaluate LC-3 protein expression.Results①The cultured PMVECs of rat in vitro showed fusiform shape or polygon,and the monolayer cultures displayed a typical cobblestone or paving-stone morphology,the PMVECs expressed factorⅧ associated antigen.②The viability of PMVEC could be reduce H2O2significantly in dose dependent manners,and reduced to 50%when treated with 200 μmol/L H2O2.③LDH content in H2O2group were higher than that of hemin group and normal control group(P<0.05),the expression of hemin group of LC-3 significantly lower than that of H2O2group Conclusion Hemin treatment can protect against H2O2induced injuries and this protection effects maybe relate to hemin reducing the endothelial cells excess autophagy.
Hemin;Pulmonary microvascular endothelial cells;H2O2;Autophagy
R-332
A
1674-4721(2013)08(c)-0006-04
宗俊青(1984-),性别:男;学历:硕士研究生;研究方向:心肺保护
▲通讯作者:马捷(1957-),性别:男;职称:博士生导师;研究方向:微创心脏外科学
2013-04-10 本文编辑:魏玉坡)

