绝经后骨质疏松症相关骨代谢指标的分析
杨立顺,袁海生,沈兴娅,康建华,王艾云
(天津市中医药大学附属北辰中医医院检验科,天津 300400)
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)为高转换型骨质疏松症。PMOP是指绝经后妇女由于体内卵巢功能低下、雌激素水平低落、骨偶联过程失调、破骨细胞的骨吸收大于成骨细胞的骨形成作用所导致的骨量减少,骨脆性增加,进而易于发生骨折的代谢性骨疾病。我们通过观察调控破骨细胞活性的主要因子和骨吸收及骨形成标志物在PMOP患者体内水平的变化,为临床早期防治骨质疏松提供依据。
材料和方法
一、研究对象
从2008年2月到2009年4月随机从居住于天津市并在天津市北辰中医医院体检中心体检的中老年女性中选出符合纳入研究标准的88例绝经后女性作为研究对象。研究对象纳入标准:汉族,自然绝经年限≥1年,年龄 <70岁。其中PMOP患者38例,年龄47~69岁;骨量减低者50例,年龄45~68岁。绝经后骨量正常妇女94名作为正常对照组,年龄45~66岁。曾感染过骨代谢疾病的个体在研究中被排除,包括肾、肝、甲状旁腺、甲状腺疾病以及糖尿病、高催乳素血症、卵巢切除、类风湿关节炎、恶性肿瘤、血液疾病,以前有病理性骨折和1年内的骨折。另外有下列情况的个体也被排除:3个月内服用过影响骨代谢药物如糖皮质激素、雌激素、甲状腺激素、甲状旁腺激素、氟化物、二磷酸甘油酸、降钙素、噻嗪类利尿药、巴比妥酸盐、免疫抑制剂和维生素D等。
二、骨密度测定
采用美国通用电气医疗系统有限公司生产的Achilles Insight系列超声骨强度仪对足跟骨进行骨强度测定。骨强度指数测定结果与诊断骨质疏松的金标准——双能X线吸收骨密度测定法的相关系数(r)为0.91,骨强度指数T-值衰减和骨密度得到的T-值衰减呈线性关系,强度指数与双能X射线吸收测定值有同等的精度。根据“原发性骨质疏松症诊治指南”:骨强度值低于同性别、同种族健康成人骨峰值的 1s~2.5s(T-值为 -1.0 ~ -2.5)之间的列为骨量低下(骨量减少)组;降低程度≥2.5s(T-值<-2.5)的列为骨质疏松组。
三、样本采集和测定
1.样本采集 受试者均于晨7∶00~9∶00抽取空腹静脉血,分离血清,样本保存于-20℃冰箱内。
2.测定指标 血清骨保护素(osteoprotegerin,OPG)与核因子-kβ受体活化因子配体(nuclear factor-k beta receptor activator ligand,RANKL)使用奥地利 Biomedica Medizinprodukte GmbH&Co.KG公司试剂盒,2个项目批内变异系数(CV)<10%,批间CV<10%;抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRACP)-5b与骨源性碱性磷酸酶(bone alkaline phosphatase,BAP)使用英国Immunodiagnostic Systems公司试剂盒,2个项目的批内CV<10%,批间CV<10%,平均回收率分别为100.9%、99.6%。以上4项均采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测,使用芬兰产MK3酶标仪及上海思桥测定软件定量分析。血清同型半胱氨酸(homocysteine,Hcy)采用北京九强生物技术公司生产的循环酶法检测试剂盒,CV<10%;检测敏感性为1.5 mmol/L。血清雌二醇(estradiol,E2)检测采用法国梅里埃 miniVIDAS全自动免疫荧光分析仪,使用原装试剂,批内 CV<7.5%,批间 CV <9.5%,检测敏感性为 5 pg/mL。各项目检测的操作按试剂盒说明书进行。
四、统计学方法
结 果
一、PMOP组、骨量减低组和正常对照组血清骨代谢指标比较
PMOP组、骨量减低组和正常对照组之间E2、OPG、RANKL、TRACP-5b、BAP、Hcy 水平及 OPG/RANKL比值差异均有统计学意义(P<0.05、P<0.01、P <0.001)。PMOP 组 BAP 水平明显高于骨量减低组及正常对照组(P<0.001),E2水平明显低于骨量减低组(P<0.001)及正常对照组(P<0.05)。骨量减低组与正常对照组之间BAP和E2水平差异无统计学意义(P>0.05)。见表1。
表1 3组骨代谢指标比较()
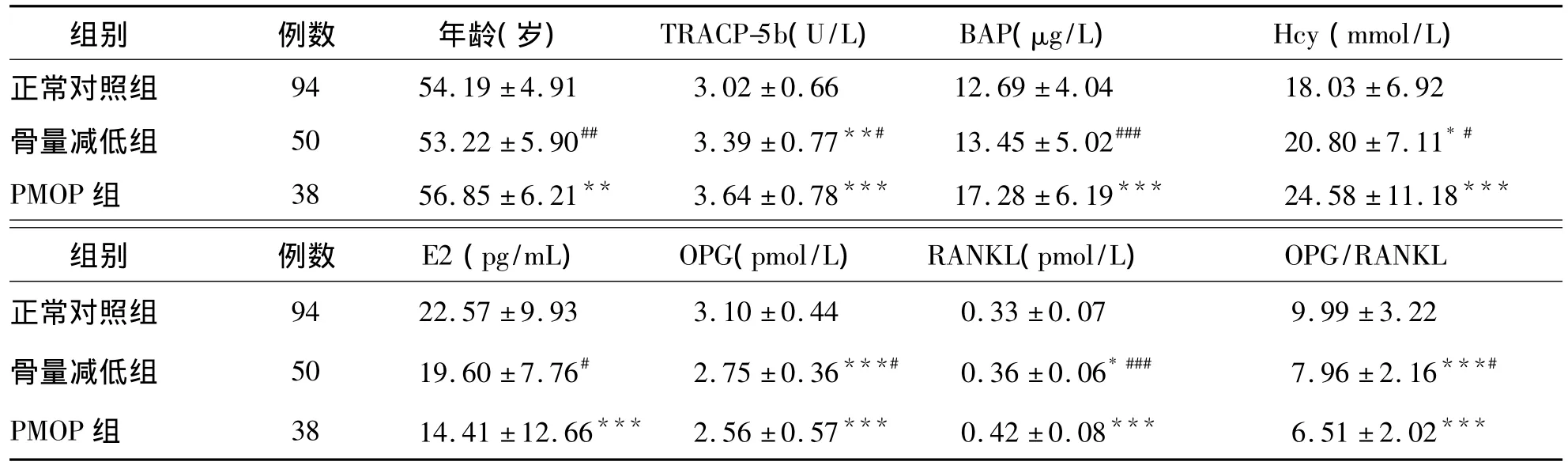
表1 3组骨代谢指标比较()
注:与正常对照组比较,*P <0.05、**P <0.01、***P <0.001;与 PMOP 组比较,#P <0.05、##P <0.01、###P <0.001
组别 例数 年龄(岁) TRACP-5b(U/L) BAP(μg/L) Hcy(mmol/L)正常对照组 94 54.19 ±4.91 3.02 ±0.66 12.69 ±4.04 18.03 ±6.92骨量减低组 50 53.22 ±5.90## 3.39 ±0.77**# 13.45 ±5.02### 20.80 ±7.11*#PMOP 组 38 56.85 ±6.21** 3.64 ±0.78*** 17.28 ±6.19*** 24.58 ±11.18***OPG/RANKL正常对照组组别 例数 E2(pg/mL) OPG(pmol/L) RANKL(pmol/L)94 22.57 ±9.93 3.10 ±0.44 0.33 ±0.07 9.99 ±3.22骨量减低组 50 19.60 ±7.76# 2.75 ±0.36***# 0.36 ±0.06*### 7.96 ±2.16***#PMOP 组 38 14.41 ±12.66*** 2.56 ±0.57*** 0.42 ±0.08*** 6.51 ±2.02***
二、各项指标的偏相关分析
1.控制年龄因素后,E2与 TRACP-5b、BAP呈负相关[r值分别为 -0.198(P=0.007),-0.157(P=0.035)],与 OPG、RANKL 和 Hcy无相关性[r值分别为 0.106(P=0.154)、-0.132(P=0.076)、0.030(P=0.69)]。
2.控制年龄、E2 因素后,Hcy与 RANKL、TRACP-5b、BAP 呈正相关[r值分别为 0.368(P <0.001)、0.193(P=0.009)、0.224(P=0.002)],与 OPG 呈负相关(r= -0.330,P <0.001)。
3.OPG 与 TRACP-5b呈负相关(r= -0.458,P=0.008),RANKL 与 BAP 呈正相关(r=0.228、P=0.044)。
三、ROC曲线分析
采用 ROC 曲线评价 E2、Hcy、OPG、RANKL、TRACP-5b、BAP对PMOP的诊断准确度,见表2、图1、图2。TRACP-5b和BAP诊断骨质疏松的Cut-off值分别是3.44 U/L 和 17.84 μg/L。
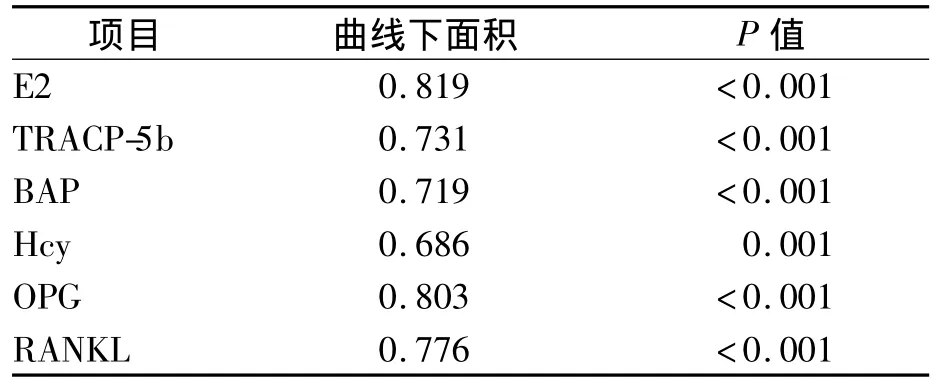
表2 各项目对PMOP的诊断准确度
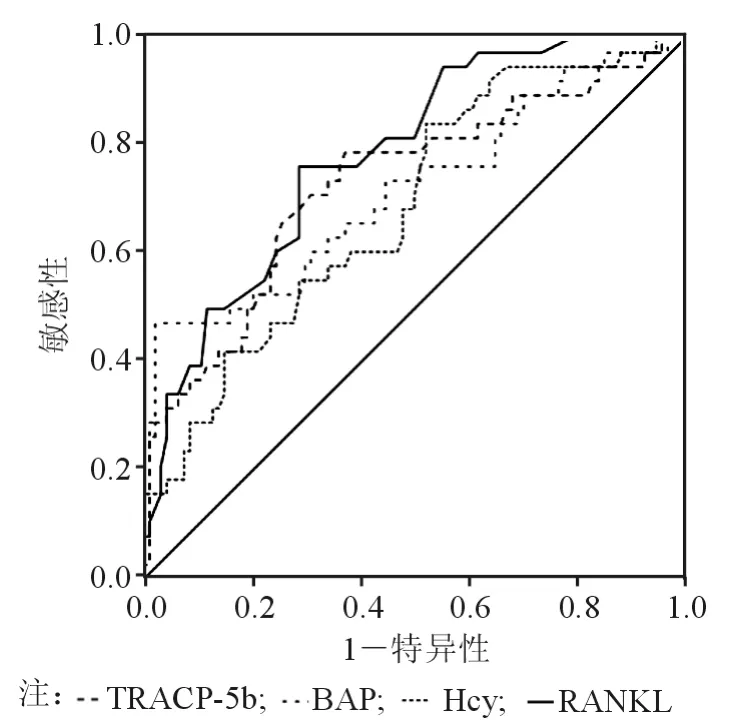
图1 TRACP、BAP、Hcy、RANKL 检测 ROC 曲线
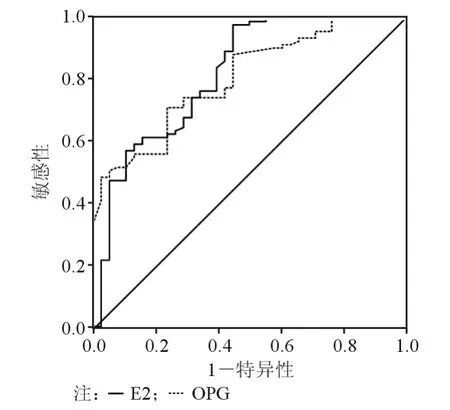
图2 E2、OPG检测ROC曲线
四、PMOP影响因素的Logistic回归分析
二分类Logistic回归分析表明,独立于年龄,血清 E2、TRACP-5b、OPG、Hcy对骨质疏松有显著影响,OPG、E2为保护因素,Hcy、TRACP-5b为危险因素。见表3。
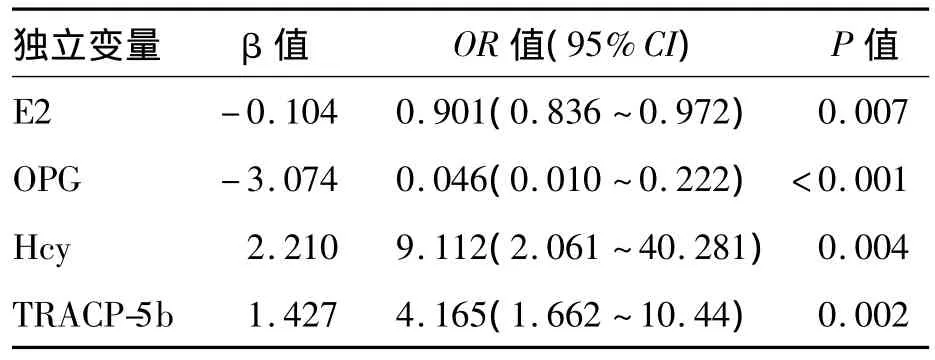
表3 骨质疏松影响因素的Logistic回归分析
讨 论
大量事实证明[1-3],雌激素对骨形成有促进作用,那么当雌激素缺乏时,就应当出现骨形成障碍,然而大量临床试验证实,绝经后女性雌激素水平降低时,骨吸收亢进的同时,骨形成也亢进,发生高转换型骨质疏松症。近年来,发现 OPG/RANKL/核因子-kβ受体活化因子(nuclear factork beta receptor activator,RANK)系统可调控破骨细胞的生成及其功能,达到抗骨质疏松或致骨质疏松的作用。
OPG是一种分泌型糖蛋白和缺乏跨膜结构域的TNF受体家族成员。OPG的配基RANKL在骨骼中的主要作用为刺激破骨细胞的分化和活性,抑制破骨细胞的凋亡,是成熟破骨细胞形成的主要刺激因子,而且对其生存很重要,其表达的增加会导致骨吸收和骨丢失。目前大量研究表明OPG与RANKL在破骨细胞发育的终末阶段发挥重要作用,是破骨细胞分化和维持功能的最终调节因子[4]。RANK是破骨细胞表面介导 RANKL生物活性的的唯一受体,而OPG是RANKL的竞争配体,通过竞争性抑制RANKL与RANK的结合,而达到抑制破骨细胞分化成熟的作用,从而抑制骨吸收。本研究中病例组的血清OPG水平显著低于正常对照组,表明在绝经后妇女中,OPG的减低降低了竞争性抑制RANKL与RANK的结合,增强了破骨细胞分化成熟,骨吸收增强,影响了机体OPG/RANKL系统的偶联平衡,进而破坏了骨形成和骨吸收的动态平衡,导致骨质疏松症患者骨吸收大于骨形成,最终导致骨破坏和骨丢失。通过Logistic回归分析得出,血清OPG对骨质疏松有显著影响,提示血清OPG的增高可能是延缓骨吸收和骨丢失的保护机制[5],对维持绝经后的骨量起到重要作用,是骨折的保护因素。这个结果与 Rogers等[6]、Mezquita-Raya 等[7]和梁少俊等[4]的研究相仿。而RANKL则相反,两病例组均高于正常对照组,证实了RANKL在骨质疏松中刺激破骨细胞分化、抑制破骨细胞凋亡、增加骨吸收和骨丢失的作用。
雌激素是一种调节OPG/RANKL/RANK系统的上游因子。有体外试验表明E2能提高OPG mRNA的水平及表达,明显提高OPG的水平[8];还能有效地降低体内IL-1、IL-6等细胞因子的水平,间接抑制成骨细胞分泌RANKL[9]。然而在本研究中虽发现E2下降的同时伴有OPG降低、RANKL升高,但并没发现 OPG、RANKL与血清E2有相关关系。这可能与本研究的病例选取、例数有限有关。
最近的流行病学调查显示,Hcy水平增高可能成为骨质疏松独立的危险因素之一[10-13],其机制主要是通过增加骨吸收,抑制骨形成及胶原蛋白的交联而减少骨密度,降低骨质量,增加骨质疏松的危险性[14]。本研究发现,病例组Hcy水平明显高于正常对照组,并且与血清OPG、RANKL具有相关性,进一步证实了Hcy是通过RANKL诱导细胞分化成破骨细胞,以及抑制破骨细胞的程序性凋亡直接增加破骨细胞的形成,抑制成骨细胞的活性,减少胶原蛋白交联而导致骨质疏松的。通过Logistic回归分析,高Hcy是患PMOP的一个独立的危险因素,深入研究Hcy的致病机制,通过干预其影响因素而降低骨质疏松症在绝经后妇女、老年人中的发生率将有重要意义。
骨质疏松的早期诊断一直是人们研究的热点。本研究选择了骨吸收标志物TRACP-5b与骨形成标志物BAP进行研究。TRACP主要来源于骨吸收过程中破骨细胞的释放,来源于破骨细胞的TRACP-5b具有酶活性[15]。女性绝经期后,血清TRACP-5b水平有所升高,如果患有骨质疏松,其水平增加更明显。本研究看到,病例组血清TRACP-5b水平显著高于正常对照组,诊断骨质疏松的ROC曲线下面积为0.731,通过二分类Logistic分析,对骨质疏松的影响显著。因此,骨吸收生化标志物TRACP-5b可以作为鉴别快速骨量丢失、诊断骨质疏松的可靠指标,同时也是一项较好的抗骨吸收治疗的监测指标。本研究得出TRACP-5b诊断骨质疏松的Cut-off值为3.44 U/L。
BAP是成骨细胞的胞外酶,由于其来源于成骨细胞,排除肝、肾、肠等疾病影响,故成为反映成骨细胞活性和骨形成的特异及敏感指标,成骨细胞活性增强,则BAP分泌增加[16]。本研究结果表明,PMOP组BAP水平明显高于无骨质疏松的其他两组。证实了PMOP为一种高转换型的骨代谢病,骨吸收与骨形成同时增强。BAP的检测对骨代谢疾病骨转换类型的判断有很好的价值。本研究得出 BAP诊断骨质疏松的 Cut-off值为17.84 μg/L。
综上所述,血清 E2、OPG/RANKL/RANK系统是骨质疏松发病机制的重要因素;血清 E2、OPG、Hcy与TRACP-5b是对骨质疏松有明显影响的独立因素,可以作为更加准确的单独预测骨质疏松的生化标志物。
[1]易伟莲,廖德权,林柏云,等.绝经后骨质疏松症患者性激素、细胞因子及骨代谢指标的变化及关系[J].检验医学,2012,27(4):296-298.
[2]白旭华.雌激素与绝经后骨质疏松症关系的研究进展[J].内蒙古民族大学学报(自然科学版),2007,29(2):180-182.
[3]安胜军,杨学辉,李 恩.雌激素与骨质疏松症[J].中国骨质疏松杂志,1999,5(3):77-85.
[4]梁少俊,刘 宏,杨 力,等.绝经后骨质疏松与血清OPG及RANKL关系的研究[J].广东医学,2006,27(5):669-671.
[5]Yano K,Tsuda E,Washida N,et al.Immunological characterization of circulating osteoprotegerin/osteoclastogenesis inhibitory factor:increased serum concentrations in postmenopausal women with osteoporosis[J].J Bone Miner Res,1999,14(4):518-527.
[6]Rogers A,Saleh G,Hannon RA,et al.Circulating estradiol and osteoprotegerin as determinants of bone turnover and bone density in postmenopausal women[J].J Clin Endoerinol Metab,2002,87(10):4470-4475.
[7]Mezquita-Raya P,de la Hiquera M,García DF,et al.The contribution of serum osteoprotegerin to bone mass and vertebral fractures in postmenopausal women[J].Osteoporos Int,2005,16(11):1368-1374.
[8]Hobfauer LC,Heufelder AE.Role of receptor activator of nuclear factor-kappaB ligand and osteoprotegerin in bone cell biology[J].J Mol Med(Berl),2001,79(5-6):243-253.
[9]Zheng SX,Vrindts Y,Lopez M,et al.Increase in cytokine production(IL-1 beta,IL-6,TFN-alpha but not INF-gamma,GM-CSF or LIF)by stimulated whole blood cells in postmenopausal osteoporosis[J].Maturitas,1997,26(1):63-71.
[10]Hodgson SF,Watts NB,Bilezikian JP,et al.American Association of Clinical Endocrinologists medical guidelines for clinical practice for the prevention and treatment of postmenopausal osteoporosis:2001 edition,with selected updates for 2003[J].Endocr Pract,2003,9(6):544-564.
[11]Sato Y,Iwamoto J,Kanoko T,et al.Homocysteine as a predictive factor for hip fracture in elderly women with Parkinson's disease[J].Am J Med,2005,118(11):1250-1255.
[12]McLean RR,Jacques PF,Selhub J,et al.Homocysteine as a predictive factor for hip fracture in older persons[J].N Engl J Med,2004,350(20):2042-2049.
[13]Van Meurs JB,Dhonukshe-Rutten RA,Pluijm SM,et al.Homocysteine levels and the risk of osteoporotic fracture[J].N Engl J Med,2004,350(20):2033-2041.
[14]赖欧杰,沈 彬.同型半胱氨酸与骨质疏松症的关系[J].中国骨质疏松杂志,2009,15(8):625-628.
[15]曾芳馨,熊中云.抗酒石酸酸性磷酸酶与骨代谢[J].华西医学,2005,20(3):545.
[16]肖 恩,孟 萍.骨质疏松骨代谢生化指标的研究进展[J].中国骨质疏松杂志,2008,14(3):212-216.