MEF2A/2D参与Rho信号通路调控去极化诱导的血管平滑肌细胞分化过程*
任京力, 王雁梅, 宋国华, 康红钰, 孙明振
(漯河医学高等专科学校医学生物工程重点实验室,河南漯河462000)
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)在病理状态如炎症、损伤以及血流动力学改变时会发生表型转化,即由正常的收缩型转化为合成型,是临床上多种心血管疾病如高血压、动脉粥样硬化、冠脉成形术后再狭窄、动脉瘤等发生的病理生理学基础。钙信号在VSMCs表型转化中起着重要作用。Wamhoff等[1]首先报道在大鼠主动脉平滑肌细胞上去极化引起的钙内流首先激活RhoA GTP结合蛋白(RhoA GTP-binding protein,RhoA),继而激活Rho相关卷曲螺旋形成蛋白激酶(Rho-associated coiled-coil forming protein kinase,ROCK),磷酸化其下游的LIM(3种同源异型结构域蛋白Lin-11、Isl-1和Mec-3)激酶(LIM kinase,LIMK)和丝切蛋白2(cofilin-2),使纤维丝状肌动蛋白(F-actin)降解减少,并可以引起胞浆中的血清反应因子(serum response factor,SRF)转移至胞核内,调控VSMCs分化标志物如平滑肌α-肌动蛋白(smooth muscle α-actin,α-SMA)、钙结合蛋白(calponin)等的表达,对维持VSMCs的分化状态非常重要;并且提出了“兴奋-转录偶联”的概念。小鼠门静脉的VSMCs沿血管长轴纵向排列,与动脉VSMCs的环状排列显著不同。去极化刺激对平滑肌细胞分化的调控是否相同尚不完全清楚。肌细胞增强因子2(myocyte enhancer factor 2,MEF2)属于转录调节因子MADS-Box家族,包括MEF2A、MEF2B、MEF2C和 MEF2D这4种亚型,在骨骼肌和心肌的发育、分化过程中起重要作用[2-3],但对VSMCs的分化调控尚无确切机制。为此,本研究拟原代培养小鼠门静脉VSMCs,观察去极化刺激对其分化的调节,探讨MEF2在其中的作用机制,以期为血管表型转换的防治提供新思路。
材料和方法
1 动物与试剂
SPF级昆明小鼠,25~30 g,雌雄不拘,购于河南省动物实验中心。电压依赖性钙通道特异性阻断剂维拉帕米(verapamil,Ver)、ROCK特异性抑制剂Y-27632、anti-calponin 抗体 、anti-α-SMA 抗体、Cy2/Cy5-conjugated anti-mouse secondary antibody等购于Sigma;total/phospho-ERK1/2、total/phospho-cofilin-2、total/phospho-LIMK等购于Cell Signaling;GAPDH和anti-Rho(clone 55)单克隆抗体购于Millipore;总RNA提取试剂盒、SM22α、MEF2A及MEF2B的引物购于Qiagen;MEF2C、MEF2D、GAPDH和心肌素(mycardin)引物购于北京三博远志生物技术公司;胶原酶 II购于Invitrogen。
2 方法
2.1 门静脉血管平滑肌细胞的原代培养 按本室建立的方法并参考相关文献[4]:在体式显微镜下,仔细去除血管外膜和内皮层,用眼科剪将门静脉条剪成约2 mm×2 mm的碎片,置于含1 mL DEME培养液的 Eppendorf管中(含 1.4 g/L 胶原酶 II、1×105U/L青霉素和100 mg/L链霉素)于细胞培养箱中孵育3 h,1 000 r/min离心3 min,去掉上清液,加入1 mL新鲜DMEM(含10%胎牛血清)并轻微振荡成悬液。然后将悬液转移入新的35 mm培养皿或6孔板中,补充培养基至2 mL,重新置于细胞培养箱中孵育4~5 d,即见VSMCs从细胞碎片爬出,见图1A。通过免疫组化(见方法2.2)及激光共聚焦显微镜扫描,可见VSMCs内呈现典型的肌丝样结构,见图1B、C,说明细胞处于分化状态。将图1A中的细胞常规胰酶消化、传代、培养即为第2代的血管平滑肌细胞。本文中所有实验均在第2代细胞上进行。
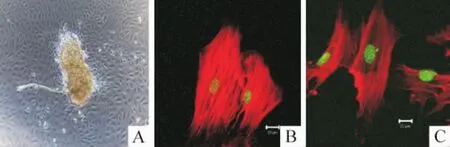
Figure 1.Identification of primarily cultured mouse portal vein VSMCs.A:primarily cultured VSMCs growing from the portal vein patch(× 100);B:smooth muscle αactin immunofluorescence assay(in red);C:calponin immunofluorescence assay(in red).SYTOX Green was used to stain nucleus(in green).Bar=20 μm in B and C.图1 小鼠门静脉血管平滑肌细胞的原代培养及鉴定
2.2 免疫组化 平滑肌细胞在适当的刺激后,用4%多聚甲醛固定15 min后,与0.2%Triton X-100孵育10 min。然后与相应的Ⅰ抗在暗室中孵育2 h[anti-calponin(1∶10 000)、anti-α-SMA(1∶10 000)和anti-RhoA(1∶5]单克隆抗体)后,PBS洗涤3次,继续与Ⅱ抗孵育(Cy2/Cy5-conjugated anti-mouse secondary antibody,1∶2 000)1 h,PBS 洗涤 3 次,以SYTOX Green进行核染色。所用样本通过激光共聚焦显微镜扫描成像。
2.3 Western blotting检测蛋白质表达 原代培养的小鼠门静脉VSMCs约90%融合时,加入0.2 mL/well蛋白裂解液(含1%PMSF、抑肽酶和亮肽素)裂解细胞。小心收集后超声粉碎、离心,取上清液,考马斯亮蓝法蛋白定量。进行聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉室温封闭2 h,加适当的Ⅰ抗,4℃过夜,PBST洗涤3次,再加入相对应的Ⅱ抗,室温孵育1 h,PBST洗涤 3次,用 ECL Advanced Western Blotting Detection Kit(Bio-Rad)显色3~5 min后,Bio-Rad图像分析系统扫描,Quantity One软件分析处理。
2.4 siRNA转染及实时荧光定量RT-PCR检测mRNA表达 细胞的转染按试剂供应商的说明书进行。为优化转染效果,设计了一系列的siRNA浓度(2~20 nmol/L),同时设立对照RNA组。所用siRNA序列如下:MEF2A 5'-CAC ATT CTG CTG AAT TAT TTA-3';MEF2D 5'-CCG CCA GGT GAC CTT CAC CAA-3'。对照组siRNA序列为制造商专利。细胞总RNA提取按照供应商试剂盒的说明进行。实时荧光定量RT-PCR按照供应商试剂盒的说明在实时荧光定量PCR仪上进行。反应条件如下:50℃ 10 min,95℃ 5 min,37个循环,95℃ 10 s,60℃的退火和扩展。GAPDH为内参照,上游引物 5'-CCTGCCAAGTATGATGAC-3',下游引物 5'-GGAGTTGCTGTT-GAAGTC-3';MEF2C上游引物5'-CCCAATCTTCTGCCACTG-3',下游引物5'-GGTTGCCGTATCCATTCC-3';MEF2D上游引物5'-GCTATGGGTCATCTGTTC-3',下游引物5'-ACTTGGATTGCTG AACTG-3';心肌素上游引物 5'-GCCACTGTGCGTCCTCCTACC-3',下游引物5'-TCGGAACTTCCTTCTAATCAGCAAAGAG-3'。SM22α、calponin-1、calponin-2、MEF2A 及 MEF2B的引物序列为Qiagen合成。
3 统计学处理
采用SPSS 16.0统计软件处理。数据以均数±标准差(mean±SD)表示。两组数据之间比较用Student's t检验。组间比较用单因素方差分析和Bonferroni post tests。以 P<0.05为差异有统计学意义。
结 果
1 高钾去极化刺激小鼠门静脉VSMCs激活RhoA
用60 mmol/L KCl分别刺激 VSMCs 30 s、1 min和4 min后通过免疫组化观察RhoA蛋白变化,同时设立空白对照组和维拉帕米组。结果显示RhoA蛋白在高钾去极化刺激后30 s即发生了明显的胞膜移位,见图 2B、C、D(箭头所示),5 μmol/L 维拉帕米则抑制了RhoA的胞膜移位,见图2E。
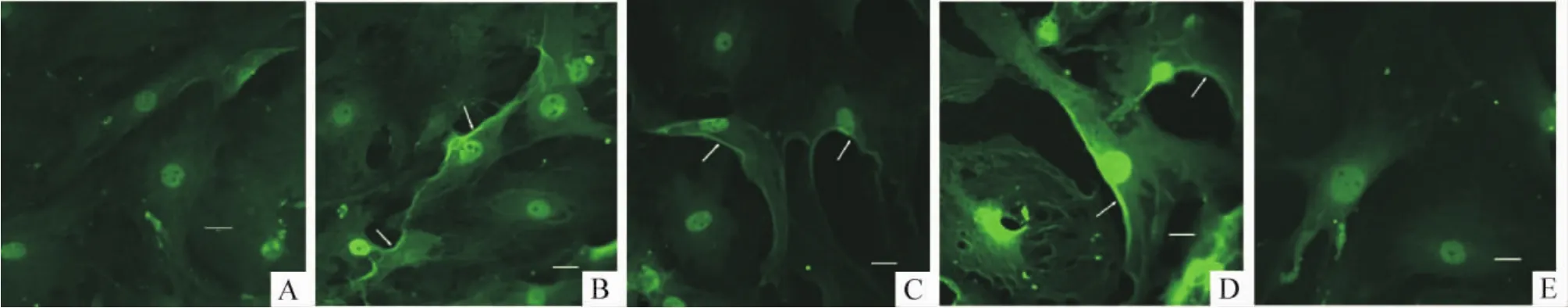
Figure 2.Membrane translocation of RhoA upon 60 mmol/L KCl-induced depolarization.VSMCs were fixed after exposure to 60 mmol/L KCl for the indicated time and immunostained for RhoA using a Cy2-conjugated secondary antibody(green).Translocation of RhoA is shown by arrows.Verapamil inhibited membrane translocation of RhoA.A:control;B:cells treated with 60 mmol/L KCl for 30 s;C:cells treated with 60 mmol/L KCl for 1 min;D:cells treated with 60 mmol/L KCl for 4 min;E:cells treated with 60 mmol/L KCl for 4 min in the presence of 5 μmol/L verapamil.Bar=20 μm.图2 RhoA蛋白在高钾去极化刺激时发生胞膜移位
2 高钾去极化刺激对LIMK和cofilin-2磷酸化的影响
60 mmol/L KCl分别刺激 VSMCs 10 min、30 min和60 min后,提取总蛋白,通过Western blotting检测RhoA信号转导通路中下游蛋白LIMK和cofilin-2的磷酸化表达变化。结果显示LIMK的磷酸化在高钾去极化刺激10 min后达到峰值,蛋白表达量增加了42.2%(P<0.01),见图3A;其底物cofilin-2的磷酸化则在高钾刺激30 min达到峰值,蛋白表达量增加了32.75%(P <0.01),见图 3B。5 μmol/L 维拉帕米能显著抑制 LIMK(P<0.01)和 cofilin-2(P<0.05)对高钾刺激的敏感性。这说明RhoA/ROCK/LIMK/cofilin-2信号途径被高钾引起的去极化激活。
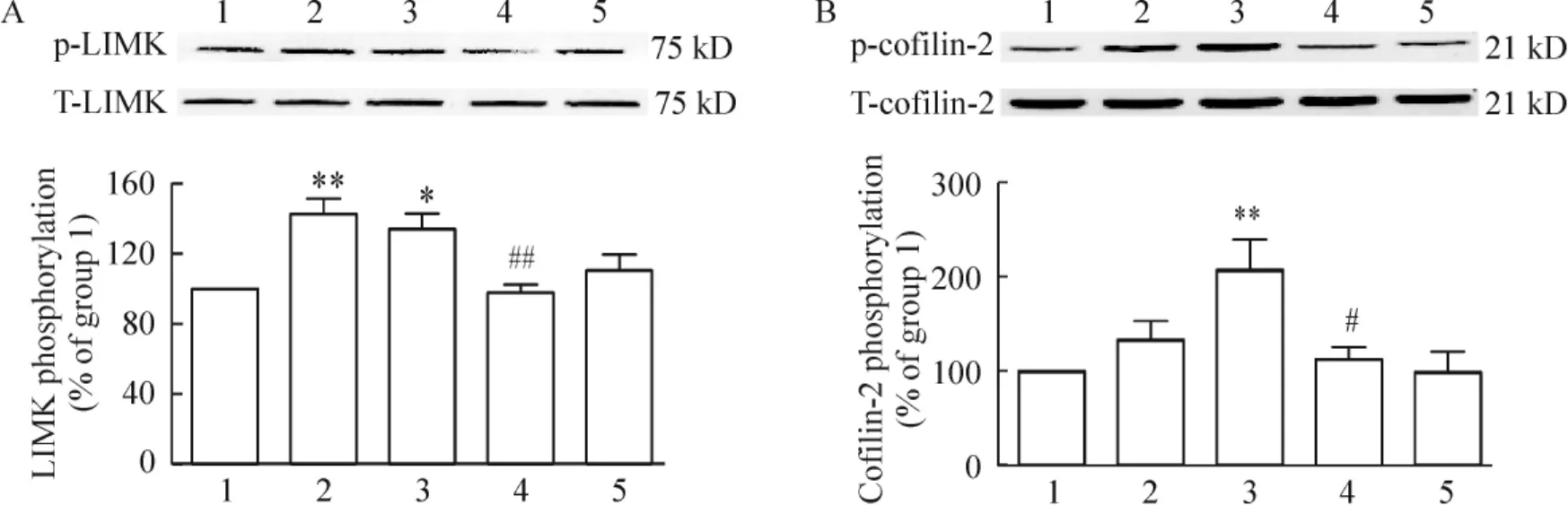
Figure 3.Effects of 60 mmol/L KCl stimulus on the phosphorylation of LIMK(A)and cofilin-2(B).1:control;2:cells treated with 60 mmol/L KCl for 10 min;3:cells treated with 60 mmol/L KCl for 30 min;4:cells treated with 60 mmol/L KCl for 30 min in the presence of 5 μmol/L verapamil;5:cells treated with 60 mmol/L KCl for 60 min.Mean±SD.n=4 ~5.*P <0.05,**P <0.01 vs group 1;#P <0.05,##P <0.01 vs group 3.图3 高钾去极化刺激对LIM激酶和丝切蛋白2磷酸化的影响
3 高钾去极化刺激小鼠门静脉VSMCs对转录因子心肌素及平滑肌标志物mRNA表达的影响
60 mmol/L KCl刺激 VSMCs 24 h后,提取总RNA后,通过real-time RT-PCR检测转录因子心肌素及平滑肌标志物SM22α、calponin-1和calponin-2 mRNA的表达。结果显示:高钾刺激显著增加心肌素(P <0.01)、SM22α(P <0.01)、calponin-1(P <0.01)及calponin-2(P<0.01)mRNA的表达水平,见图 4。5 μmol/L 维拉帕米 及 10 μmol/L Y27632(ROCK特异性抑制剂)均能完全抑制高钾去极化刺激引起心肌素mRNA表达增加,见图4A;5 μmol/L维拉帕米可完全抑制高钾去极化引起的SM22α、calponin-1和calponin-2 mRNA表达增加(均P<0.01),见图4B~D。这说明高钾去极化通过激活 Rho/ROCK信号通路诱导心肌素表达的增加,进而调控平滑肌标志物的表达。

Figure 4.Effects of 60 mmol/L KCl stimulus on the mRNA expression of myocardin(A)and smooth muscle markers(B,C and D).1:control;2:cells treated with 60 mmol/L KCl for 24 h;3:cells treated with 60 mmol/L KCl for 24 h in the presence of 5 μmol/L verapamil;4:cells treated with 60 mmol/L KCl for 24 h in the presence of 10 μmol/L Y27632.Mean ± SD.n=6.**P <0.01 vs group 1;##P <0.01 vs group 2.图4 高钾去极化刺激对血管平滑肌细胞心肌素及平滑肌标志物mRNA表达的影响
4 高钾去极化刺激小鼠门静脉VSMCs对MEF2四种亚型mRNA表达的影响
60 mmol/L KCl刺激 VSMCs 24 h后,提取总RNA后,通过real-time RT-PCR检测MEF2四种亚型mRNA的表达。结果显示:MEF2A和MEF 2D mRNA表达显著增加,分别增加 47.63%(P<0.05)和48.15%(P<0.01),维拉帕米和ROCK的特异性抑制剂Y27632能显著抑制MEF2A和MEF2D mRNA的表达(均P<0.01)对高钾刺激的敏感性,见图5A、D。这说明高钾去极化刺激 VSMCs引起的MEF2A和MEF2D表达增加受到Rho/ROCK信号通路的调控。而MEF2B和EEF2C mRNA表达对高钾刺激不敏感,见图5B、C。

Figure 5.Effects of high KCl-induced depolarization on the mRNA expression of MEF2 isoforms.1:control;2:cells treated with 60 mmol/L KCl for 24 h;3:cells treated with 60 mmol/L KCl for 24 h in the presence of 5 μmol/L verapamil;4:cells treated with 60 mmol/L KCl for 24 h in the presence of 10 μmol/L Y27632.Mean ±SD.n=6.*P <0.05,**P <0.01 vs group 1;##P <0.01 vs group 2.图5 高钾去极化对MEF2四种亚型mRNA表达的影响
5 高钾去极化刺激对沉默MEF2A和MEF2D的VSMCs心肌素和SM22α mRNA表达的影响
分别设置空白对照组、无关对照组、假转染组、阴性对照组和实验组,用2~20 nmol/L siRNA分别转染VSMCs 48 h后,提取细胞总RNA,通过real-time RT-PCR检测沉默效果,发现10 nmol/L siRNA即能显著抑制 MEF2A和 MEF2D mRNA的表达,见图6A。在沉默MEF2A和MEF2D的VSMCs中,心肌蛋白mRNA的表达对高钾去极化刺激不再敏感,见图6B;但是SM22α的表达在高钾去极化刺激后仍然显著增加(P<0.05),见图6C。这说明心肌素 mRNA的表达受控于MEF2A和MEF2D。SM22α的表达并没有受到沉默MEF2A和MEF2D的影响,提示平滑肌标志物的表达除了受心肌素调控外,可能还存在另外的调控通路。
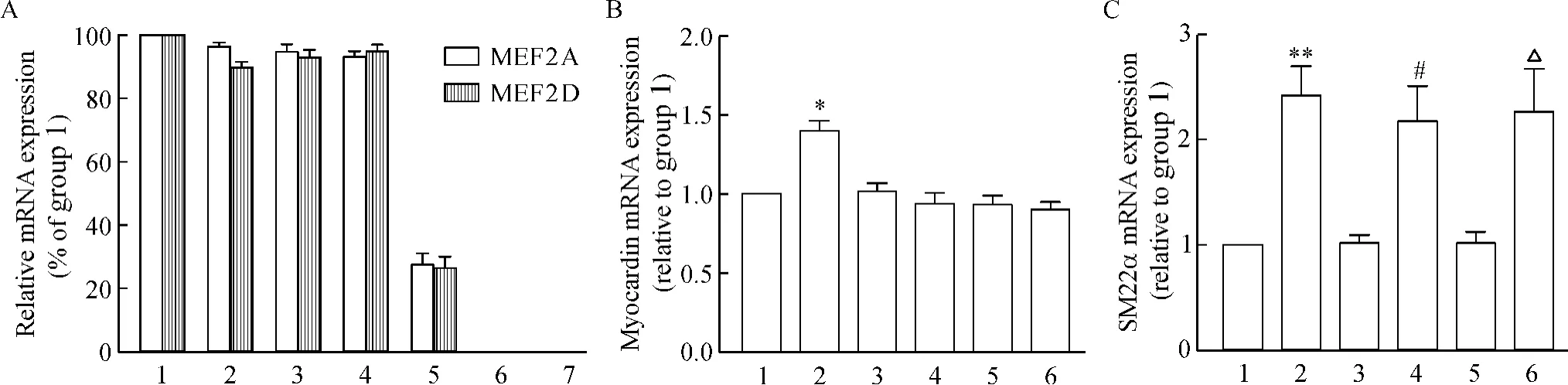
Figure 6.Effects of MEF2A/2D knockdown on the sensitivity of myocardin and SM22α mRNA expression to high KCl-induced depolarization.A:MEF2A and MEF2D mRNA expression.1:empty control;2:scrambled siRNA control;3:vehicle control;4:negative control;5:cells transfected with 2 nmol/L siRNA;6:cells transfected with 10 nmol/L siRNA;7:cells transfected with 20 nmol/L siRNA.Mean±SD.n=3.B and C:myocardin and SM22α mRNA expression,respectively.1:wild type control;2:wild type control cells treated with 60 mmol/L KCl for 24 h;3:MEF2A knockdown;4:MEF2A knockdown cells treated with 60 mmol/L KCl for 24 h;5:MEF2D knockdown group;6:MEF2D knockdown cells treated with 60 mmol/L KCl for 24 h.Mean ±SD.n=6.*P <0.05;**P <0.01 vs group 1;#P <0.05 vs group 3;△P <0.05 vs group 5.图6 沉默MEF2A/2D对高钾去极化引起的心肌素和SM22α mRNA表达的影响
讨 论
VSMCs具有收缩表型和合成表型。收缩表型VSMCs胞浆内主要是收缩纤维、游离核糖体及高尔基体,内质网很少,分布于核周区域,主要对机械刺激和化学物质起收缩反应并维持血管壁的张力;合成表型VSMCs有少量肌纤维,大量的高尔基体、游离核糖体和粗面内质网,具有合成功能,主要参与细胞外基质的形成和合成血管活性物质,合成表型的VSMCs见于生长和修复过程,而VSMCs在血管损伤因素刺激下发生的表型转换是其获得增殖能力的决定因素[5-6]。因此,阐明VSMCs增殖的发生机制,对防治血管重塑和逆转增殖性血管病变具有重要的意义。MEF2是MADS(酵母MCMI基因、拟南芥AGAMOUS基因、金鱼草DEFTCI基因及人类SRF基因的英文首字母)家族成员之一,在动物发育过程中起到重要的调节作用。在脊椎动物中,MEF2基因是由4个基因(MEF2A、MEF2B、MEF2C 和 MEF2D)组成的多基因家族。MEF2广泛存在于肌肉组织、心肌组织和神经组织。MEF2蛋白的N末端序列保守,包含MADS结构域和MEF2结构域,能够与其它因子形成二聚体并具有DNA结合活性;C末端含有磷酸化位点,是多种激酶的靶点,与启动基因表达有关,是MEF2因子活性调节及发挥功能的主要区域。对骨骼肌和心肌细胞分化过程的调控研究表明MEF2最突出的功能是控制肌细胞分化过程中的基因转录,主要作用是在骨骼肌、心肌和平滑肌的发育过程中介导细胞的分化[7-9]。但MEF2对VSMCs分化过程的调控报道不多,并且有不同的结论[10-12]。
本研究观察到:首先,在原代培养的小鼠门静脉VSMCs中,60 mmol/L KCl去极化刺激可激活Rho/ROCK-LIMK-cofilin-2信号转导通路,表现为RhoA蛋白发生显著的胞膜移位,其下游底物LIMK以及cofilin-2的磷酸化分别在去极化刺激10 min和30 min达到峰值,并且上述变化均对5 μmol/L维拉帕米敏感。与Wamhoff等[1]的报道一致;其次,平滑肌标志物的重要调控因子心肌素mRNA表达的显著增加具有高钾去极化依赖性并受到Rho/ROCK信号通路的调控,表现为其表达对5 μmol/L维拉帕米和ROCK特异性抑制剂 Y27632敏感;再次,心肌素mRNA表达还受MEF2A和MEF2D的调控,表现为在沉默MEF2A和MEF2D两种亚型的VSMCs,心肌素的表达失去了对高钾去极化刺激的敏感性。这与在心脏和骨骼肌中,心肌素受MEF2调控的报道相一致[13-14],提示 MEF2A/2D与心肌素很可能作为RhoA/ROCK信号转导通路的一个新的分支在调控平滑肌标志物的表达过程中起重要作用。最后,在沉默MEF2A和MEF2D的VSMCs中,高钾去极化刺激仍然能引起SM22α表达显著增加,提示平滑肌特异基因的调控可能通过其它通路,如RhoA/ROCK/LIMK/mDia/profilin 信号通路进行代偿[15]。至于MEF2A和MEF2D之间如何协同作用,以及是否与其它转录因子相互作用调节VSMCs的分化过程有待进一步实验研究。
综上所述,MEF2A和MEF2D通过调控心肌素的表达参与了高钾去极化引起的VSMCs平滑肌标志物的表达。
[1] Wamhoff BR,Bowles DK,McDonald OG,et al.L-type voltage-gated Ca2+channels modulate expression of smooth muscle differentiation marker genes via a Rho kinase/myocardin/SRF-dependent mechanism[J].Circ Res,2004,95(4):406-414.
[2] Yu Z,Li Z,Jolicoeur N,et al.Aberrant allele frequencies of the SNPs located in microRNA target sites are potentially associated with human cancers[J].Nucleic Acids Res,2007,35(13):4535-4541.
[3] Haberland M,Arnold MA,McAnally J,et al.Regulation of HDAC9 gene expression by MEF2 establishes a negative-feedback loop in the transcriptional circuitry of muscle differentiation[J].Mol Cell Biol,2007,27(2):518-525.
[4] Ren J,Albinsson S,Hellstrand P.Distinct effects of voltage-and storedependent calcium influx on stretch-induced differentiation and growth in vascular smooth muscle [J].J Biol Chem,2010,285(41):31829-31839.
[5] Anwar MA,Shalhoub J,Lim CS,et al.The effect of pressure-induced mechanical stretch on vascular wall differential gene expression[J].J Vasc Res,2012,49(6):463-478.
[6] 郑 辉,薛 松,连 锋,等.人Gax基因转染对血管平滑肌细胞增殖、迁移和细胞周期的影响[J].中国病理生理杂志,2012,28(2):216-221.
[7] Seok HY,Tatsuguchi M,Callis TE,et al.miR-155 inhibits expression of the MEF2A protein to repress skeletal muscle differentiation [J].J Biol Chem,2011,286(41):35339-35346.
[8] AI Madhoun AS,Mehta V,Li G,et al.Skeletal myosin light chain kinase regulates skeletal myogenesis by phosphorylation of MEF2C [J].EMBO J,2011,30(12):2477-2489.
[9] Tessier SN,Storey KB.Myocyte enhancer factor-2 and cardiac muscle gene expression during hibernation in thirteen-lined ground squirrels[J].Gene,2012,501(1):8-16.
[10] Pagiatakis C,Gordon JW,Ehyai S,et al.A novel RhoA/ROCK-CPI-17-MEF2C signaling pathway regulates vascular smooth muscle cell gene expression[J].J Biol Chem,2012,287(11):8361-8370.
[11] Katsuyama M,Ozgur Cevik M,Arakawa N,et al.Myocyte enhancer factor 2B is involved in the inducible expression of NOX1/NADPH oxidase,a vascular superoxide-producing enzyme [J].FEBS J,2007,274(19):5128-5136.
[12] Ginnan R,Sun LY,Schwarz JJ,et al.MEF2 is regulated by CaMKIIδ2and a HDAC4-HDAC5 heterodimer in vascular smooth muscle cells[J].Biochem J,2012,444(1):105-114.
[13] Creemers EE,Sutherland LB,McAnally J,et al.Myocardin is a direct transcriptional target of Mef2,Tead and Foxo proteins during cardiovascular development[J].Development,2006,133(21):4245-4256.
[14] Kuwahara K,Teg Pipes GC,McAnally J,et al.Modulation of adverse cardiac remodeling by STARS,a mediator of MEF2 signaling and SRF activity [J].J Clin Invest,2007,117(5):1324-1334.
[15] Lai SL,Chan TH,Lin MJ,et al.Diaphanous-related formin 2 and profilin I are required for gastrulation cell movements[J].PLoS One,2008,3(10):e3439.

