bFGF对人脐带间充质干细胞增殖及胶原产生的影响*
林 丽, 林绍强, 王晓玉△, 张 羡
(1暨南大学附属第一医院妇产科,广东广州510632;2温州医学院药学院生物制药系,浙江温州325035)
目前间充质干细胞因其强大的分化潜能已经成为科学家们研究的热点,间充质干细胞 (mesenchymal stem cells,MSCs)在组织工程领域显示出了良好的应用前景[1-2]。相比其它间充质干细胞,本实验选用的人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)具有种子细胞的很多优良特性,如增殖活性高、免疫原性低、无致瘤性等,来源充足,无伦理问题[3]。国外有研究证实,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)具有显著的促 MSCs增殖作用[4]。但对hUCMSCs的增殖是否同样具有促进作用,对hUCMSCs产生胶原的能力有何影响,是否会加重创面修复过程中瘢痕组织的形成等问题,尚不明确。本实验拟采用bFGF对hUCMSCs在体外条件下进行干预培养,研究其对hUCMSCs增殖和I、III型胶原产生的影响,初步探讨两者联合应用是否有促进组织修复、减少瘢痕形成的作用。
材料和方法
1 原代hUCMSCs的分离和培养
正常、足月、剖宫产的健康婴儿脐带,取自暨南大学附属第一医院手术室,经产妇知情同意,实验经医院伦理委员会批准。手术前产妇按常规做艾滋病病毒抗体、乙型肝炎病毒抗体、丙型肝炎病毒抗体、梅毒螺旋体抗体等检测。将脐带标本采集后于4℃保存,4 h内完成实验。脐带在含青霉素和链霉素的PBS溶液中洗尽残余血液,剔除脐带中的血管并剪碎至1~2 mm,酶消化法分离细胞。24 h后除去非贴壁细胞,按实验要求随机分成实验组和对照组,换置成相应的新鲜培养液培养,每3 d更换1次培养液,待贴壁细胞即将铺满瓶底时用胰酶消化分离,按5×103/cm2密度接种于25 cm2培养瓶,记为 P1;待培养过程中贴壁细胞彼此融合,铺满整个培养板的底面时,再重复以上操作,记为 P2;以此类推传代培养。
2 流式细胞术分析其表面标记
用流式细胞术分析细胞表型以证实我们分离的是间充质干细胞,而不是造血、内皮类细胞。取第2代hUCMSCs,消化后计数2×105细胞与抗体室温反应30 min,流式细胞仪分析细胞表型。
3 hUCMSCs成脂诱导分化及油红O染色
取 P3 hUCMSCs,加入含 10-6mol/L地塞米松、0.5 mmol/L 1-甲基-3-异丁基黄嘌呤、10 mg/L 胰岛素、1×105U/L青霉素和100 mg链霉素的DMEM/F12培养液,置于含有5%CO2、37℃、饱和湿度培养箱中培养,每3 d进行细胞换液1次,连续诱导2周,采用油红O染色鉴定。
4 hUCMSCs成骨诱导分化及茜素红染色
取 P3 hUCMSCs,加入含10-7mol/L地塞米松、10 μmol/L β-甘 油 磷酸 钠和 10 mg/L 胰岛 素 的DMEM/F12培养液,置于含有5%CO2、37℃、饱和湿度培养箱中培养,每2~3 d进行细胞换液1次,连续诱导3周,采用茜素红染色鉴定细胞分化为成骨细胞的能力。
5 bFGF浓度的确定
取P2 hUCMSCs,以添加不同浓度bFGF的普通培养基培养,设含 10 μg/L、20 μg/L 和 30 μg/L 组,对照组为无bFGF培养,每组调整细胞浓度为3×103cells/well,分别接种于7块96孔板内,每组6孔,依次于培养第1~7 d消化细胞,计数。以细胞数为纵坐标,天数为横坐标,绘制生长曲线。取促进hUCMSCs增殖的最适浓度。
6 培养液成分及实验分组
培养液选用 DMEM/F12(Gibco),添加1×105U/L青霉素(HyClone)和100 mg/L链霉素(Hy-Clone),使用前加入10%胎牛血清(HyClone)。依据培养液中是否含有bFGF,实验分为2组:实验组使用含bFGF(Sigma)的培养液;对照组培养液不含bFGF。
7 MTT比色法分析2组 hUCMSCs的存活和增殖能力
使用二甲基四氮唑盐微量酶反应比色法(MTT法)测定A值,间接反映细胞生长及增殖活性。将生长良好的P2 hUCMSCs以2 000 cells/well种植在7块96孔培养板中,加入2种不同的培养液,采用bFGF对hUCMSCs进行干预培养,并设实验组(加bFGF)和对照组(无 bFGF),依次于培养 2、4、8、12、14 d后,于各小孔内加入5 g/L噻唑蓝20 μL,继续培养4 h后每孔加入二甲基亚砜200 μL,用酶标仪在570 nm波长下检测hUCMSCs增殖情况,并绘制生长曲线。
8 RT-PCR测定其对胶原产生的影响
RT-PCR检测Ⅰ、Ⅲ型胶原蛋白mRNA的表达:取P4 hUCMSCs,实验组及对照组各培养30 d后,以Trizol法提取细胞总RNA,用紫外分光光度计测总RNA的纯度和浓度,1%琼脂糖凝胶电泳鉴定其完整性。取总RNA 0.4 μg反转录为 cDNA,样品-20℃保存。PCR引物由上海捷瑞生物有限公司合成,见表1。
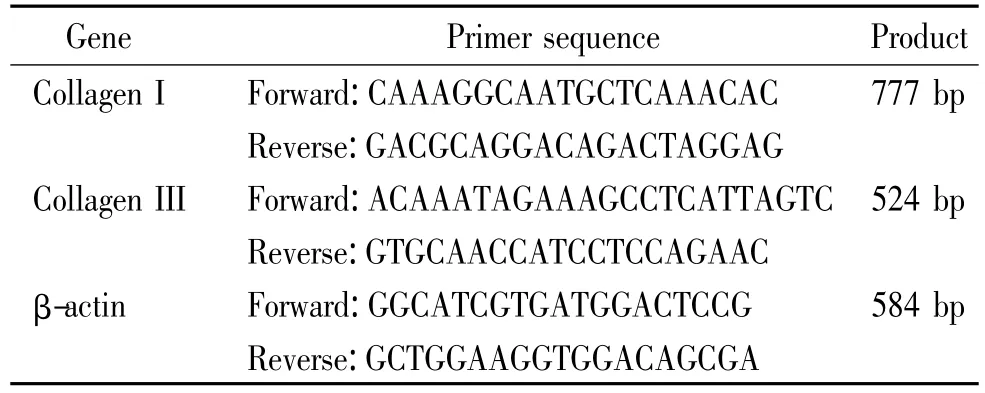
表1 引物序列Table 1.Sequences for the primers
PCR反应条件:94℃预变性5 min,94℃ 30 s,50℃ 30 s,72℃ 1.5 min,共40个循环;最后72℃ 5 min,4℃终止反应。以2%琼脂糖凝胶,在0.5×TBE缓冲液中电泳进行PCR产物鉴定,用基因条带图像处理系统,将电泳结束后的凝胶块放入紫外投射仪的暗箱内,将β-actin的密度值设定为1,目的基因条带密度相对于β-actin的比值即为目的基因的相对密度,测量3次,取平均值。
9 Western blotting检测I、III型胶原蛋白的表达
hUCMSCs贴壁培养30 d后,实验组培养液中含bFGF(20 μg/L),对照组无 bFGF,分别取 P4 细胞各2瓶,采用Western blotting方法测定 I、III型胶原蛋白的表达。以ImageJ图像分析系统对各条带进行灰度分析,以GAPDH为内参照。
10 统计学处理
用SPSS 13.0软件处理 ,数据以均数±标准差(mean±SD)表示,两样本均数比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 hUCMSCs的形态学观察
倒置显微镜下观察,实验组贴壁细胞数量较对照组多,1周后可见多数呈长梭形或扁平形的成纤维样细胞;实验组传代时间快,传代间隔小于对照组,当第1代hUCMSCs细胞生长到汇合期时,实验组细胞数是对照组的2.5倍,见图1。
2 流式细胞术分析其表面标记
培养的2组hUCMSCs均表现为CD29和CD105强阳性,不表达 CD34、CD45和 HLA-DR。CD34、CD45和HLA-DR呈阴性,说明实验所分离培养的细胞具有间充质干细胞的表型特征,见图2。
3 成脂细胞和成骨细胞分化鉴定结果
向成脂细胞培养诱导分化后,多数细胞失去原有的长梭形而变为肥大、扁平的多角形细胞,2周后用油红O染色检测脂肪滴为阳性;在细胞向成骨细胞诱导3周后茜素红染色阳性,细胞内可因钙质沉积而显现红色,见图3。

Figure 1.The cell morphology and growth after treatment with bFGF(20 μg/L).图1 2组细胞的形态和生长状况
4 加入不同浓度bFGF培养的hUCMSCs的生长曲线
加入bFGF后,前3 d不同浓度的bFGF对hUCMSCs增殖的影响不明显,4 d后细胞增殖明显,6 d到达高峰,30 μg/L、20 μg/L 和 10 μg/L bFGF 组的细胞数分别为13.6 ×103、13.43 ×103和9.33 ×103,经统计学检验分析显示,20 μg/L、30 μg/L 与10 μg/L比较有显著差异(P <0.05),20 μg/L 与 30 μg/L组比较无显著差异(P >0.05),10 μg/L、20 μg/L 组与对照组比较有显著差异(P<0.05),见图4。上述结果提示选取20 μg/L是促进hUCMSCs增殖的最佳浓度,与相关文献报道一致。
5 实验组与对照组hUCMSCs的MTT结果及生长曲线
依据MTT测定结果,绘制实验组和对照组细胞生长曲线,见图5。2组之间吸光度值比较差异有显著性(P<0.05)。接种后第1 d 2组细胞生长相对平缓,表现同生长曲线潜伏期。第4 d起2组保持较高的增殖活性,呈快速生长,构成生长曲线的指数增长期,实验组细胞增殖明显。2组细胞相比:实验组A值明显增加(P <0.05)。

Figure 2.Flow cytometry analysis of the surface markers on hUCMSCs.图2 流式细胞术分析hUCMSCs的表面标记

Figure 3.Oil red O and alizarin red staining of hUCMSCs.图3 hUCMSCs的油红O染色及茜素红染色

Figure 4.Growth curves of hUCMSCs stimulated with different concentrations of bFGF图4 不同浓度bFGF作用hUCMSCs的生长曲线
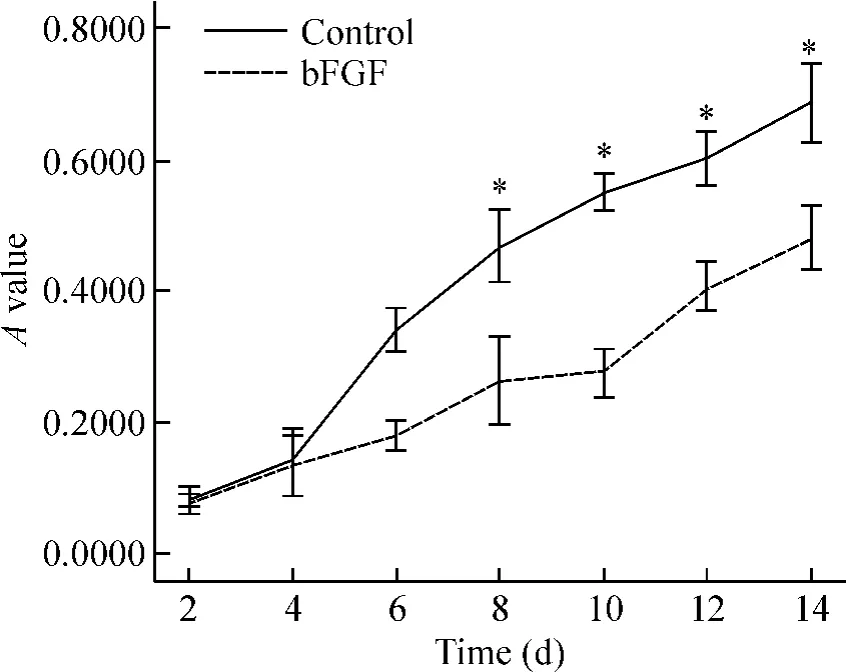
Figure 5.Growth curves of control group and bFGF(20 μg/L)treatment group.Mean ± SD.n=3.*P < 0.05 vs control.图5 bFGF干预后2组hUCMSCs的生长曲线
6 RT-PCR测定2组hUCMSCsⅠ、III型胶原mRNA表达的变化
经bFGF处理的细胞Ⅰ、Ⅲ型胶原mRNA的表达情况见图6。2组间Ⅰ、Ⅲ型胶原mRNA的表达差异有统计学意义(P<0.05),实验组Ⅰ、Ⅲ型胶原mRNA的表达明显低于对照组。
7 Western blotting的检测结果
实验组与对照组相比,I、III型胶原蛋白表达减少,且差异有统计学意义(P<0.05),见图7。
讨 论

Figure 6.Effects of bFGF on collagen I and III mRNA expression in hUCMSCs.hUCMSCs were treated with 20 μg/L bFGF for 30 d.M:DNA marker;1,2,3:bFGF group;4,5,6:control group;1,4:collagen I;2,5:collagen Ⅲ;3,6:β-actin.Mean ± SD.n=3.*P < 0.05 vs control.图6 RT-PCR检测 bFGF对 hUCMSCs I、III型胶原 mRNA表达的影响
本实验所培养的P2 hUCMSCs的流式细胞术检测结果显示:2组 hUCMSCs均表现为 CD29和CD105强阳性,CD34、CD45和HLA-DR阴性。不表达造血干细胞及血管内皮细胞的表面抗原标志CD34、白细胞抗原CD45,证明其为非造血、非内皮类细胞[5];HLA-DR阴性说明该细胞免疫原性很低。因此,本次实验所分离培养的细胞具有间充质干细胞的表型特征。成脂及成骨分化成功提示我们分离培养的是间充质干细胞,可以满足向成肌细胞诱导的需要。有大量国内外研究证实MSCs能分化为心肌细胞,分化的细胞具有相似的动作电位和形成闰盘结构[6],可应用于改善肌原性心衰。我们已成功地将hUCMSCs注射于压力性尿失禁的大鼠尿道周围,并观察到其存活、增殖,改善了尿失禁的体征,形态学上观察可以修复尿道周围的支持结构,但在盆底器官中的应用未见报道。有学者将hUCMSCs注射进胫前肌,胫前肌预先用布比卡因损伤,在体内微环境诱导下,hUCMSCs体内存活2周后分化为骨骼肌细胞,见受损的肌肉完全修复[7]。
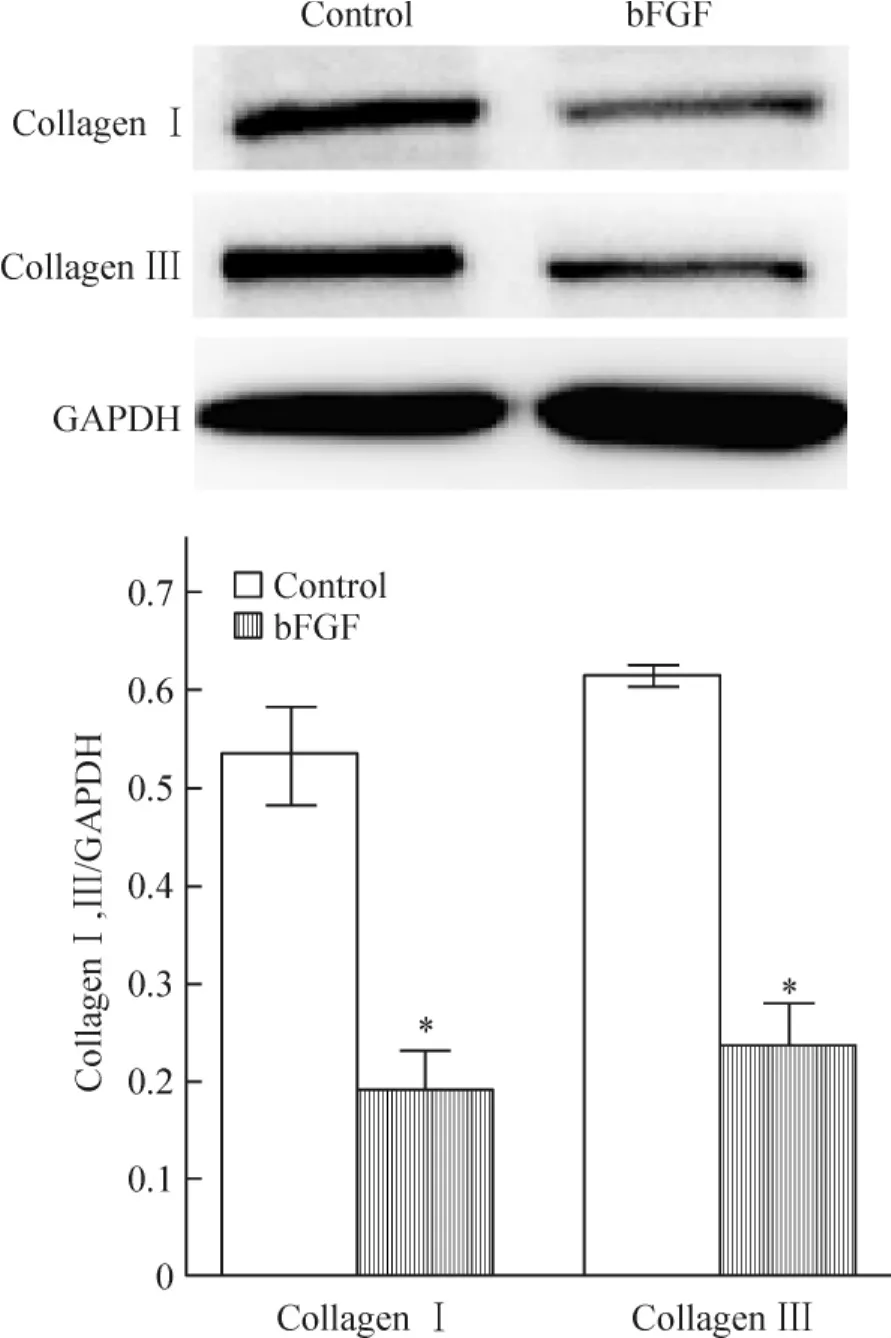
Figure 7.Effects of bFGF on collagen I and III protein expression in hUCMSCs.hUCMSCs were treated with 20 μg/L bFGF for 30 d.Mean ± SD.n=3.*P <0.05 vs control.图7 Western blotting检测bFGF对 hUCMSCs I、III型胶原蛋白表达的影响
近年来的研究发现,bFGF对干细胞的增殖具有重要的促进作用。bFGF是一种作用较广泛的细胞因子,它是一种强丝裂原,对来源于中胚层和外胚层的组织具修复和再生作用,可促进造血干细胞、神经干细胞、胚胎干细胞增殖。Akino等[8]发现在bFGF单独作用或合用2 d后,体外培养的人间充质干细胞的细胞数与对照组相比有显著增长(P<0.05),显示了bFGF促MSCs的增殖的作用。雷军等[9]研究了bFGF、IL-1α、IL-3、IL-6 等因子对人骨髓间充质细胞增殖的作用,发现bFGF促增殖作用最显著。本实验亦证实了bFGF浓度为20 μg/L对体外培养的HUCMSCs具有很明显的促进增殖的作用,与文献报道一致。增加bFGF浓度并不能进一步发挥促增殖作用,其机制可能是bFGF与hUCMSCs表面的受体结合,通过胞内转导通路发挥促增殖作用,因受体数量有限,当bFGF达到一定浓度时受体饱和,此时继续增加浓度但促增殖作用不再增强。
有研究已证实了bFGF具有促损伤修复的作用[10]。Nakagawa等[11]合用 hMSCs和 bFGF 作用于裸鼠的皮肤损伤,伤口面积明显缩小(P<0.01),表明hMSCs与bFGF合用可加快皮肤创面愈合。Anna等[12]用大鼠建立动物模型,用 bFGF作用培养后的自体同源肌细胞注入大鼠损伤的尿道壁,2周后发现,实验组大鼠尿道移植区细胞的数量比对照组增加46%。但bFGF在促创伤修复作用同时是否会引起瘢痕增生已受到学者的广泛关注。Ⅰ、Ⅲ型胶原蛋白的过度沉积且降解减少是增生性瘢痕形成的主要原因[13]。有研究证实在瘢痕组织内胶原蛋白的合成是正常细胞的3倍。Sato等[14]研究表明,瘢痕疙瘩组织中Ⅰ、Ⅲ型胶原的含量显著增加,何威等[15]研究发现疤痕疙瘩成纤维细胞Ⅰ型胶原mRNA升高,其胶原合成量也明显高于正常皮肤真皮成纤维细胞。本实验提示bFGF在促进hUCMSCs增殖的情况下减少了hUCMSCs胶原的合成,对hUCMSCsⅠ型、Ⅲ型胶原mRNA的表达起减少的作用,Western blotting检测结果与RT-PCR结果一致,提示其在促进创面愈合的同时并不会引起Ⅰ、Ⅲ型胶原蛋白沉积而导致瘢痕增生。其机制有待进一步研究。实验结果提示我们可考虑将hUCMSCs与bFGF联合应用于盆底功能障碍性疾病,有效地解决植入聚丙烯网片后所致网片侵蚀、暴露、阴道壁组织瘢痕增生挛缩的问题。本次研究主要探讨在体外环境中bFGF的干预下hUCMSCs增殖及I、III胶原产生的影响,但hUCMSCs与bFGF合用移植于体内受损肌肉组织的微环境中是否直接分化成肌纤维母细胞,并修复盆底受损组织需要我们进一步研究。
[1] Matsumoto T,Okabe T,Ikawa T,et al.Articular cartilage repair with autologous bone marrow mesenchymal cells[J].J Cell Physiol,2010,225(2):291-295.
[2] Shimomura K,Ando W,Tateishi K,et al.The influence of skeletal maturity on allogenic synovial mesenchymal stem cell-based repair of cartilage in a large animal model[J].Biomaterials,2010,31(31):8004-8011.
[3] 王跃春,李业霞,段阿林,等.人脐带间充质干细胞的快速分离、纯化及冻存[J].中国病理生理杂志,2010,26(8):1658-1661.
[4] Sotiropoulou PA,Perez SA,Salagianni M,et al.Characterization of the optimal culture conditions for clinical scale production of human mesenchymal stem cells[J].Stem Cells,2006,24(2):462-471.
[5] Reger RL,Tucker AH,Wolfe MR.Differentiation and characterization of human MSCs[J].Methods Mol Biol,2008,449:93-107.
[6] 陈运贤,何 敏,刘建华,等.心肌梗死大鼠血清促进大鼠骨髓间质干细胞分化为心肌细胞的作用[J].中国病理生理杂志,2007,23(5):853-857.
[7] Conconi MT,Burra P,Di Liddo R,et al.CD105(+)cells from Wharton's jelly show in vitro and in vivo myogenic differentiative potential[J].Int J Mol Med,2006,18(6):1089-1096.
[8] Akino K,Mineta T,Fukuui M,et al.Bone morphogenetic protein-2 regulates proliferation of human mesenchymal stem cells[J].Wound Repair Regen,2003,11(5):354-360.
[9] 雷 军,程腊梅,谭孟群,等.血清及细胞因子对人骨髓间充质干细胞增殖的影响[J].湖南医科大学学报,2003,28(5):469-472.
[10] Xie J,Bian H,Qi S,et al.Effects of basic fibroblast growth factor on the expression of extracellular matrix and matrix metalloproteinase-1 in wound healing[J].Clin Exp Dermatol,2008,33(2):176-182.
[11] Nakagawa H,Aldta S,Fukui M,et al.Human mesenchymal stem cells successfully improve skin-substitute wound healing[J].Br J Dematol,2005,153(1):29-36.
[12] Burdzin'ska A,Bartoszuk U,Orzechowski A.Preincubation with bFGF but not sodium ascorbate improves efficiency of autologous transplantation of muscle-derived cells into urethral wall[J].Urology,2009,73(4):736-742.
[13] Bosman FT,Stamenkovic I.Functional structure and composition of the extracellular matrix[J].J Pathol,2003,200(4):423-428.
[14] Sato M,Ishikawa O ,Miyachi Y.Distinct patterns of collagen gene expression are seen in normal and keloid fibroblasts grown in three-dimensional culture[J].Br J Dermatol,1998,138(6):938-943.
[15] 何 威,刘荣卿,钟白玉.瘢痕疙瘩成纤维细胞胶原合成的实验研究[J].中华皮肤科杂志,1999,32(6):373-375.

