不同稀释度A型肉毒毒素局部注射对小鼠神经肌肉的影响☆
周琛 张为西 冷雁 郑振扬 马震宇 钟志刚
A型肉毒毒素(botulinum toxin type A,BTXA)是厌氧梭状芽孢杆菌代谢过程中产生的一种极强的外毒素,由于其化学性去神经支配作用,近年来逐渐成为治疗面肌痉挛等多种肌张力障碍疾病的重要手段[1]。然而,关于BTX-A局部注射合适的稀释度目前尚无统一意见[2]。Gracies等[3]认为高稀释度的BTX-A局部注射痉挛性偏瘫患者肱二头肌,可发挥更强的神经肌肉阻滞作用,减轻协同收缩及痉挛状态,改善肘关节主动伸展运动;而Lee等[4]研究表明,用不同稀释度BTX-A局部注射治疗脑瘫患儿,对患儿运动功能及步态改善无显著性差异。为明确不同稀释度BTX-A局部肌肉注射的治疗效应,以及是否对局部肌肉、神经产生损害,本研究用C57BL/6J小鼠作为动物模型,对BTX-A合适的稀释度进行探索性研究,为临床合理应用BTX-A提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年C57BL/6J小鼠25只,体重18~26g,雌雄不限,购于中山大学实验动物中心,饲养于中山大学实验动物中心SPF级动物室。
1.1.2 主要试剂 BTX-A(兰州生物制品研究所,规格50U/瓶,批号:20090903);兔抗小鼠神经细胞粘附分子(neural cell adhesion molecule,N-CAM)多克隆抗体(Millipore,美国);山羊抗兔荧光标记二抗(Millipore,美国)。
1.2 研究方法
1.2.1 分组与处理 将25只C57BL/6J小鼠随机分为5组:其中4组小鼠的右侧腓肠肌分别用微量进样器局部注射新鲜稀释度为 1.25U/0.1mL、2.50U/0.1mL、5.00U/0.1mL、10.00U/0.1mL 的 BTX-A,注射剂量均为0.025U;其余1组切断右侧坐骨神经作为阳性对照(去神经支配组);左侧腓肠肌注射等量生理盐水作为阴性对照。
1.2.2 趾运动评分 小鼠腓肠肌注射BTX-A后,第1~14天每天采用趾外展运动5级评分法[5](0分为正常,4分为最大程度的减少腿外伸和趾外展)评价小鼠骨骼肌运动功能恢复情况,即抓住小鼠尾巴使小鼠悬空以引出其特有的惊恐反应,即伸展后腿和外展后腿的脚趾。
1.2.3 腓肠肌动作电位 C57BL/6J小鼠麻醉后固定,玻璃分针游离坐骨神经,连接刺激电极、记录电极、地线,启动BL-420S生物机能实验系统和刺激器,刺激强度从0开始逐渐增加,当刺激强度增加到刚能引起微小动作电位时,此刺激强度称为阈强度,记录其数值;当刺激强度引起的动作电位幅值达最大时,再增加刺激强度,动作电位幅值不再增加,则刚好能引起最大幅值动作电位的刺激强度称为最大刺激强度,记录其数值;观察双向动作电位,记录潜伏期、动作电位峰值[6]。
1.2.4 腓肠肌称重 BTX-A注射后14d,颈椎脱臼法处死小鼠,完整取出双侧腓肠肌分别进行称重,计算右/左侧腓肠肌重量比,观察右侧腓肠肌萎缩程度。
1.2.5 HE染色 BTX-A注射后14d,取小鼠腓肠肌组织冰冻切片行常规HE染色。
1.2.6 免疫荧光检测 BTX-A注射后14d,取小鼠腓肠肌组织冰冻切片行组织免疫荧光检测。PBS漂洗后用山羊血清封闭,滴加兔抗小鼠N-CAM抗体(1:500),湿盒中孵育过夜,PBS漂洗后滴加山羊抗兔荧光标记二抗(1:400),避光湿盒中孵育1h,使用荧光正置显微镜观察并拍照。
1.2.7 电子显微镜检测腓肠肌肌肉、神经 BTX-A注射后14d,取小鼠腓肠肌组织冷却固定并切成小块,经固定、梯度酒精脱水等处理后超薄切片,进行铅-铀双重染色,冲洗干净并使样品自然干燥,金属镀膜法使样品表面导电,使用飞利浦CM-10电镜观察小鼠腓肠肌肌肉、神经超微结构并拍照。
1.3 统计学方法 数据采用SPSS 18.0进行统计分析,数据采用(±s)描述,多组间小鼠趾运动评分比较采用重复测量资料的方差分析,多组小鼠腓肠肌动作电位、右/左腓肠肌重量比的比较采用单因素方差分析,多组间两两比较采用LSD-t检验。检验水准α为0.05,双侧检验。
2 结果
2.1 趾运动评分 采用重复测量资料的方差分析进行统计分析,处理主效应即不同稀释度BTX-A处理组差异有统计学意义(F=14.825,P<0.001),时间主效应即不同时间点差异有统计学意义(F=1231.350,P<0.001),处理与时间的交互效应有统计学意义(F=12.475,P<0.001)。两两比较结果表明:BTX-A注射后1~7 d,不同处理组小鼠趾运动评分均降低,但稀释度为 2.50U/0.1mL、5.00U/0.1mL、10.00U/0.1mL 处理组肌力均较 1.25U/0.1mL组下降较明显(均P<0.001);在BTX-A注射后7~14 d,稀释度为 2.50U/0.1mL、5.00U/0.1mL 处理组均较10.00U/0.1mL组小鼠趾运动恢复不明显(均P<0.001)。见表1。
表1 不同稀释度BTX-A处理组小鼠趾运动评分(±s)
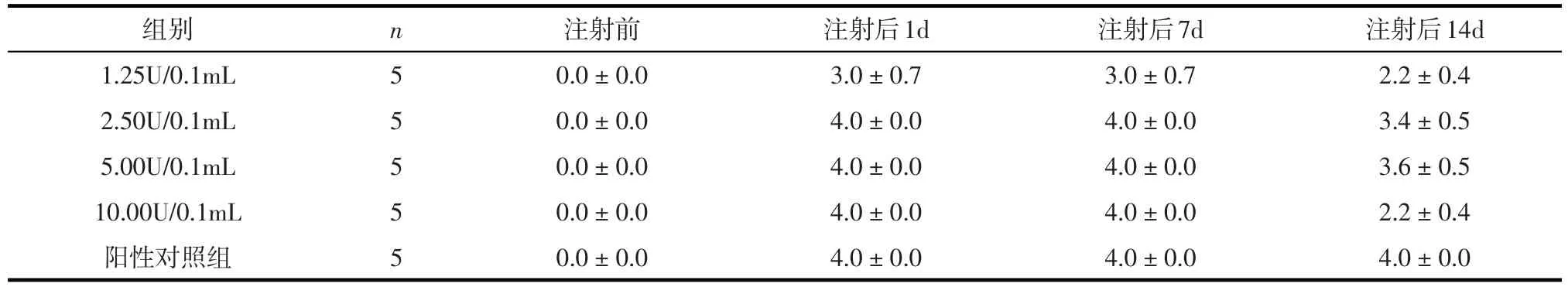
表1 不同稀释度BTX-A处理组小鼠趾运动评分(±s)
注射前0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0组别1.25U/0.1mL 2.50U/0.1mL 5.00U/0.1mL 10.00U/0.1mL阳性对照组n 5 5 5 5 5注射后1d 3.0±0.7 4.0±0.0 4.0±0.0 4.0±0.0 4.0±0.0注射后7d 3.0±0.7 4.0±0.0 4.0±0.0 4.0±0.0 4.0±0.0注射后14d 2.2±0.4 3.4±0.5 3.6±0.5 2.2±0.4 4.0±0.0
2.2 小鼠腓肠肌动作电位 不同稀释度BTX-A处理组小鼠腓肠肌动作电位比较采用方差分析,阈强度电位(F=10.311,P<0.001)、最大刺激强度(F=22.069,P<0.001)、潜伏期(F=94.712,P<0.001)、动作电位峰值(F=164.649,P<0.001)组间差异均有统计学意义。两两比较结果表明,在阈强度电位和最大刺激强度方面,2.50U/0.1mL组、5.00U/0.1mL 组比 1.25U/0.1mL、10.00U/0.1mL 处理组、阴性对照组大(均P<0.001),即需要较强刺激才能引起肌肉收缩;在潜伏期和动作电位峰值方面,各BTX-A处理组均比阴性对照组潜伏期延长(均P<0.001)、动作电位峰值降低(均P<0.001),其中2.50U/0.1mL组和5.00U/0.1mL组比1.25U/0.1mL、10.00U/0.1mL处理组的潜伏期更长(均P<0.001)、动作电位峰值更低(均P<0.001)。见表2。
表2 不同稀释度BTX-A处理组小鼠腓肠肌动作电位(±s)

表2 不同稀释度BTX-A处理组小鼠腓肠肌动作电位(±s)
1)与阴性对照组比较比较,经 LSD-t检验,P<0.001;2)与 1.25U/0.1mL 组比较,经 LSD-t检验,P<0.001;3)与 10.00U/0.1mL 处理组比较,经LSD-t检验,P<0.001。
阈强度电位(V)0.30±0.10 0.50±0.101)2)3)0.50±0.101)2)3)0.30±0.05 0.25±0.05动作电位峰值(mV)5.42±0.111)3.03±0.121)2)3)3.14±0.261)2)3)6.23±0.401)10.40±1.05组别1.25U/0.1mL 2.50U/0.1mL 5.00U/0.1mL 10.00U/0.1mL阴性对照组n 5 5 5 5 5最大刺激强度(V)0.70±0.10 1.60±0.201)2)3)1.46±0.321)2)3)0.73±0.31 0.53±0.15潜伏期(ms)0.82±0.081)1.23±0.101)2)3)1.16±0.111)2)3)0.81±0.111)0.18±0.06
2.3 小鼠右左腓肠肌重量比 BTX-A注射后14天,不同稀释度BTX-A处理组小鼠右/左腓肠肌重量比值组间差异有统计学意义(F=390.462,P<0.001)。两两比较结果表明:稀释度为 1.25U/0.1mL、10.00U/0.1mL 组比阳性对照组大(均 P<0.001),而 2.50U/0.1mL 组(P=0.119)、5.00U/0.1mL组(P=0.688)与阳性对照组无统计学差异。如表3所示。
表3 不同稀释度BTX-A处理组小鼠右/左腓肠肌重量比(±s)

表3 不同稀释度BTX-A处理组小鼠右/左腓肠肌重量比(±s)
1)与阳性对照组比较,经LSD-t检验,P<0.001
右/左腓肠肌重量比0.61±0.011)0.44±0.01 0.45±0.02 0.65±0.011)0.46±0.01组别1.25U/0.1mL 2.50U/0.1mL 5.00U/0.1mL 10.00U/0.1mL阳性对照组n 5 5 5 5 5
2.4 HE染色 BTX-A注射后14d,不同处理组小鼠腓肠肌均呈现细胞大小不一,部分肌细胞变圆、核内移,少量肌细胞间隙增大,稀释度为2.50U/0.1mL、5.00U/0.1mL组较1.25U/0.1mL、10.00U/0.1mL组肌细胞间隙增宽、细胞萎缩较明显,如图1 A1~F1所示。
AIS是较常见脑血管类疾病[7]。有研究显示,炎症反应在AIS的发病及预后中发挥重要作用,其中,细胞因子作为炎症反应所释放出的炎症介质,在AIS发生过程中起一定的调节作用[8-9]。IL-33可通过多种细胞和组织表达,对心脑血管起保护作用[10-11]。CXCL12可介导炎症反应,较好地促进组织及血管再生。
2.5 免疫荧光检测 BTX-A注射后14d,免疫荧光检测小鼠腓肠肌N-CAM表达。稀释度为2.50U/0.1mL、5.00U/0.1mL处理组 N-CAM 阳性表达细胞较稀释度为 1.25U/0.1mL、10.00U/0.1mL 处理组为多,如图1 A2~F2所示。
2.6 电子显微镜检测 BTX-A注射后14d,稀释度为 2.50U/0.1mL、5.00U/0.1mL 处理组较稀释度为1.25U/0.1mL、10.00U/0.1mL 处理组肌肉及神经结构变性显著,可见其肌浆网明显肿胀、线粒体空泡变性、肌节排列紊乱,神经轴索、髓鞘变性,轴索萎缩、髓鞘凹陷、细胞器肿胀变性、外膜崩解、神经丝缠结,如图1 A3~F4所示。
3 讨论
BTX-A选择性作用于外周胆碱能运动神经元的突触前膜,与突触囊泡蛋白2结合后被摄取,通过降解突触小体相关蛋白-25,导致不能形成突触融合复合体,突触小囊与突触前膜融合受阻,抑制突触前膜释放含有乙酰胆碱的囊泡,阻断神经冲动传递,使其支配的效应器官(肌肉等)出现功能减弱,引起肌肉松弛性麻痹,这种作用称为化学性去神经支配作用[7-8]。本研究通过观察BTX-A局部注射对作为运动效应器的肌肉以及支配该肌肉的周围神经的影响,间接反映BTX-A的化学性去神经支配作用。
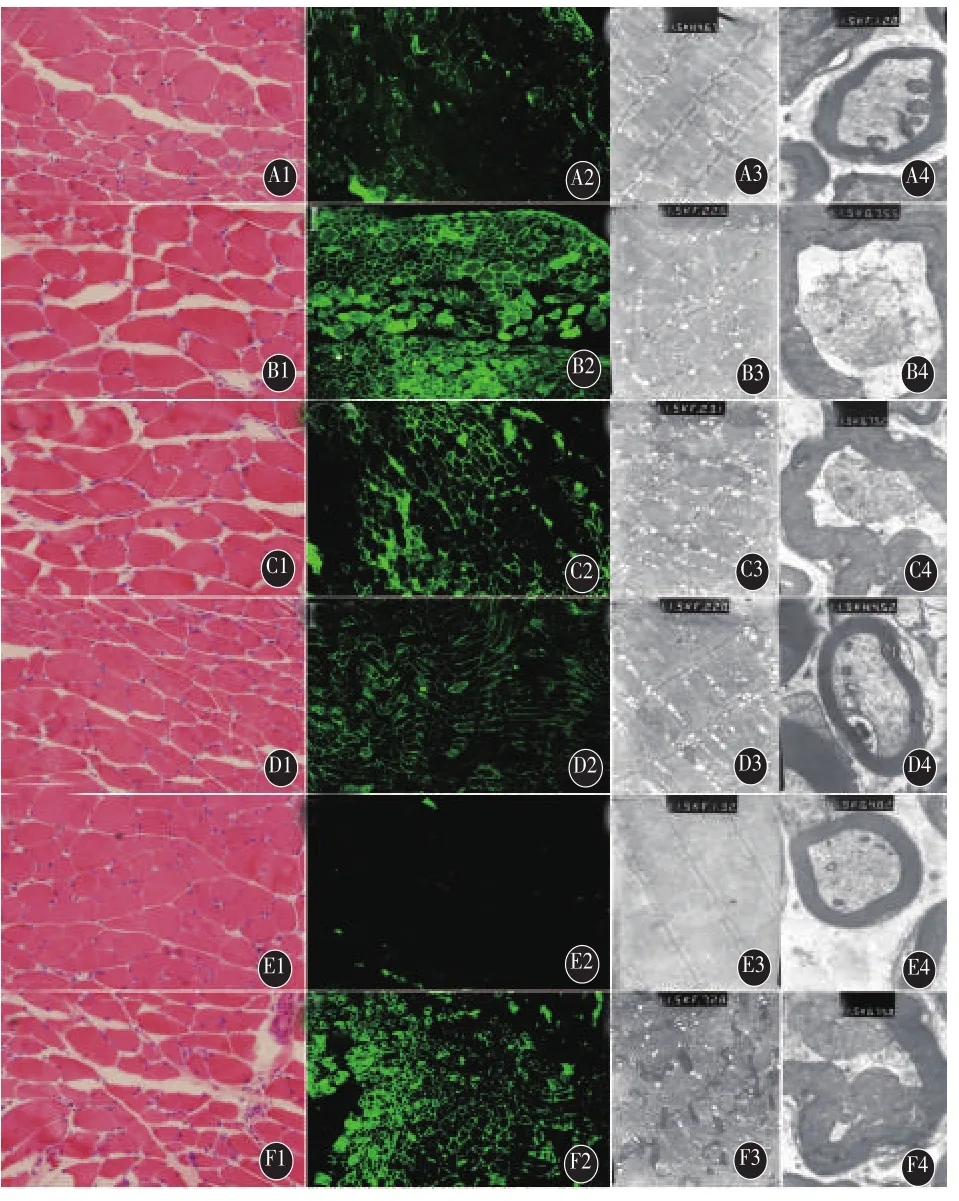
图1 不同稀释度BTX-A处理组注射后14d小鼠腓肠肌形态学变化。A1~A4:1.25U/0.1mL 处理组;B1~B4:2.50U/0.1mL 处理组;C1~C4:5.00U/0.1mL处理组;D1~D4:10.00U/0.1mL处理组;E1~E4:阴性对照组;F1~F4:阳性对照组(A1~F2,200×;A3~F4,10000×)。A1~F1:HE染色,示稀释度为2.50U/0.1mL(B1)、5.00U/0.1mL处理组(C1)较1.25U/0.1mL(A1)、10.00U/0.1mL处理组(D1)肌细胞间隙增宽、细胞萎缩明显;A2~F2:免疫荧光检测N-CAM表达,示稀释度为 2.50U/0.1mL(B2)、5.00U/0.1mL 处理组(C2)NCAM 阳性表达细胞较稀释度为 1.25U/0.1mL(A2)、10.00U/0.1mL处理组(D2)为多;A3~F3:电镜检测小鼠腓肠肌超微结构,示稀释度为2.50U/0.1mL(B3)、5.00U/0.1mL处理组(C3)较稀释度为1.25U/0.1mL(A3)、10.00U/0.1mL 处理组(D3)肌肉变性明显,可见肌浆网肿胀、线粒体空泡变性、肌节排列紊乱;A4~F4:电镜检测小鼠神经超微结构,示稀释度为2.50U/0.1mL(B4)、5.00U/0.1mL处理 组(C4)较稀释度为 1.25U/0.1mL(A4)、10.00U/0.1mL 处理组(D4)轴索、髓鞘变性明显,可见轴索萎缩、髓鞘凹陷、细胞器肿胀变性、外膜崩解、神经丝缠结。
本研究采用BTX-A对C57BL/6J小鼠腓肠肌进行局部注射后,小鼠趾运动评分显示:2.50U/0.1mL、5.00U/0.1mL BTX-A 导致小鼠骨骼肌肌力较快下降,腓肠肌需要较强刺激才能引起收缩,且收缩较慢、收缩强度较小;免疫荧光检测发现2.50U/0.1mL、5.00U/0.1mL 处理组腓肠肌 N-CAM阳性表达较多,表明其化学性去神经支配作用较强。N-CAM是一种膜糖蛋白,它只在胚胎期肌管表达,在生长发育过程中不再表达,但当肌肉去神经支配后,可诱发N-CAM重新聚集于肌纤维表面,可作为BTX-A化学性去神经支配效应的敏感检测指标[9];电镜下2.50U/0.1mL、5.00U/0.1mL处理组肌纤维结构紊乱、Z线断裂、线粒体增多、空泡变性较显著,神经轴索、髓鞘变性也较明显,提示其化学性去神经支配作用较其他处理组强。因此,本研究发现 2.50U/0.1mL、5.00U/0.1mL 两种稀释度的BTX-A化学性去神经支配作用较强。
本研究发现 2.50U/0.1mL、5.00U/0.1mL 两种稀释度BTX-A相比化学性去神经支配作用没有显著性差异,这与Francisco等[10]、崔利华等[11]和王国栋等[12]的研究结果一致。而稀释度为10.00U/0.1mL组虽有一定作用,但其趾运动评分在14天时恢复较为明显,作用不及 2.50U/0.1mL、5.00U/0.1mL组,可能与其稀释度过高导致扩散较慢有关[9,13]。稀释度为1.25U/0.1mL的BTX-A达不到最佳去神经支配作用,与稀释度过低使药物稳定性降低有关[9,14]。通常认为,BTX-A在温度过高或溶液过多时药物易分解失效,稀释度为1.25U/0.1mL时需要较多生理盐水,导致BTX-A性状改变而使毒素失去部分活性[15]。然而,也有研究认为较低稀释度的BTX-A药物作用效果等同甚至优于较高稀释度的BTX-A。胡兴越等[16]研究提示稀释度为 1.7U/0.1mL 和 2.5U/0.1mL 的 BTX-A 效果相当,罗蔚锋等[17]认为稀释度为1.25U/0.1mL比稀释度为5U/0.1mL的BTX-A肌肉松弛作用好,Kim等[14]比较了稀释度为10U/0.1mL和2U/0.1mL BTX-A的肌肉松弛作用,发现后者效果较好。此结果可能与BTX-A稀释后溶液量增多,影响了较多数量的运动终板,在较短时间内与神经肌肉接头的胆碱能突触前受体结合,抑制乙酰胆碱释放,从而使肌肉松弛较明显。
在局部肌肉注射治疗肌张力障碍中,BTX-A发挥肌肉松弛作用与其稀释度有关。药物稀释度过低,不能充分发挥其作用;而稀释度过高,不利于药物扩散,且较易出现毒副作用。本研究发现,2.50U/0.1mL 和 5.00U/0.1mL BTX-A 局部注射起效快、维持作用时间长且去神经支配作用强,它们可能是BTX-A局部注射合适的稀释度。但是BTXA的作用维持时间一般为3~6个月[18],本研究未在不同时间点对不同稀释度BTX-A化学性去神经支配效应的动态变化进行观察,这是本研究的不足之处。本课题组将在下一步研究中选取不同时间点,动态观察不同稀释度BTX-A局部注射对小鼠神经肌肉的影响,以期为临床合理应用BTX-A提供实验依据。
[1]Schulte-Mattler WJ.Use of botulinum toxin A in adult neurological disorders:efficacy,tolerability and safety[J].CNS Drugs,2008,22(9):725-738.
[2]de Sa EA,Marmur ES.The five D's of botulinum toxin:doses,dilution,diffusion,duration and dogma[J].J Cosmet Laser Ther,2008,10(2):93-102.
[3]Gracies JM,Lugassy M,Weisz DJ,et al.Botulinum toxin dilution and endplate targeting in spasticity:a double-blind controlled study[J].Arch Phys Med Rehabil,2009,90(1):9-16.
[4]Lee JH,Sung IY,Yoo JY,et al.Effects of different dilutions of botulinum toxin type A treatment for children with cerebral palsy with spastic ankle plantarflexor:a randomized controlled trial[J].J Rehabil Med,2009,41(9):740-745.
[5]Aoki KR.A comparison of the safety margins of botulinum neurotoxin serotypes A,B,and F in mice[J].Toxicon,2001,39(12):1815-1820.
[6]陈静嫦,麦光焕,余新平,等.A型肉毒杆菌毒素水凝胶去神经支配作用的定量研究[J].中国应用生理学杂志,2008,24(1):104-107.
[7]Wortzman MS,Pickett A.The science and manufacturing behind botulinum neurotoxin type A-ABO in clinical use[J].Aesthet Surg J,2009,29(6 Suppl):S34-S42.
[8]Lucioni A,Bales GT,Lotan TL,et al.Botulinum toxin type A inhibits sensory neuropeptide release in rat bladder models of acute injury and chronic inflammation[J].BJU Int,2008,101(3):366-370.
[9]Carli L,Montecucco C,Rossetto O.Assay of diffusion of different botulinum neurotoxin type a formulations injected in the mouse leg[J].Muscle Nerve,2009,40(3):374-380.
[10]Francisco GE,Boake C,Vaughn A.Botulinum toxin in upper limb spasticity after acquired brain injury:a randomized trial comparing dilution techniques[J].Am J Phys Med Rehabil,2002,81(5):355-363.
[11]崔利华,张通,杨凌宇.不同稀释A型肉毒毒素的方法对脑卒中后上肢痉挛疗效的观察[J].中国当代医药,2009,16(5):130-131.
[12]王国栋,赵永波.不同稀释度A型肉毒毒素治疗偏侧面肌痉挛的疗效观察[J].中国全科医学,2009,12(15):1428-1429.
[13]Tsai FC,Hsieh MS,Chou CM.Comparison between neurectomy and botulinum toxin A injection for denervated skeletal muscle[J].J Neurotrauma,2010,27(8):1509-1516.
[14]Kim HS,Hwang JH,Jeong ST,et al.Effect of muscle activity and botulinum toxin dilution volume on muscle paralysis[J].Dev Med Child Neurol,2003,45(3):200-206.
[15]Lebeda FJ,Cer RZ,Stephens RM,et al.Temporal characteristics of botulinum neurotoxin therapy[J].Expert Rev Neurother,2010,10(1):93-103.
[16]胡兴越,邵宇权,吕文,等.不同稀释浓度A型肉毒毒素治疗痉挛性斜颈的对照研究[J].中华物理医学与康复杂志,2002,24(12):721-722.
[17]罗蔚锋,刘春风,包仕尧,等.不同稀释度A型肉毒毒素治疗痉挛性斜颈的疗效观察[J].临床神经病学杂志,2004,17(6):463-464.
[18]Evidente VG,Adler CH.An update on the neurologic applications of botulinum toxins[J].Curr Neurol Neurosci Rep,2010,10(5):338-344.
——从一道浙江选考生物学试题谈起

