土壤中产α-淀粉酶菌株的分离和筛选
杨 杨,刘毕琴,张 发,廖光辉,杨晓燕
(大理学院农学与生物科学学院,云南大理 671003)
α-淀粉酶(α-amylase),编号:EC 3.2.1.1,作用于淀粉时从淀粉分子的内部随机切开α-1,4糖苷键,是一种只能催化水解直链淀粉的液化酶〔1〕。通常采用酶活力(enzyme activity)来表示酶催化一定化学反应的能力〔2〕。一般情况下,α-淀粉酶的作用温度范围60~90℃,最适宜作用温度为60~70℃,作用pH值范围5.5~7.0,最适pH值为6.0。α-淀粉酶主要存在于人的唾液和胰脏中,也存在于麦芽、蟑螂涎腺、芽孢杆菌、枯草杆菌、黑曲霉和米曲霉中。α-淀粉酶酶制剂大量应用于粮食加工、食品工业、酿造、发酵、纺织品工业和医药行业等,占酶制剂市场份额的25%左右〔3-4〕。目前,工业生产上都以微生物发酵法大规模生产α-淀粉酶,最常用的方法是从自然界中筛选出可以产这种酶的目的菌种,大致可以分为以下4个步骤:采样、增殖培养、纯种分离和性能测定〔5-6〕。土壤是微生物生活的大本营,是发掘微生物资源的重要基地,可以从中分离、纯化得到期望中的菌株,再对菌株进行发酵培养,生产出所需的酶〔7〕。由于我国的α-淀粉酶制剂的品种和生产菌株都很单一,α-淀粉酶酶活力相对于国外同行业的较低〔8〕。本研究旨在从富含淀粉类物质的土壤中分离纯化出产α-淀粉酶的菌株,通过水解圈直径和菌落直径的比值,结合酶活力大小进行比较,筛选出产酶活力较强的菌株,并对其所产的酶进行初步的酶学性质研究。研究结果可为α-淀粉酶的生产提供种质资源,同时也为生产实践提供数据支持和理论参考。
1 材料
1.1 样品采集 土壤样品分别采自大理学院校园面食食堂附近空地、晾晒谷物空地、食堂附近绿化带和洗碗池旁,共4份,编号1~4。
1.2 培养基的制备
1.2.1 淀粉琼脂培养基 2.0 g可溶性淀粉,10 g蛋白胨,5 g牛肉膏,5 g NaCl,加少量蒸馏水加热溶解,然后称量16 g琼脂加入烧杯中溶化,补蒸馏水至1000 mL,再用1 mol/L的NaOH或1 mol/L的HCl,调节 pH 至6.4〔9〕。
1.2.2 产α-淀粉酶发酵培养基 22.5 g面粉、10 g牛肉膏、2 g NaNO3、1.5 g K2HPO4、0.5 g MgSO4、0.005 g FeS04·7H2O,补蒸馏水至500 mL〔10〕。
2 方法
2.1 α-淀粉酶产生菌的分离 在超净工作台上,各称取土样10 g,分别加入到装有90 mL无菌水的灭菌三角瓶中,震荡摇匀,置80℃水浴10 min,以倍比稀释法分别制备10-4~10-6稀释度的土壤悬液。用移液管从10-4、10-5、10-6这3个梯度的试管中取土壤悬液1 mL注入无菌培养皿中,然后加入适量经过灭菌融化的淀粉琼脂培养基,摇匀、冷却、标记后,倒置于37℃恒温培养箱中培养24~48 h〔9〕。待长出菌落后,将新碘标准液加入到生长最好的平板中,菌落周围若形成水解圈,便是产α-淀粉酶的菌株,测量这些菌株的菌落直径和水解圈直径,记录编号。挑取有水解圈的单菌落,转接平板,得到纯种,继续转接于平板和试管斜面,37℃培养24 h后置4℃冰箱保藏,作为工作菌株备用。
2.2 α-淀粉酶的酶活力测定
2.2.1 发酵培养 找出每种菌株生长最好的稀释度平板,将该稀释度平板制成菌悬液。以接种量为4 mL,接到发酵培养基中,最适发酵初始pH值为7,装液量为40 mL。发酵温度为33.5℃,摇床培养72 h,进行发酵培养〔11〕。
2.2.2 原酶液的制备 首先,采用硫酸铵沉淀法从发酵液中粗提取α-淀粉酶〔12〕。全部操作过程均在室温下进行。每种菌株发酵液以4000 rmp离心10 min去菌体,所得上清液为粗酶液。粗酶液各取5 mL,分别同时加入1.87 g(NH4)2SO4细粉末,混匀,静置30 min。以4000 rmp离心10 min,离心去除上清液保留沉淀,将沉淀在40℃下烘干,制成酶粉。再将0.1 g酶粉溶于1 mL无菌水,制成原酶液。
2.2.3 酶活力的测定 反应体系为5 mL 0.5%淀粉和0.5 mL稀释了200倍的原酶液,pH值6.0,50℃下反应5 min后,加0.1 mol/L H2SO45 mL终止反应,取0.5 mL反应液加入5 mL Lugol氏碘液稀释液,溶液显色,在660 nm波长下测吸光度。查看吸光度与α-淀粉酶酶浓度对照表〔13〕,找出相应测试酶液的浓度,通过下面公式计算出样品的酶活力。
公式:X=cn,
式中:X为样品的酶活力〔U/g(U/mL)〕,
c为测试酶液的浓度(U/mL),
n为样品的稀释倍数。
2.3 α-淀粉酶产生菌的形态学观察 将产酶活力最强的菌株接种于淀粉琼脂培养基〔9〕,37℃恒温培养箱中培养24 h后观察菌落的形态特征,并通过革兰氏染色和芽孢染色法对菌株进行形态学鉴定〔14〕。
2.4 α-淀粉酶学性质研究
2.4.1 α-淀粉酶最适反应温度 分别取制备好的产酶活力最强菌株的发酵液5 mL,在温度梯度为30℃、40℃、50℃、60℃、70℃、80℃的情况下测定酶活力,以确定α-淀粉酶最适反应温度。
2.4.2 酶反应最适pH值 反应体系的pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5的缓冲液,再将0.1%可溶性淀粉作为底物,加入5 mL制备好的产酶活力最强菌株的发酵液反应5 min,测定酶活力,以确定该酶反应最适pH值。
3 结果
3.1 α-淀粉酶产生菌的筛选 从土壤样品共分离到4株α-淀粉酶产生菌,水解圈测定结果见表1。由表1可见,菌株4的内外径比值较大,为2.800。

表1 菌株水解圈直径比较
3.2 α-淀粉酶的酶活力测定 菌株1~4的酶活力测定结果见表2。从表2可知,菌株4产酶活力最高。
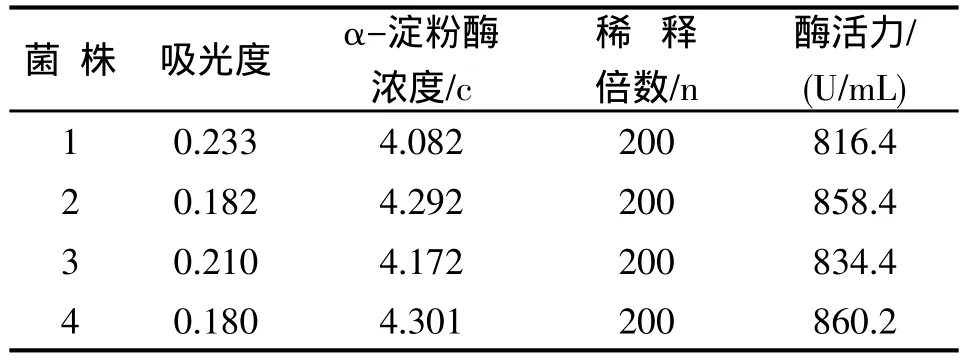
表2 酶活力的计算结果
3.3 菌株4形态学特征 菌株4的菌落表面光滑,不透明,呈规则的圆形。菌体经革兰氏染色呈杆状,为革兰氏阳性菌。经芽孢染色后菌体中可见绿色芽孢,故初步鉴定菌株4为芽孢杆菌。
3.4 α-淀粉酶酶学性质
3.4.1 菌株4产α-淀粉酶酶促反应最适温度 结果见图1。由图1可知,菌株4产α-淀粉酶酶促反应最适温度范围为50~60℃
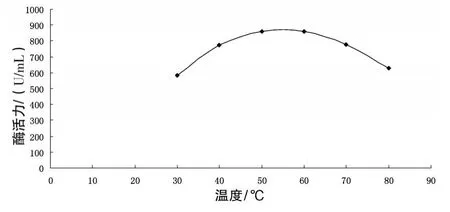
图1 α-淀粉酶热稳定性
3.4.2 菌株4产α-淀粉酶酶促反应最适pH值 结果见图2。由图2可知,菌株4产α-淀粉酶酶促反应适合pH值范围在4.0~7.5之间,最适pH值为6.2。
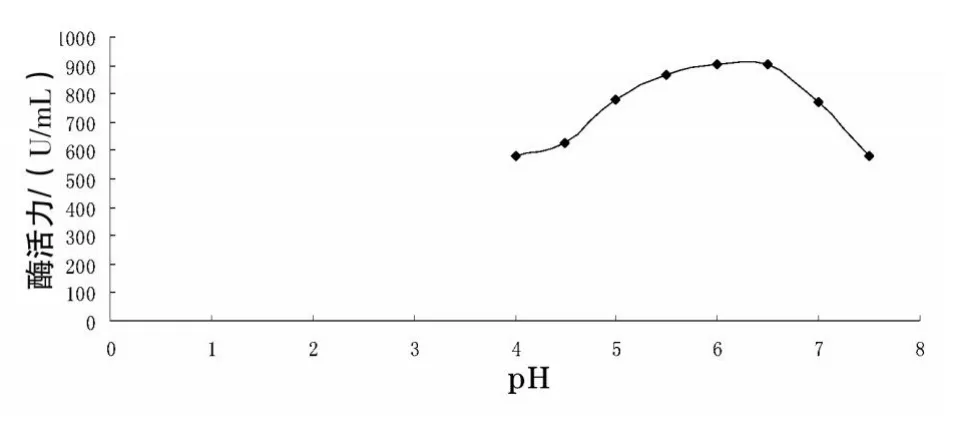
图2 不同pH值反应体系中对酶活力的影响
4 讨论
菌株4所产酶的酶活力最强,其所在土壤表层含淀粉类物质最多,水分充足。推测这样的土壤适合产淀粉酶活力较强的菌株的生长。
在测定α-淀粉酶酶活力时常采用白瓷板目视比色法。该方法是以酶与淀粉的呈色反应为基础,肉眼观察酶反应的终点,直接根据公式计算酶活力。虽然此方法简便快速,但是在确定反应终点时,由于主观因素的影响会造成误差,并且标准色的不稳定性以及色泽与反应液的不一致,都将影响酶活力最终计算结果。因此,本实验在测定α-淀粉酶酶活力时均采用分光光度计法,此方法克服了白瓷板目视比色法的各种缺点。同时应用(NH4)2SO4盐析法,粗提取α-淀粉酶,将该酶稀释200倍,吸光度便调整到了0.178~0.425范围内,可以查看吸光度与α-淀粉酶酶浓度对照表〔14〕,计算酶活力,这样更准确可靠。
〔1〕张驰,陈固.甘薯果脯加工工艺研究〔J〕.食品研究与开发,2001,22(6):28-30.
〔2〕郭勇.酶工程原理与技术〔M〕.北京:高等教育出版社,2010:8-9.
〔3〕孙晓菲,李爱江.α-淀粉酶的应用及研究现状〔J〕.畜牧兽医科技信息,2008(6):13-14.
〔4〕罗志刚,杨景峰,罗发兴.α-淀粉酶的性质及应用〔J〕.食品研究与开发,2007,28(8):163-167.
〔5〕谷军.α-淀粉酶的生产与应用〔J〕.生物技术,1994,4(3):1-5.
〔6〕唐嘉,陈朝银,夏静,等.一种初筛产胞外淀粉酶菌株的简化方法〔J〕.生物加工过程,2008,6(1):1.
〔7〕燕卫东.贫瘠土壤中淀粉酶产生菌株的筛选〔J〕.中国酿造,2008(12):73-74.
〔8〕杨自明,张金辉,苏静,等.一株黑曲霉所产α-淀粉酶的提取及其特性研究〔J〕.河南职工医学院学报,2006,18(6):431.
〔9〕石飞虹,周友超,郭翠,等.工业生产中耐高温α-淀粉酶发酵培养基的优化研究〔J〕.食品与机械,2009,25(5):54-56.
〔10〕安弋,刘新育,刘亮伟,等.1株酸性α-淀粉酶产生菌的鉴定及发酵条件优化〔J〕.安徽农业科学,2010,38(4):1709-1711.
〔11〕朱中南,郑毅,章淑妹.α-淀粉酶发酵条件的优化〔J〕.海峡科学,2011(12):22-25.
〔12〕姜永明,隋德新,史永昶.枯草芽孢杆菌86315α-淀粉酶的研究、分离提纯、性质及动力学〔J〕.江苏农学院学报,1992,13(2):15-20.
〔13〕全国食品发酵标准化中心.工业用酶制剂行业标准资料汇编〔M〕.1993:37-44.
〔14〕沈萍,陈向东.微生物学实验〔M〕.北京:高等教育出版社,2007:187-190.

