丝裂原活化蛋白激酶信号通路抑制剂对断奶仔猪小肠形态和肠通透性的影响
栾兆双 宋 娟 胡彩虹
(浙江大学饲料科学研究所,动物分子营养学教育部重点实验室,杭州 310058)
肠道是机体与外界环境接触最为密切的部位,不仅是消化、吸收营养物质的重要场所,而且是机体的重要免疫屏障。肠道损伤所涉及的缺血、炎症、凋亡等多个病理机制与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号道路的调节有关。MAPK信号通路是广泛存在于真核生物中保守的信号转导系统,MAPK被激活后可停留在胞质中,激活一系列其他蛋白激酶,亦可进入细胞核调节相应基因的表达,完成对细胞外刺激的反应。MAPK参与调节细胞的生长、发育、分化、凋亡、对环境的应激适应、炎症反应等多种重要的细胞生理/病理过程[1-3]。目前已在哺乳动物细胞克隆和鉴定了4个MAPK亚族:胞外信号调节激酶 1/2(external-signal regulated kinase,ERK1/2)、c-Jun N末端激酶(c-Jun N-terminal kinase,JNK)、p38 MAPK和胞外信号调节激酶5(ERK5)。Broom 等[2]报道,炎症性肠疾病引起ERK1/2、p38 MAPK被激活,MAPK激活时间、程度与肠损伤时间、程度一致。大量研究表明,断奶应激使仔猪肠形态受损,消化吸收能力下降[4],并且使仔猪肠道的通透性增加,破坏肠屏障功能[5-6]。然而关于早期断奶应激引起仔猪肠道损伤的信号转导机制尚不清楚[7]。MAPK是否参与此过程目前尚未见报道。本试验通过MAPK信号通路抑制剂预处理断奶仔猪,旨在研究阻断p38 MAPK、JNK和ERK信号通路对断奶仔猪小肠形态和肠通透性的影响,为防治仔猪早期断奶应激引起的肠道损伤提供新的思路。
1 材料与方法
1.1 试验动物与试验设计
试验选用体重约为5.8 kg的24头21日龄杜×长×大断奶仔猪,随机分成4组,每组6头。试验组断奶前30 min分别腹腔注射p38 MAPK抑制剂(2 mg/kg SB203580,Ⅰ组)、JNK 抑制剂(4 mg/kg SP600125,Ⅱ组)和 ERK1/2抑制剂(2 mg/kg PD98059,Ⅲ组),对照组注射等量的生理盐水。仔猪自由采食和饮水,按常规程序进行管理。于断奶后36 h屠宰仔猪取样待测。
1.2 饲粮及营养水平
基础饲粮参照美国NRC(1998)断奶仔猪的营养需要配合成颗粒饲料。基础饲粮组成及营养水平见表1。
1.3 样品采集与测定
仔猪早晨空腹前腔静脉取血,肝素抗凝,制备血浆,-80℃保存。屠宰后,沿肠系膜纵向切开小肠,取空肠中段长度约1 cm的肠管,浸入10%福尔马林固定液中4℃保存。另取10 cm左右空肠用剪刀剖开,用生理盐水轻轻冲洗肠内容物,用滤纸吸干水分,再用手术刀钝面轻轻刮取肠黏膜,分装在5 mL无菌冻存管中,液氮速冻,-80℃保存。
1.3.1 小肠形态分析
用一系列浓度梯度的乙醇脱水,二甲苯透明,石蜡包埋、切片,苏木精-伊红染色,中性树胶封片。Leica Qwin图像分析仪测定绒毛高度和隐窝深度。
1.3.2 肠通透性
血浆D-乳酸含量测定参照Brandt等[8]建立的分光光度法。血浆二胺氧化酶(DAO)含量用猪DAO ELISA试剂盒(Uscn Life Science公司,美国)测定。
1.3.3 小肠黏膜促炎细胞因子水平
称取一定量黏膜,按1∶9加入磷酸盐缓冲液,匀浆,3 000 r/min离心10 min,取上清液,制备成10%的黏膜匀浆液,促炎细胞因子肿瘤坏死因子α(TNF-α)、白细胞介素 1β(IL-1β)、白细胞介素 6(IL-6)和干扰素γ(IFN-γ)水平采用ELISA试剂盒(R&D System,美国)测定。

表1 基础饲粮组成及营养水平(干物质基础)Table1 Composition and nutrient levels of the basal diet(DM basis) %
1.4 数据统计
数据计算程序采用SAS 6.12中的一般线性模型(general linear models)进行,平均值的比较采用Duncan氏法进行,以P<0.05作为差异显著性判断标准。
2 结果
2.1 空肠形态
由表2可知,Ⅰ组绒毛高度和绒毛高度/隐窝深度均高于对照组(P<0.05),隐窝深度显著低于对照组(P<0.05);与对照组相比,Ⅱ组绒毛高度/隐窝深度显著提高(P<0.05),而Ⅲ组各指标均未显著变化(P>0.05)。
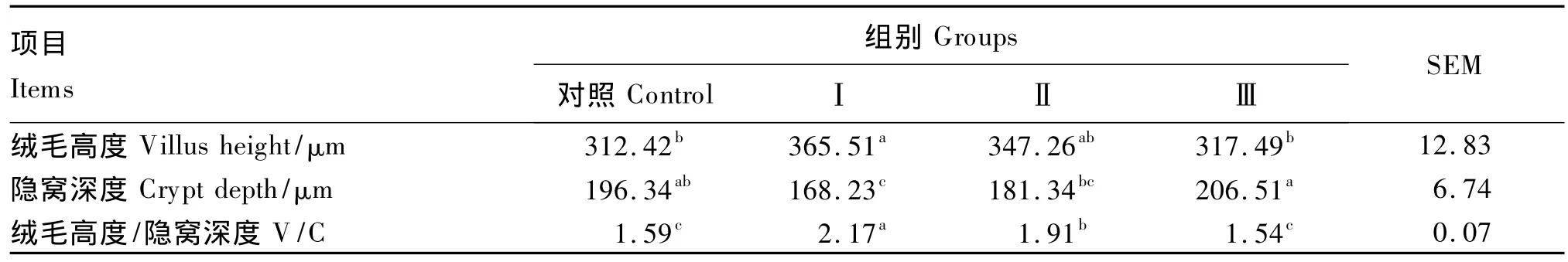
表2 不同MAPK通路抑制剂对断奶仔猪空肠形态的影响Table2 Effects of different inhibitors of MAPK pathways on jejunal morphology of weaner piglets
2.2 肠通透性
由表3可知,与对照组相比,Ⅰ组和Ⅱ组仔猪血浆D-乳酸、DAO含量显著降低(P<0.05),Ⅰ组降低程度较大,而Ⅲ组仔猪血浆D-乳酸含量显著升高(P<0.05)。

表3 不同MAPK通路抑制剂对断奶仔猪肠通透性的影响Table3 Effects of different inhibitors of MAPK pathways on intestinal permeability of weaner piglets
2.3 空肠黏膜细胞因子
由表4可知,Ⅰ组空肠黏膜促炎细胞因子TNF-α、IL-1β、IL-6 和 IFN-γ 水平显著低于对照组(P<0.05);与对照组相比,Ⅱ组TNF-α和 IL-1β水平显著降低(P<0.05),IL-6和IFN-γ水平均未显著变化(P>0.05),而Ⅲ组TNF-α水平显著升高(P<0.05),IL-6和IFN-γ水平有上升的趋势,但差异不显著(P>0.05)。

表4 不同MAPK通路抑制剂对断奶仔猪空肠黏膜促炎细胞因子的影响Table4 Effects of different inhibitors of MAPK pathways on jejunum mucosal pro-inflammatory cytokines of weaner piglets pg/mg prot
3 讨论
MAPK信号转导途径是细胞内多条信号通路的汇聚点,包括蛋白激酶C、离子通道等,它介导了细胞的生长、发育、分裂、死亡以及细胞间的功能同步等多种细胞生理过程。p38 MAPK和JNK均是应激激活的MAPK,能被炎症、应激、损伤等信号激活[1-2,10]。p38 MAPK 和 JNK 信号转导通路在炎症与细胞凋亡等应激反应中发挥重要作用。
D-乳酸是胃肠道固有细菌的代谢终产物,哺乳动物体内不具备将其快速代谢分解的酶系统,因而血浆中D-乳酸含量的增加可反映肠通透性的改变。DAO是哺乳动物肠绒毛上皮细胞的标记酶,其活性与绒毛高度和黏膜细胞的核酸和蛋白质合成密切相关,可作为反映肠黏膜屏障功能损伤的理想指标[9]。早期断奶应激会引起仔猪肠形态发生改变,主要表现为绒毛高度下降,隐窝深度加深,肠绒毛上成熟细胞数量减少,且黏膜的消化酶活性下降[11-12],从而造成仔猪肠道消化吸收面积减少,消化能力下降,使仔猪肠道屏障功能受损[4,13-14]。前期作者研究了早期断奶对仔猪肠黏膜屏障变化以及p38 MAPK信号通路的影响,结果表明,与哺乳组相比,21日龄仔猪断奶后24和48 h小肠形态和黏膜屏障受损,断奶应激激活了p38 MAPK信号通路[15]。本试验发现,与对照组相比,断奶前腹腔注射p38 MAPK和JNK抑制剂,仔猪小肠形态得到明显的改善,肠道通透性显著降低(血浆 D-乳酸、DAO含量显著降低),p38 MAPK抑制剂效果较明显。p38 MAPK能激活细胞内一些蛋白激酶,进而激活低分子质量热休克蛋白27(HSP27),介导细胞骨架重构以及促进肠损伤后上皮细胞存活、增殖和修复过程[1]。本试验中p38 MAPK抑制剂处理后有较好的肠道改善效果可能与此有关。
细胞因子在肠黏膜免疫应答中起重要作用,而且还参与维持上皮组织的完整性。断奶因饲粮和环境的突然变化而产生的应激引起仔猪肠道细胞因子网络发生改变,以适应肠道在形态学和功能上的变化。Pie等[16]研究发现,28日龄断奶使仔猪肠黏膜免疫系统产生早期的、暂时性的炎症应答,在小肠中部,TNF-α、IL-1β 和 IL-6 mRNA 等表达水平在断奶后的前2天内迅速增加,随后恢复到断奶前水平。p38 MAPK的激活与炎症反应密切相关,调节多种炎性细胞因子基因表达,调控炎症反应[17]。本试验发现,与对照组相比,断奶前腹腔注射p38 MAPK和JNK抑制剂仔猪小肠促炎细胞因子表达量显著降低,p38 MAPK抑制剂效果较明显。Mihaescu 等[18]报道,ERK1/2、JNK、p38 MAPK参与辐射导致的肠黏膜损伤,用特异性p38 MAPK抑制剂SB203580抑制p38 MAPK活性,可明显减少TNF-α释放,减轻肠黏膜组织损伤。还有学者利用Caco-2、T84等细胞模型,研究了促炎因子TNF-α、IFN-γ等对肠通透性的影响,结果发现促炎因子可通过改变肠上皮细胞紧密连接蛋白的基因表达和分布,破坏紧密连接,进而增加肠道通透性[19]。提示用p38 MAPK和JNK抑制剂抑制信号通路,可能通过抑制炎症细胞因子的表达,减轻仔猪肠道炎症,从而保护肠黏膜屏障。其中具体的机制有待进一步的研究。
ERK1/2通路在促进肠上皮细胞增生和分化中发挥重要作用。本试验结果表明,断奶前注射ERK1/2抑制剂仔猪肠屏障没有得到改善,反而有加重损伤的趋势。Basuroy等[20]在研究过氧化氢(H2O2)诱导Caco-2细胞氧化应激过程中发现,紧密连接蛋白重新分布,细胞骨架被破坏,细胞通透性增加,而上皮生长因子可以通过激活ERK1/2通路保护紧密连接蛋白,保护肠黏膜;用ERK1/2抑制剂处理后,上皮生长因子的保护作用被阻断。ERK1/2信号通路在小肠损伤修复过程中发挥着重要作用[21]。提示在断奶应激致仔猪肠屏障损伤过程中ERK信号通路的激活可能起到一定的修复保护作用。
4 结论
在断奶应激致仔猪小肠黏膜屏障受损过程中,抑制p38 MAPK和JNK通路后,肠屏障得到改善,而抑制ERK1/2通路后肠屏障损伤有加重的趋势。
致谢:
感谢美国北卡罗琳娜州立大学(North Carolina State University)兽医学院Moeser博士对本试验选题、构思和论文撰写给予的指导。
[1]郑曙云,付小兵,徐建国.MAPK信号传导通路与肠损伤后黏膜上皮修复[J].中国危重病急救医学,2004,16(1):59-62.
[2]BROOM O J,WIDJAYA B,TROELSEN J,et al.Mitogen activated protein kinases:a role in inflammatory bowel disease?[J].Clinical& Experimental Immunology,2009,158(3):272-280.
[3]COSTANTINI T W,PETERSON C Y,KROLL L,etal.Role of p38 MAPK in burn-induced intestinal barrier breakdown[J].Journal of Surgical Research,2009,156(1):64-69.
[4]LALLÈS J P,BOSI P,SMIDT H,et al.Weaning:a challenge to gut physiologists[J].Livestock Science,2007,108(1/2/3):82-93.
[5]刘海萍,胡彩虹,徐勇.早期断奶对仔猪肠通透性和肠上皮紧密连接蛋白Occludin mRNA表达的影响[J].动物营养学报,2008,20(4):442-446.
[6]HU C H,SONG J,YOU Z T,et al.Zinc oxide-montmorillonite hybrid influences diarrhea,intestinal mucosal integrity and digestive enzyme activity in weaned pigs[J].Biological Trace Element Research,2011.doi:10.1007/s12011-012-9422-9.
[7]MOESER A J,VANDER K C,RYAN K A,et al.Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2007,292(1):G173-G181.
[8]BRANDT R B,SIEGEL S A,WATERS M G,et al.Spectrophotometric assay for D-lactate in plasma[J].Analytical Biochemistry,1980,102(1):39-46.
[9]胡泉舟,侯永清,王猛.血中二胺氧化酶活性与仔猪腹泻程度的相关性分析[J].猪业科学,2007(12):73-74.
[10]KYRIAKIS J M,BANERJEE P,NIKOLAKAKI E,et al.The stress-activated protein kinase subfamily of c-Jun kinases[J].Nature,1994,369:156-160.
[11]HEDEMANN M S,DYBKJAER L,JENSEN B B.Pre-weaning eating activity and morphological parameters in the small and large intestine of piglets[J].Livestock Science,2007,108(1/2/3):128-131.
[12]HEDEMANN M S,HØJSGAARD S,JENSEN B B.Small intestinal morphology and activity of intestinal peptidases in piglets around weaning[J].Journal of Animal Physiology and Animal Nutrition,2003,87(1/2):32-41.
[13]WIJTTEN P J A,MEULEN J V D,VERSTEGEN M W A.Intestinal barrier function and absorption in pigs after weaning:a review[J].British Journal of Nutrition,2011,105:967-981.
[14]SMITH F,CLARK J E,OVERMAN B L,et al.Early weaning stress impairs development of mucosal barrier function in the porcine intestine[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2010,298:G352-G363.
[15]栾兆双,姚丽丽,傅振宁,等.断奶应激对仔猪肠形态、肠黏膜屏障和p38丝裂原活化蛋白激酶信号通路的影响[J].动物营养学报,2012,24(11):2237-2242.
[16]PIÉ S,LALLÈS J P,BLAZY F,et al.Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets[J].The Journal of Nutrition,2004,134:641-647.
[17]易文全,甘华田.P38 MAPK信号通路:炎性肠病治疗的新靶[J].华西医学,2006,21(1):194-195.
[18]MIHAESCU A,SANTEN S,JEPPSSON B,et al.P38 mitogen-activated protein kinase signalling regulates vascular inflammation and epithelial barrier dysfunction in an experimental model of radiation-induced colitis[J].British Journal of Surgery,2010,97(2):226-234.
[19]CAPALDO C T,NUSRAT A.Cytokine regulation of tight junctions[J].Biochimica et Biophysica Acta,2009,1788(4):864-871.
[20]BASUROY S,SETH A,ELIAS B,et al.MAPK interacts with occludin and mediates EGF-induced prevention of tight junction disruption by hydrogen peroxide[J].Biochemical Journal,2006,(393):69-77.
[21]余进.猪和大鼠小肠黏膜热应激损伤修复机制的研究[D].硕士学位论文.北京:北京农学院,2010:57-69.

