他克莫司对小鼠髓样树突状细胞成熟及抗原呈递的干预作用研究
周艳,杨淑霞,唐海明,杨佩,邹强,王衍堂*
(1.四川大学华西第二医院急诊医学科,成都 610041;2.成都医学院基础医学院免疫教研室,成都 610083)
树突状细胞(dendritic cells,DCs)是哺乳动物体内的专职抗原递呈细胞(antigen presenting cells,APCs),按成熟状态分为成熟 DCs(mature DCs,mDCs)和 未 成 熟 DCs(immature DCs,imDCs)[1,2]。mDCs能有效激活幼稚 T 细胞(na¨Ive T cells),启动特异性免疫应答。imDCs则具有较强的吞噬及迁移能力,但因其仅表达低水平的MHC分子以及CD40、CD80和CD86等共刺激分子,imDCs不能有效激活幼稚T细胞,反而诱导T细胞免疫耐受。鉴于DCs的表型和功能具有可塑性,可通过人工干预控制DCs的分化成熟,进而间接调控机体的免疫应答反应。这种干预获得的imDCs在诱导移植免疫耐受,治疗自身免疫性疾病以及变态反应等方面已经取得初步的进展,因此其又被称为致 耐 受 DCs(tolerogenic dendritic cells,Tol DCs)[3-5]。
他克莫司(Tacrolimus,FK506)是一种强力的新型免疫抑制剂,通过与细胞内FK506结合蛋白(FKBP)专一性结合形成FK506-FKBP复合物,进而抑制钙神经素(calcineurin)的活性,调控T、B淋巴细胞的活化、增殖以及炎性细胞因子的分泌等[6]。临床实验[7]表明,FK506在器官移植以及自身免疫性疾病的治疗中发挥着积极的作用。但FK506是否会影响小鼠骨髓来源的树突状细胞(bone marrow-derived dendritic cells,BM-DCs)的成熟分化以及抗原呈递功能,目前尚不清楚。本研究拟通过观察比较FK506处理后的imDCs,在经LPS诱导成熟后(FK-DCs)的表面分子标志以及功能与未经FK506处理的DCs是否存在差异,探讨FK506是否可以诱导小鼠BM-DCs的免疫耐受,从而有助于了解FK506治疗自身免疫性疾病以及抑制移植排异反应的免疫药理学机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 6~8周龄雄性SPF级C57BL/6及BALB/c小鼠均购自成都达硕生物科技有限公司,饲养于成都医学院科研实验中心SPF动物房。1.1.2 主要实验试剂 rmGM-CSF及rmIL-4购自美国Perprotech公司;LPS购自美国Sigma公司;FITC标记的抗小鼠CD40mAb,PE标记的抗小鼠CD80mAb,APC/Cy7标记的抗小鼠CD86 mAb,FITC标记的抗小鼠MHC II mAb及相应的同型对照购自美国Biolegend公司;小鼠IL-12、IL-6及TNFα购自美国Perprotech公司;CFSE细胞增殖检测试剂盒购自美国Invitrogen公司。
1.2 实验方法
1.2.1 BM-DCs分离培养及药物干预 取6~8周龄C57BL/6小鼠,颈椎脱臼处死,于75%酒精中浸泡5~10min,无菌状态下取出胫骨和股骨,浸泡于含1%胎牛血清的PBS缓冲液中。剪刀剪掉骨两端,用1mL注射器吸取PBS缓冲液刺入骨髓腔反复冲洗,将骨髓冲洗入另一无菌培养皿中,收集培养皿中细胞悬液,离心(300g/min,5min),弃上清,PBS洗涤后搜集细胞。细胞计数后,重悬于含10%胎牛血清的RPMI-1640培养基中,接种于100mm平皿(细胞密度1×106个/mL),加入细胞因子rmGM-CSF 20ng/mL,rmIL-4 10ng/mL,37 ℃,5%CO2孵箱培养。隔日半量换液,去除未贴壁细胞及细胞碎片,并补充细胞因子。培养至第7天,轻轻吹打平皿,收获轻微贴壁及悬浮的细胞,离心搜集,细胞计数后,重新接种于24孔培养板(细胞密度1×106个/mL),获得imDCs。加入100ng/mL的LPS刺激24h后,即为成熟BM-DCs。FK506在LPS刺激前24h加入,设2个组,分别为vehicle组和FK506组。
1.2.2 BM-DCs形态学观察 倒置相差显微镜(日本Olympus公司)观察imDCs、mDCs和FK-DCs细胞形态特征。
1.2.3 流式细胞术(flow cytometry,FCM)检测BM-DCs表面分子标志 搜集第8天DCs、PBS缓冲液洗涤重悬,调整细胞密度为5×105个/100μL,每组设3复孔,加入CD80、CD86、CD40和 MHC II的荧光抗体标记,4℃孵育30min,PBS洗涤后重悬于300μL PBS缓冲液,以相同荧光标记的同型IgG抗体为对照,流式细胞仪(美国Bd公司)上机检测。
1.2.4 ELISA检测BM-DCs培养上清中细胞因子表达 搜集mDCs培养上清,按照ELISA试剂盒说明书检测IL-12、IL-6及TNFα的表达水平,每组设3复孔。1.2.5 混合淋巴细胞反应 CFSE细胞增殖测定试剂盒检测FK506对mDCs刺激同种异型的T细胞增殖的影响。无菌条件下取BALB/c小鼠脾脏,制备脾细胞悬液。注入尼龙毛柱(日本和光公司),37℃,5%CO2孵箱孵育1h,得到纯化的T细胞为反应细胞。细胞计数后调整细胞密度为1×106个/mL细胞,加入工作浓度为2μM的CFSE溶液,37℃孵育10min,定时混匀细胞悬液。用等量的含5%FBS的PBS缓冲液中止,离心去上清,PBS洗涤细胞离心去上清,重复两次。离心重悬后调节细胞密度为1×106个/mL,接种于96孔U型底培养板。搜集培养第8天的mDCs,离心重悬后调节细胞密度为2×106个/mL,加入丝裂霉素C(25ng/mL)灭活,作为刺激细胞。将刺激细胞与反应细胞按不同比例(1∶100、1∶30和1∶10)混合培养于96孔板,37℃,5%CO2孵箱培养72h。离心搜集细胞,流式细胞仪上机检测。
1.2.6 统计学方法 所有数据采用Graphpad Prism 6.0软件进行统计学分析,实验结果用均数±标准差(±s)表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 FK-DCs的形态
光镜下见培养第8天细胞,mDCs组贴壁生长呈树突状,呈梭形及不规则形,FK506组细胞形态未见明显改变。
2.2 FK-DCs的分子表型检测
BM-DCs各组 CD80、CD86、CD40和 MHC II表达(见表1)。与vehicle组相比,FK506组mDCs CD80、CD86、CD40和MHC II表达均有明显降低,差异有统计学意义(P<0.05)。
表1 流式细胞术检测FK-DCs表面分子标志(±s,n=6)

表1 流式细胞术检测FK-DCs表面分子标志(±s,n=6)
与imDCs组比较,aP<0.05;与 mDCs(vehicle)组比较,b P<0.05
MHC II+/%CD80+/% CD86+/% CD40+/%imDCs 68.2±2.1 68.8±5.7 24.4±4.8 48.6±5.6 mDCs(vehicle) 98.4±1.7a99.3±2.4a94.7±0.9a72.4±3.5a FK-DCs 79.1±3.5b 82.8±4.6b 79.3±3.7b 54.5±2.9b
2.3 FK-DCs分泌的细胞因子测定
mDCs各组培养上清中BM-DCs各组CD80、CD86、CD40和MHC II的表达水平(见表2)。根据标准品浓度制定标准曲线方程,与vehicle组相比,FK506组 mDCs IL-12、IL-6及 TNFα表达水平有明显降低,差异有统计学意义(P<0.05)。
表2 ELISA检测FK-DCs分泌炎性细胞因子(±s,n=6)

表2 ELISA检测FK-DCs分泌炎性细胞因子(±s,n=6)
与 mDCs(vehicle)组比较,aP<0.05
IL-12/(pg/mL) IL-6/(pg/mL) TNFα/(pg/mL)mDCs(vehicle) 150.45±19.85 1 680.66±152.19 5 214.23±301.21 FK-DCs 65.27± 9.56a682.33± 89.74a3 829.17±259.21a
2.4 FK-DCs刺激同种异型T细胞增殖能力的测定
C57BL/6小鼠的 mDCs与BALB/c的脾脏T细胞进行混合淋巴细胞反应(见表3)。应用CFSE活细胞标记法,经流式细胞仪检测后发现,与vehicle组相比,FK506组两个比例(1∶10及1∶30)的mDCs刺激同种异型T细胞增殖水平有明显降低,差异有统计学意义(P<0.05)。
3 讨论
DCs是目前发现的唯一能直接活化幼稚T细胞的APCs,其在诱导T细胞免疫应答或免疫耐受的过程中发挥了十分重要的作用[2]。DCs的表型、成熟度和功能的异质性是平衡免疫反应和免疫耐受的重要因素。mDCs表达高水平的共刺激分子,分泌 T细胞刺激因子(如IL-12、IL-15和IL-18等),选择激活相应的受者T细胞,从而诱发免疫反应。imDCs表达低水平的共刺激分子,通过T细胞无能、免疫偏离、T细胞凋亡或者诱导Treg细胞产生等诱导特异性免疫耐受[5]。因此,建立大量获取imDCs的有效方法无疑是Tol DCs临床应用的前提和基础。目前常用的获取Tol DCs的策略主要有免疫抑制剂类药物诱导、表达细胞凋亡分子、建立细胞因子培养体系、基因工程技术等[8]。尽管诱导Tol DCs的方法较多,在试验研究中Tol DCs亦显示出巨大的应用前景,但Tol DCs真正应用于临床,其诱导手段还需要解决以下问题:1)稳定确切、经济高效;2)无或低毒副作用以及致畸致癌致突变作用;3)可控性良好,具有良好的优化提高潜力。而目前已应用于临床的某些免疫抑制类药物,如阿司匹林、N-乙酰半胱氨酸、环孢素A或地塞米松等均被证实可以抑制DCs分化成熟,发挥免疫耐受诱导的药理作用。但是以上药物诱导Tol DCs特异性较差,毒副反应显著,限制了其在该临床方向上的研究,尤其在解决自身免疫问题上的长期应用。
表3 CFSE试剂盒检测FK-DCs刺激同种异型T细胞增殖(±s,n=6)
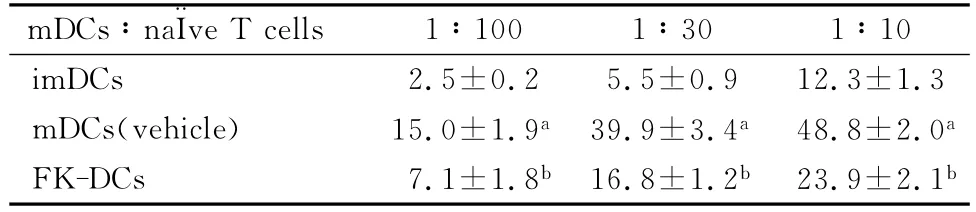
表3 CFSE试剂盒检测FK-DCs刺激同种异型T细胞增殖(±s,n=6)
与imDCs组比较,aP<0.05;与mDCs(vehicle)组比较,b P<0.05
mDCs∶na¨Ive T cells 1∶100 1∶30 1∶10 imDCs 2.5±0.2 5.5±0.9 12.3±1.3 mDCs(vehicle) 15.0±1.9a39.9±3.4a48.8±2.0a FK-DCs 7.1±1.8b 16.8±1.2b 23.9±2.1b
FK506是一种新型强效免疫抑制性大环内酯类抗生素,对T细胞有选择性抑制作用。FK506直接作用于T细胞时,与亲免蛋白FKBP结合形成FK506-FKBP复合物,进而抑制钙神经素(calcineurin)的活性,并降低活化T细胞核转录因子(nuclear factor of activated T-cells,NF-AT)的去磷酸化水平,下调的PNF-AT则直接影响IL-2等炎性细胞因子的转录[6]。而FK506还可以抑制核转录因子κB(NF-κB)活性[9],而 NF-κB又参与调控DCs表面的 MHC II以及CD40、CD80、CD86等共刺激分子的表达[10]。因此推测,FK506可能会通过干预DCs成熟及抗原呈递,间接调控T细胞免疫反应。通过实验研究证实,FK506在体外可以有效抑制LPS诱导成熟的小鼠骨髓来源DCs表面CD40、CD80、CD86和MHC II分子的表达,下调成熟BMDCs IL-12、IL-6及 TNFα炎性细胞因子的分泌水平,降低成熟BM-DCs刺激同种异型幼稚T细胞增殖的能力。因此,FK506在体外可以成功诱导Tol DCs,深入研究药物(免疫抑制剂)修饰的Tol DCs以及与T细胞反应的相互作用关系将对进一步干预自身免疫性疾病以及诱导移植免疫耐受提供新的解决思路和临床治疗方向。
[1]Ardavín C.Origin,precursors and differentiation of mouse dendritic cells[J].Nature Reviews Immunology,2003,3(7):582-591.
[2]Reizis B,Bunin A,Ghosh HS,etal.Plasmacytoid dendritic cells:recent progress and open questions[J].Annual Review of Immunology,2011,29:163-183.
[3]Moser M.Dendritic cells in immunity and tolerance-do they display opposite functions?[J].Immunity,2003,19(1):5-8.
[4]Reis e Sousa C.Dendritic cells in a mature age[J].Nature Reviews Immunology,2006,6(6):476-483.
[5]Minton K.Dendritic cells:Choosing the right presentation[J].Nature Reviews Immunology,2011,11(12):804-805.
[6]Abou-Jaoude MM,Najm R,Shaheen J,etal.Tacrolimus(FK506)versus cyclosporine microemulsion(neoral)as maintenance immunosuppression therapy in kidney transplant recipients[J].Transplantation Proceedings,2005,37(7):3025-3028.
[7]Rath T.Tacrolimus in transplant rejection[J].Expert Opinion on Pharmacotherapy,2013,14(1):115-122.
[8]Buonocore S,Flamand V,Goldman M,etal.Bone marrowderived immature dendritic cells prime in vivo alloreactive T cells for interleukin-4-dependent rejection of major histocompatibility complex class II antigen-disparate cardiac allograft[J].Transplantation,2003,75(3):407-413.
[9]Du S,Hiramatsu N,Hayakawa K,etal.Suppression of NF-kappaB by cyclosporin a and tacrolimus(FK506)via induction of the C/EBP family:implicationfor unfolded protein response[J].J Immunol,2009,182(11):7201-7211.
[10]Kim GY,Kim KH,Lee SH,etal.Curcumin inhibits immunostimulatory function of dendritic cells:MAPKs and translocation of NF-kappa B aspotential targets [J].J Immunol,2005,174(12):8116-8124.

