碳基燃料SOFC阳极材料研究进展
孙春文 ,孙 杰,杨 伟,马朝晖,李 帅,仙存妮 ,王少飞,肖睿娟 ,施思齐 ,李 泓,陈立泉
(1.中国科学院物理研究所北京凝聚态物理国家实验室,北京 100190;2.中国科学院清洁能源研究重点实验室,北京市新能源材料与器件重点实验室,北京 100190;3.中国人民解放军防化学院,新能源与能源安全实验室,北京 102205)
碳基燃料SOFC阳极材料研究进展
孙春文1,2,孙 杰3,杨 伟1,2,马朝晖1,2,李 帅1,2,仙存妮1,2,王少飞1,2,肖睿娟1,2,施思齐1,2,李 泓1,2,陈立泉1,2
(1.中国科学院物理研究所北京凝聚态物理国家实验室,北京 100190;2.中国科学院清洁能源研究重点实验室,北京市新能源材料与器件重点实验室,北京 100190;3.中国人民解放军防化学院,新能源与能源安全实验室,北京 102205)
固体氧化物燃料电池(SOFCs)是一类可以将燃料气体的化学能以高效而环境友好的方式直接转化为电能的电化学反应器。最近的研究趋势是发展可以直接电化学氧化碳氢化合物燃料(如天然气)的电池,但是使用碳氢化合物作为燃料时,目前最常使用的镍-氧化钇稳定的氧化锆(Ni/YSZ)金属陶瓷阳极材料具有易积碳和硫中毒的缺点。因此,研究在燃料气氛下具有混合离子-电子电导的替代阳极材料显得尤为必要。综述了以碳基燃料工作的SOFCs阳极材料研究的一些进展,并展望本领域在未来的发展趋势。
固体氧化物燃料电池;阳极材料;碳基燃料;抗积碳;抗硫
1 前言
随着世界经济的快速发展,对一次能源的需求急剧增加,以化石资源为燃料的能源结构受到严重的挑战,日益严重的能源供需和环境问题已经成为制约经济和社会发展的瓶颈。为此,世界各国都把发展洁净能源和能源洁净利用技术当作可持续发展能源战略的重要目标。尽管近年来原油价格飞涨,煤的价格却始终稳定在较低的水平。发展以煤为主的能源结构对于国家能源安全意义重大。我国煤炭贮量丰富,而且煤炭在我国能源消费结构中所占的比重远远超过世界平均水平,目前煤电占全国总发电量的80%以上,到2020年,煤电仍将超过75%,但是煤炭的开发和加工利用已经成为我国环境污染物排放的主要来源[1]。因此,发展洁净煤技术将是我国能源发展的必然选择。在洁净煤技术中,集成的煤汽化和燃料电池组合循环发电系统(IGFC)是最高效的发电系统,同时对环境具有小的影响,有望成为“最终的煤基发电技术”。固体氧化物燃料电池(SOFCs)因其燃料适应性强、全固态模块化设计、可热电联合发电等优点,是集成的煤汽化和燃料电池组合循环发电系统(IGFC)发电部分的最佳候选者。
尽管通常使用的镍-氧化钇稳定的氧化锆(Ni/YSZ)金属陶瓷阳极材料以氢气作为燃料时具有优异的电催化活性,但是当使用碳氢化合物作为燃料时,具有易积碳和硫中毒的问题[1~6]。因此,研制可以直接电化学氧化碳氢化合物和耐硫毒化的新型替代阳极材料仍面临巨大的挑战。
在最近十几年,大量关于固体氧化物燃料电池阳极的研究见诸报道,涉及到材料、催化、表面科学和电化学等许多学科前沿。本文旨在对目前碳基燃料SOFCs阳极材料的研究提供一个总的描述。将从介绍SOFCs工作原理开始,重点介绍阳极材料的研究进展,尤其是可以直接电化学氧化碳氢化合物燃料和抗硫的阳极材料。
1.1 固体氧化物燃料电池基本的工作原理
图1示意地描述了固体氧化物燃料电池的工作原理[7]。从阴极侧开始,分子氧得到电子首先被还原为氧离子,半电池反应可以写成如下反应方程式

为了完成这一反应,阴极必须能够解离氧气分子,并且是电子电导的。通常使用的阴极材料是锶掺杂的锰酸镧(LSM)。此外,大量的混合离子-电子导体(MIEC)也可用作阴极材料,例如,La0.6Sr0.4Fe0.8Co0.2O3,Ba0.5Sr0.5Co0.8Fe0.2O3-δ,Sm0.5Sr0.5CoO3。理想的阴极材料应当是容易解离分子氧、具有高的电子-离子电导,以及具有与电解质相匹配的热膨胀系数。

图1 固体氧化物燃料电池工作原理示意图[7]Fig.1 Schematic diagram showing the working principle of a solid oxide fuel cell[7]
为了将空气室和燃料室分开,电解质必须是致密的;为了容易地迁移氧离子,电解质必须具有高的氧离子电导;为了保持高的开路电压,电解质还必须是电子绝缘体。此外,电解质必须在宽的氧分压下保持这些性能,因为电解质工作区域从阴极侧氧分压接近1个大气压,到阳极侧大约10-20大气压或者更低[3]。固体氧化物燃料电池的工作温度很大程度上是由获得足够离子电导的电解质的工作温度决定的。目前,最常使用的电解质材料是氧化钇稳定的氧化锆(YSZ)。此外,一些其他的氧化物,例如掺杂的氧化铈,以及锶和镁掺杂的镓酸镧La0.9Sr0.1Ga0.8Mg0.2O2.85(LSGM)因为具有较高的离子电导也被考虑用于电解质材料[1]。然而,因其在宽的氧分压范围内的稳定性、合理的机械强度和不贵的价格等优点,YSZ仍是目前主要使用的电解质材料。因为降低工作温度将简化SOFCs系统中对其他部分材料的要求,因此目前的趋势是使用电极支撑的薄膜电解质结构。
阳极不仅是燃料发生电化学氧化的场所,也起着将电荷迁移回导电连接体的作用。受电池燃料和空气室氧化学势差的驱动,氧离子迁移通过电解质到达阳极,按下面的反应方程式被燃料的氧化反应所消耗。

因此,阳极材料对燃料氧化的催化性能是非常重要的。此外,阳极材料必须与其他电池部分的材料(电解质和连接体)相兼容(化学和热膨胀系数)。阳极必须提供燃料气体传输的通道,提供电子向连接体传输的通路,为从电解质传输过来的氧离子提供反应。在传统以YSZ作为电解质、氢或氢和CO混合物作为燃料的电池设计中,阳极为金属Ni和陶瓷YSZ的复合材料(通常称为金属陶瓷)。此外,其他混合离子-电子电导氧化物材料也被用作阳极材料,将在后面讨论。
以纯氢作为燃料,空气作为氧化剂,在800℃下和开路电压(OCV)条件下,可以由能斯特方程计算得到单电池理想的电压(E0)为1.01 V[8]。然而,在负载条件下,实际的输出电压(V)通常比E0低,可以按如下方程式表示

式(5)中,I表示流过电池的电流;R为电池的阻抗;ηc和ηa分别表示与阴极和阳极相关的极化损失。如图2所示,电压降低是由几个不可逆损失造成的[11]。在实际的燃料电池中,多个现象对不可逆损失有贡献。通过优化电池各个组分的性能,可以将这些损失降至最低,例如,微观结构、电流交换动力学、输运性能等。

图2 理想和实际的燃料电池电压-电流特性[9]Fig.2 Ideal and actual fuel cell voltage-current characteristic[9]
在高温燃料电池中,活化相关的损失通常较不显著,因此,电流-电压(I-V)曲线下凹的特征不明显。相反,如果传质相关的损失显著,I-V曲线上凸部分则向左扩展。
1.2 阳极三相边界
固体氧化物燃料电池的性能在很大程度上取决于阳极的微观结构,而阳极的微观结构主要由制备方法决定。此外,电化学反应与通常的异相反应在一些方面是不同的[10]。因此,有必要考虑一下阳极在微观尺度上是怎么工作的。众所周知,在固体氧化物燃料电池中发生的电化学反应仅仅发生在三相边界(TPB)处,定义为氧离子导体(电解质)、传导电子的金属相和气相交汇的地方。图3给出了电解质和阳极之间TPB存在的区域[3]。如果这三相中任何一相断开,反应则不能够发生。也就是说,如果电解质中的离子不能到达反应位,或者气相中的燃料分子不能扩散传输到达反应位,或者电子不能从反应位上离开,那么这一位置对于电池的性能是没有贡献的。尽管阳极的结构和组成清楚地影响TPB的长度,理论和实验研究发现有效的TPB仅处于从电解质到阳极大约 10 μm 的区域[3,10~12]。本质上,只要离子扩散通过电解质部分限制了性能,阳极氧化物相中过量离子的浓度的影响将不显著。TPB这一概念对于优化阳极和阴极具有重要意义。目前燃料电池的电极典型地具有复杂的微/纳结构,涉及到相互连接的电子和离子电导相、气体孔隙率和催化活性表面[13,14]。
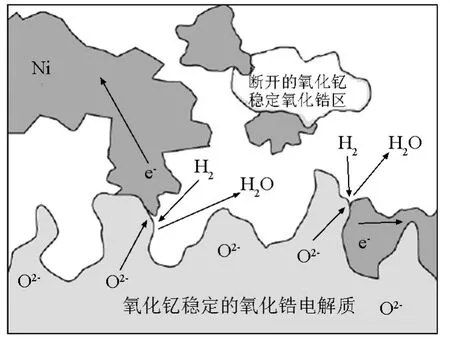
图3 Ni/YSZ阳极三相边界示意图[3]Fig.3 Schematic diagram of Ni/YSZ anode three-phase boundary[3]
阳极的孔隙率控制反应气体的传输,因此对电池性能具有重要的影响。阳极的孔隙率可以通过改变烧结温度和使用造孔剂(例如淀粉和石墨)来调控。Suzuki等人[15]报道了管状设计的SOFC阳极微观结构与其电化学性能的关系。当阳极组分的颗粒尺寸减小,得到高度多孔的微观结构,电池性能显著地提高。一个由传统的氧化锆基电解质、镍-金属陶瓷阳极和钙钛矿铁酸镧阴极材料构成的SOFC在600℃下的输出功率密度大于1 W。他们也研究了氢燃料流速(线性粘度)对于优化工作条件的影响。发现较高的线性燃料粘度导致具有较高阳极孔隙率的电池具有较好的电池性能。这一研究充分证明了通过优化阳极的微观结构和工作条件,ZrO2基电解质的SOFC也可以在600℃下工作。
2 阳极材料研究进展
2.1 Ni-YSZ金属陶瓷阳极材料
金属陶瓷阳极材料中的Ni为直接电化学氧化或甲烷水汽重整提供电子电导和催化活性反应位。金属陶瓷阳极材料中的YSZ使得阳极材料的热膨胀系数与YSZ电解质相匹配,并且将离子传导扩展至阳极的反应区,此外,YSZ在阳极中起结构支撑体的作用,阻止镍的烧结[1~4]。因为NiO和YSZ即使在高温下也不形成固溶体,因此,素坯能够烧结形成NiO-YSZ复合材料,然后经过原位还原形成多孔的Ni-YSZ金属陶瓷[1]。为了得到电子电导的渗流阈值,典型地Ni的量最少为30%(体积比)[16]。Ni-YSZ复合材料能够满足阳极的大多数要求,但是这一材料的缺点是其差的氧化还原稳定性、低的抗硫毒化性能,以及当使用碳氢化合物作为燃料时发生积碳现象和长时间运行后Ni的团聚问题[9]。尤其是差的抗积碳性能使得这一材料不适合用于以碳氢化合物作为燃料的 SOFCs中[1~6,17]。因为金属 Ni是一种优良的水汽重整和氢断裂的催化剂,当用碳氢化合物作为燃料时,除非使用过量的水汽来确保水汽重整,否则会在阳极上快速地发生碳的沉积。阳极的组成、粉末的颗粒尺寸和制备方法对于获得足够高的电子电导、离子电导、高的电化学反应以及重整和水汽变换反应活性是至关重要的。
当使用碳氢化合物为燃料时,为了解决积碳问题,通常采用以下几个手段。第一个手段是积碳问题可以通过降低工作温度来避免。英国学者Steele等[18]研究发现对于许多氧化物由于甲烷裂解而发生的积碳只在大约750℃以上才发生。Murray等人[19]利用直流反应磁屏溅射的方法在YSZ电解质和Ni-YSZ阳极之间沉积了一层0.5 μm厚的多孔(Y2O3)0.15(CeO2)0.85(YDC)薄膜,它们在固体氧化物燃料电池中实现了在较低温度下直接电化学氧化甲烷而没有观察到积碳,在650℃下,电池功率密度为0.37 W/cm2。
第二个手段是通过改进现有的阳极材料来避免积碳。例如,向Cu-YSZ/SDC金属陶瓷中添加CeO2形成Cu-CeO2-YSZ/SD复合阳极显著地提高了电池的性能,尤其是在使用碳氢化合物作为燃料时的性能[20]。这一结果表明CeO2促进了碳氢化合物的氧化。典型地,美国宾州大学Gorte教授小组最早研究了用铜和氧化铈或氧化钐掺杂的氧化铈取代镍金属陶瓷[21]。和镍不同,铜对积碳没有催化活性,但铜是有效的电流集流体,而氧化铈由于其优异的贮氧和氧输运性能,对碳氢化合物重整显示出高的催化活性。他们报导了在973 K和1 073 K下直接电化学氧化各种碳氢化合物,包括甲烷、乙烷、1-丁烯、正-丁烷和甲苯。气相热解仍然会导致焦油在Cu金属陶瓷上形成,但是在铜上形成的化合物是聚芳烃,而不是石墨。这些化合物通过提供额外的电子电导而增强了阳极的性能。但是,作为电催化剂,铜没有镍那么好,铜基阳极和YSZ电解质构成的固体氧化物燃料电池的功率密度比使用镍基阳极的电池要低。此外,金属铜的熔点较低,因此它与许多标准的高温SOFC制备技术不兼容。提高铜基阳极活性和稳定性的方法之一是将铜与另一具有高催化活性的金属形成合金,从这一点上来看,镍似乎是较好的选择[8]。Kim等[22]在800℃下测试了甲烷作为燃料Cu/Ni合金(Ni的组成为0、10%、20%、50%、100%)的性能。他们发现尽管在阳极上有少量的碳生成,但是电池的功率密度随时间是增加的。电池功率密度的增加被归因于阳极电子电导的增加,这一结果说明少量的碳可能对改善阳极性能是有好处的。他们也同时发现Cu/Ni合金阳极显示出与镍基-或铜基-金属陶瓷非常不同的性能。Lee等人[23]在973 K和1 073 K下用氢气和正丁烷作为燃料运行,考察了含有铜和镍或铜和钴的阳极的性能。与铜基阳极相比,在973 K下以氢气作为燃料,双金属阳极表现出改进的性能;与镍基或钴基阳极相比,用正丁烷作为燃料,发现积碳减少。相比较,Cu-Co似乎更抗积碳,可能因为Cu和Co以分离的相存在。这一结果表明,用碳氢化合物燃料工作时,应当考虑用双金属作为阳极。Xie等人[24]进一步研究了三金属合金FexCo0.5-xNi0.5/Sm0.2Ce0.8O1.9(SDC)金属陶瓷和氧化钆掺杂的氧化铈(CGO)电解质、Sm0.5Sr0.5CoO3/SDC阴极构成的单电池的性能。他们发现三金属合金阳极表现出最低的界面阻抗和最高的功率密度;当x=0.25时,观察到具有比Ni/SDC阳极好得多的性能。
第三个手段是通过寻找替代的阳极材料可以缓解或避免积碳问题,主要包括萤石型、钙钛矿、钨青铜、烧绿石结构的材料。对钨青铜和烧绿石结构阳极材料的研究目前主要集中在以氢气为燃料的燃料电池中,不在此文论述的范围,感兴趣的研究者可以参考相关文献[7]。下面将对具有萤石和钙钛矿型结构的两种阳极材料在直接电化学氧化碳氢化合物燃料电池方面的进展给予详细讨论。
2.2 替代的阳极材料
在发展碳基燃料固体氧化物燃料电池的背景下,研制具有混合离子-电子电导的氧化物显得尤为重要。氧离子电子混合导体可以将氧离子传输到阳极和气相之间界面的任何位置,扩展了电化学反应发生的活性区域。
2.2.1 萤石型阳极材料
到目前为止,大多数SOFC研究者使用氧化铈作为阳极材料来降低电池的工作温度。氧化铈在还原性气氛下由于Ce4+被还原为Ce3+而表现出混合离子电子电导。此外,理论计算发现氧化铈基材料优异的催化活性起源于CeO2-Ce2O3可逆转变相关的氧空位的生成和迁移[25,26]。研究发现氧化铈基离子导体具有高的抗积碳能力[27],允许直接使用碳氢化合物燃料。然而,更加有效的方法是添加Ni,Co和一些贵金属,例如,Pt,Rh,Pd和Ru,这些金属有助于碳氢化合物的重整反应,这是因为它们很容易使C-H键断裂,尤其是金属Ru[28]。
Hibino等人[29]研究了Ru-Ni-Ce0.9Gd0.1O1.95(GDC)阳极用于氧化铈薄膜电解质的SOFC在600℃下直接电化学氧化甲烷、乙烷和丙烷。他们认为阳极中金属Ru的作用是通过反应产生的水汽和CO2促进没有反应的碳氢化合物进行重整,避免了燃料气相扩散中水汽和CO2的干预。使用干燥的甲烷,电池最大的功率密度达到750 mW/cm2,与润湿的氢(2.9%H2O,体积分数)为燃料的电池最大功率密度769 mW/cm2相当。
2005年美国西北大学Barnett教授小组报道了在传统的SOFC阳极一侧通过添加一层Ru-CeO2催化层,实现了直接内重整异辛烷(汽油的主要成分)而没有积碳,使得实用而高效的固体氧化物燃料电池的研制向前推进了一步[30]。这一电池使用Ce0.85Sm0.15O1.925(SDC)作为电解质,570℃下最大的输出功率密度约0.35 W/cm2,与同一条件下以氢气为燃料的SDC电解质基固体氧化物燃料电池的性能相当。但是,正如本文指出的,这一催化剂层的缺点是降低了燃料扩散通过阳极的速率,因而降低了电池的功率密度。中国科学院物理研究所小组通过使用具有微/纳结构的花状介孔CeO2微球作为催化剂的载体,显著地改善了电池的传质性能,在600℃下电池的最大功率密度达到0.654 W/cm2[31]。电化学阻抗谱(EIS)分析表明含有多孔CeO2-Ru微球催化剂层的燃料电池的阳极反应动力学特性显著地提高。
Ramirez-Cabrera等人[32]研究了氧化钆掺杂的氧化铈Ce0.9Gd0.1O1.95(CGO)作为阳极材料,在900℃下以5%CH4(水汽/甲烷比在0~5.5)为燃料,发现该阳极材料具有抗积碳性能,反应速率受慢的甲烷吸附所控制。Marina等人[27]研究了同一催化剂用于甲烷氧化反应,发现氧化铈对于甲烷氧化活性很低,但是具有高度抗积碳性能。Antonucci等人[33]研究了利用Ru/CGO电催化剂和Cu电流收集体在固体氧化物燃料电池中直接电化学氧化和内重整丙烷。研究发现,用丙烷作燃料电池的电化学性能显著地受到极化阻抗的影响,比以氢作燃料的SOFC大约4倍。但是,在800℃下在电池外可以将丙烷水汽重整成合成气,转化率达到90%。在750℃下直接氧化和内重整丙烷气体没有观察到积碳现象。Wisniewski等人[34]在600~800℃下测试了Ir/Ce0.9Gd0.1O2-x对二氧化碳重整甲烷的性能,CH4/CO2比在2~0.66变化。他们发现催化剂在运行20 h表现出优良的稳定性,大多数实验条件下积碳被完全抑制;仅在800℃非常苛刻的条件下(CH4/CO2=2)运行,观察到少量的积碳。但是,他们没有报道该阳极的性能与镍或铜基金属陶瓷阳极性能的比较。
Hibino等人[35]在单腔SOFC中研究了甲烷和空气混合物在450~550℃温度区间在添加少量(0~10 wt.%)Pd的30 wt%Ce0.8Sm0.2O1.9-Ni阳极上的电催化氧化特性。发现在阳极中添加少量的钯显著地促进了甲烷的氧化,生成氢气和一氧化碳,电池的电动势大约为900 mV,阳极的反应阻抗很小。在550℃下,使用0.15 mm厚的SDC电解质,最大功率密度达到644 mW/cm2。
Ahn等人[36]考察了Ce0.6Zr0.4O2取代铜-氧化铈复合阳极中的氧化铈对电池性能的影响。他们发现Ce0.6Zr0.4O2改善了阳极的热稳定性,归因于Ce0.6Zr0.4O2固溶体与氧化铈相比较改善的氧化还原性能。Ye等人[37]研究了Cu-CeO2-ScSZ(氧化钪稳定的氧化锆)复合阳极对乙醇的电化学氧化性能,他们发现含有21.5 wt.%Cu-8.5 wt.%CeO2-ScSZ阳极的燃料电池表现出最好的性能。在800℃下,该阳极对乙醇和水汽流表现出稳定的性能,运行50 h后电池的输出功率密度稳定地保持在210 mW/cm2,并且在阳极表面没有观察到积碳,但是没有报道乙醇氧化的机理。
Hirabayashi等人[38]研究了铋基氧化物作为直接碳氢化合物固体氧化物燃料电池阳极的可能性。发现(Bi2O3)0.85(Ta2O5)0.15在600℃下表现出有希望的性能。在燃料气氛下,一部分Bi2O3被还原为BiO和金属Bi,材料具有较高的混合电导和足够高的催化活性,可以完全氧化碳氢化合物。当用丙烷作为燃料时,在低于800℃的温度下工作没有观察到积碳。此外,这一阳极材料在燃料和空气氛下都很稳定。
最近美国佐治亚理工学院刘美林教授小组报道了通过纳米结构的BaO/Ni界面容易吸附水这一特性,BaO/Ni-YSZ|YSZ|SDC/LSCF电池使用碳基燃料时实现了水调控的碳去除,使得设计新一代内重整碳基燃料SOFCs成为可能[39]。
2.2.2 钙钛矿型阳极材料
钙钛矿型氧化物具有ABO3通式,其中A和B阳离子总的电荷数为+6。较低价的A离子(例如La、Sr、Ca和Pb等)具有较大的离子半径,位于12重氧配位空穴中较大的空间;B离子(例如Ti、Cr、Ni、Fe、Co和Zr等)则占据较小的八面体空位(六重配位)。用不同价态的离子完全或部分取代A或B离子是可能的。当A位和B位离子总的化合价(n+m)小于6时,失去的电荷通过在氧晶格位引入空位而得到补偿[40]。图4给出了立方钙钛矿ABO3典型的结构图。大量具有钙钛矿结构的化合物已被研究用于SOFCs的阳极材料。
Tao等人[41]报道了氧缺陷钙钛矿材料La0.75Sr0.25Cr0.5Mn0.5O3具有与Ni/YSZ金属陶瓷相当的电化学性能,并且在高温下对甲烷具有优良的电化学氧化性能。在97%H2/3%H2O燃料气氛中,在900℃下电极极化阻抗接近0.2 Ω·cm2。没有使用过量的水蒸汽,对甲烷氧化表现出非常好的性能。阳极在燃料和空气氛下都具有很好的稳定性,并且用甲烷作为燃料表现出稳定的性能。克服了Ni-YSZ金属陶瓷阳极的两个主要弊病,表现出很好的氧化还原稳定性和在低水汽碳氢化合物比条件下
的抗积碳性能。在还原性气氛下,La0.75Sr0.25Cr0.5Mn0.5O3具有低的电子电导,并且对燃料气体中的硫杂质不稳定[42],即使浸渍CuO改善阳极在还原气氛下的电子电导,长期性能还是不令人满意[43]。但是,他们的工作最先展示了用氧缺陷型混合价钙钛矿作为混合离子电子导体阳极材料。这些氧化物的热膨胀系数也与一般的固体电解质相兼容。

图4 ABO3钙钛矿结构单胞[40]Fig.4 Unit cell of the ABO3perovskite structure[40]
美国德州大学奥斯汀分校的Goodenough教授小组[44]最先报道将双钙矿结构的Sr2Mg1-xMnxMoO6-δ用于阳极材料,用天然气作为燃料,在650~1 000℃的温度下工作,该材料表现出长期稳定性和抗硫毒化性能。这一材料的特点是含有氧缺陷,并且在还原气氛下稳定。混合价态的Mo(VI)/Mo(V)提供电子电导,具有足够大的功函数,可以接受碳氢化合物的电子。作为混合离子-电子导体可以接受电子并失去氧,对H2和碳氢化合物的氧化表现出高的催化活性。因为Mo(VI)和Mo(V)形成羟氧钼离子,所以具有失氧并接受电子的能力,使得在小于六重氧配位的环境下稳定存在,Mg2+和Mn2+在四重和六重氧配位环境下都很稳定。用干CH4作燃料,在800℃时电池的最大功率密度达到438 mW/cm2。同一小组最近研究了双钙钛矿结构的Sr2CoMoO6-δ用于SOFC阳极材料,发现在400~500℃和氢气气氛下这一材料的电子电导随温度急剧增加,这是由于发生了氧的损失,使得Sr2CoMoO6-δ变为优良的混合离子-电子导体。与300μm厚的La0.8Sr0.12Ga0.83Mg0.17O2.815电解质和SrCo0.8Fe0.2O3-δ阴极组成的电池,以氢气和润湿的甲烷为燃料,电池最大的输出功率密度分别为1 017 mW/cm2和634 mW/cm2。用甲烷为燃料,电池性能随时间观察到衰退,归因于在电极上发生了积碳[45]。
最近,美国佐治亚理工学院刘美林教授小组[46]报道了兼具质子和氧离子传导的混合离子导体BaZr0.1Ce0.7Y0.2-xYbxO3-δ在低温下(500~700 ℃)具有增强的抗硫和抗积碳能力。这一材料除了可以用于SOFCs的电解质和电极外,还可用于碳氢化合物燃料的重整催化剂以及燃料气体的脱硫催化剂。
Vernoux等人[47]研究了La0.8Sr0.2Cr0.97V0.03O3(LSCV)的催化和电催化特性,发现尽管这一材料对甲烷燃料表现出抗积碳性能,但是在800℃下这一材料对甲烷水汽重整表现出低的活性。当在电极中添加水汽重整催化剂Ru进行逐级内重整,LSCV-YSZ复合材料是一种有希望的阳极材料。
Sauvet等人[48]研究了750℃和850℃下用氢气和甲烷作为燃料La1−xSrxCr1−yRuyO3(x=0.2,0.3,0.4和y=0.02,0.05)的电化学性能。他们发现30%Sr掺杂的材料表现出最好的性能,改变Ru的含量(0.02~0.05)对电化学性能影响很小。通过使用梯度电极和在电解质表面涂覆一层5 μm厚的氧化铈层,电化学性能显著改善。然而,当氧化铈层的厚度大于5 μm,比没有中间层的电池的电化学性能还要低。Sauvet等[49,50]研究了 La1-xSrxCr1-yNiyO3-δ作为阳极材料,发现该材料具有一定的催化活性,尽管比Ni基复合材料的低。对于甲烷水汽重整,当水汽对甲烷的比为1或更小时,没有观察到积碳。
Liu等人[51]研究了电子导体La0.8Sr0.2Cr0.8Mn0.2O3-δ、离子导体Ce0.9Gd0.1O1.95和少量Ni构成的复合阳极分别用 H2,CH4,C3H8和 C4H10作为燃料的电池性能。发现用氢和甲烷作为燃料,阳极的性能与Ni-GDC阳极相当。当用丙烷和丁烷作为燃料,不同于Ni-GDC阳极,有很少量的碳生成。阳极中添加4 wt.%的Ni对于得到好的性能是必要的,表明少量的Ni提供好的电催化性能而没有造成积碳。初步的电池测试结果表明电池具有好的稳定性,阳极性能不受氧化还原循环的影响。
浸渍GDC的(La0.75Sr0.25)(Cr0.5Mn0.5)O3作为替代的无Ni阳极材料,用于在固体氧化物燃料电池中实现了直接电化学氧化甲烷[52,53]。研究发现浸渍亚微米和离子电导的GDC明显地改善了LSCM阳极对3%水润湿的甲烷的电催化氧化活性。在800℃下,在润湿的甲烷气氛下,浸渍4.0 mg/cm2GDC的LSCM阳极的电极极化阻抗为0.44 Ω·cm2,比LSCM和LSCM/YSZ复合阳极的极化性能都小。浸渍La0.75Sr0.25Cr0.5Mn0.5O3-δ的YSZ复合阳极也是一种有希望的阳极材料[54,55]。用浸渍35 wt.%La0.75Sr0.25Cr0.5Mn0.5O3-δ的YSZ复合阳极、YSZ电解质和La0.8Sr0.2MnO3-δ阴极组成的单电池,在800℃下用干燥的氢气和甲烷作为燃料,电池的最大功率密度分别为567 mV/cm2和561 mV/cm2。阳极浸渍Ag和Ni进一步用以改善电子电导和催化活性,当在YSZ和32 wt.%LSCM复合阳极中添加6 wt.%Ni和6 wt.%Ag,在850℃下用干燥的氢气和甲烷作燃料,电池最大功率密度分别为850 mW/cm2和1 302 mW/cm2,并且没有观察到积碳[54]。Pd纳米颗粒也通过浸渍的方法沉积到La0.75Sr0.25Cr0.5Mn0.5O3/YSZ复合阳极上,显著地提高了LSCM/YSZ复合阳极对甲烷和乙醇电化学氧化的催化活性[55]。在800℃下,用甲烷和乙醇作为燃料,使用沉积Pd纳米颗粒的YSZ阳极电池的最大功率密度分别为45 mW/cm2和111 mW/cm2;与LSCM/YSZ为阳极的电池相比较,输出功率密度分别提高了2倍和8倍,并且没有观察到积碳。这一结果表明沉积Pd纳米颗粒的LSCM/YSZ复合材料是一种有效的直接氧化甲烷和乙醇的阳极材料。
Sin等人[56]研究了La0.6Sr0.4Fe0.8Co0.2O3-Ce0.8Gd0.2O1.9(LSCFO-CGO)复合阳极用于中温氧化铈电解质支撑的固体氧化物燃料电池中直接电化学氧化甲烷。在800℃下,最大功率密度达0.17W/cm2。电化学测试后,阳极没有表现出结构变化,并且没有观察到积碳。在一填充床反应器中对干燥甲烷流高温处理后,这一材料表现出显著改进的化学和结构稳定性。这说明由于CGO的混合电导特性,从电解质中连续地向阳极供给氧离子,稳定了SOFC工作条件和开路条件下电极材料表面的钙钛矿结构。Faro等人[57]研究了两种浸渍低Ni含量(10 wt.%)的GDC和La0.6Sr0.4Fe0.8Co0.2O3阳极催化剂用于以干燥丙烷为燃料的中温(800℃)固体氧化物燃料电池。Ni修饰的钙钛矿催化剂与GDC粉末混合形成7 wt.%Ni-63 wt.%La0.6Sr0.4Fe0.8Co0.2O3-30 wt.%Gd0.2Ce0.8O2复合催化层沉积在GDC电解质上,构成合适的三相边界。与Ni/GDC阳极相比,Ni修饰的钙钛矿表现出较好的性能。在800℃下,电解质支撑的SOFC用干燥的丙烷气体作燃料,电池功率密度达300mW/cm2。电池运行后,对复合阳极层的结构分析表明修饰了钙钛矿结构并且有La2NiO4相生成。Ni/GDC体系中形成的金属Ni由于有积碳造成催化剂的失活。
掺杂的SrTiO3(SYT)也是一类有希望的阳极材料。1997年英国Irvine小组最先研究了SrTiO3基材料作为SOFCs的阳极材料[58]。这些材料表现出高的抗硫和抗积碳性能,具有优良的化学和氧化还原稳定性[59]。使用纯的SrTiO3作为阳极,主要的问题是其在还原性气氛下低的电子电导[60]。Petric等人[61]报道Nb和Y共掺杂的SrTiO3在还原性气氛下的电导为340 S/cm,但是当在空气氛下焙烧时会降低到小于10 S/cm。A位掺杂Y或La显著地提高了电子电导,而对化合物的稳定性没有不好的影响[62,63]。La掺杂的SrTiO3具有较高的电导和低的对氢气氧化的催化活性。但掺杂Y的SrTiO3具有合理的电子电导和催化活性。因为这些化合物离子电导很低或几乎没有,所以必须与其他离子导体氧化物形成复合阳极材料。通过与氧化铈基材料复合或掺杂,SrTiO3类材料有可能用于直接电化学氧化碳基燃料电池的阳极。最近,Périllat-Merceroz等人研究了Ce掺杂的钙钛矿型La0.33Sr0.67TiO3+δ[64]。他们发现只有在高温和还原性气氛(稀释的氢气)下才可得到纯相的La0.23Ce0.1Sr0.67TiO3+δ(LCST)。当在1 200℃暴露在氧化性气氛下,Ti3+和Ce3+氧化导致LCST分解和几纳米富Ce相的生成。在较低温度下,将气氛转变回还原性气氛,只发生部分可逆转变,确保了在电子电导的n-型网络中存在电催化活性相的纳米颗粒。在900℃对甲烷水汽重整(CH4/H2O=10/1)的测试表明部分分解相的性能极大地被改善,显示出高的抗积碳能力,有可能作为直接氧化润湿甲烷气体的SOFC阳极材料。
Hui等人[65]研究了钇掺杂的SrTiO3作为固体氧化物燃料电池的阳极材料,研究了电导、相稳定性、氧化还原行为,与YSZ和La0.8Sr0.2Ga0.8Mg0.2O2.8电解质的化学兼容性、热膨胀系数,以及燃料电池性能。优化组成的Sr0.86Y0.08TiO3-δ的电导在800℃下和氧分压为10-19大气压时,电导达82 S/cm。在氧化和还原过程中观察到电导可逆地变化。用过渡金属(例如Co)部分取代Ti,抗氧化能力提高。这一材料在宽的温度范围(最高1 400℃)和氧分压(1~10-20大气压)下结构很稳定。SYT和YSZ或LSGM的混合物在1 400℃下烧10 h,没有观察到相变。掺杂SrTiO3的热膨胀系数与YSZ和LSGM电解质相兼容。在900℃下,电池的最大功率密度为58 mW/cm2。
Vernoux 等人[66]研究了 La(Sr)Cr(Ru,Mn)O3-δ缺陷钙钛矿材料作为固体氧化物燃料电池阳极材料。在B位加入Ru,材料对水汽重整反应的催化活性得以改善。催化性能很稳定,在含有甲烷比水汽更多的混合反应气氛下运行300 h后没有检测到积碳。与锶掺杂的铬酸镧相比较,在B位掺入Mn促进了氢气的电化学氧化。说明这些钙钛矿材料是进行逐级内重整(GIR)甲烷的可选SOFC阳极材料。
新材料设计概念也被引入改善现有材料的性能。最近,Ruiz-Morales等人[67]通过扩展缺陷的无序化来诱导功能性,从而更加高效地以甲烷为燃料工作。在LaSrTiO3中用Ga和Mn取代Ti诱导氧化还原活性和更灵活的配位。利用La4Sr8Ti11Mn0.5Ga0.5O37.5作为阳极,用甲烷作燃料,电池最大功率密度在950℃下达0.35 W/cm2。
此外,新型对称结构的SOFCs也有望解决在电池运行的过程中由于硫粒子或非晶的碳附着在阳极表面致使其失去活性的问题。英国Irvine小组[68]报道了利用氧化还原稳定的材料既作为阳极也作为阴极的对称结构SOFCs。这一新型电池构造具有如下的优点[69]:阳极表面上可能发生的硫毒化和积碳问题有可能通过将阳极和阴极反用而消除;氧化剂(空气)将冲走吸附在电极上的硫和碳粒子,从而使电极得以再生。此外,氧化还原稳定的阴极预期将提高阴极的寿命,因为阴极三相边界区的氧分压相当低,尤其是当电池在低电压下工作时(例如,为获得非常高的电流密度)。当电池存在渗漏时(电解质或密封有缺陷),即燃料进入阴极侧或空气进入阳极侧,氧化还原稳定的阳极也是一个不错的选择,可以避免不具氧化还原稳定性材料出现的性能衰退的问题。由于阳极处于还原性环境而阴极处于氧化性环境,对对称SOFCs电池中电极的要求是它在还原性和氧化性环境中必须显示出化学和结构的稳定性,并且表现出对氧还原和燃料氧化的双重电催化性能。此外,必须具有高的电子电导,降低欧姆损失;具有一定的氧离子电导,促进电化学 反 应 。 目 前 ,La0.75Sr0.25Cr0.5Mn0.5O3(LSCM),La0.8Sr0.2Sc0.8Mn0.2O3(LSSM),以及(La,Sr)(TiFe)O3(LSTF)已经被研究作为对称SOFCs的电极。迄今为止,对称SOFCs报道的最好结果是利用LSCM作为电极[70],润湿的H2作为燃料,950℃时输出功率为500 mW/cm2。相比较,这一性能仍较低,需要开发新的电极材料来改善对称SOFCs的电池性能。最近,Chen等人[69]报道了一种新型的钙钛矿材料Sr2Fe1.5Mo0.5O6-δ(SFM),在空气和氢气氛下表现出高的电导,优异的氧化还原稳定性,用作对称SOFCs的电极表现出有希望的电池性能。
最近中美两国科学家合作报道了一种新型复合阳极材料,由K2NiF4型结构的Pr0.8Sr1.2(Co,Fe)0.8Nb0.2O4+δ(K-PSCFN)基质和均匀分散的纳米尺寸的Co-Fe合金(CFA)构成[71]。在H2气氛中900℃下退火钙钛矿Pr0.4Sr0.6Co0.2Fe0.7Nb0.1O2-δ(P-PSCFN)得到这一复合阳极材料。K-PSCFN-CFA复合阳极材料显示出与Ni基金属陶瓷阳极相似的催化活性、优异的抗硫和抗积碳性能。此外,在900℃空气气氛下K-PSCFN-CFA可以被氧化回P-PSCFN,显示出优异的氧化还原循环稳定性。纯的K-PSCFN阳极对甲烷氧化的催化活性较低,但是,当使用K-PSCFN-CFA复合阳极,K-PSCFN-CFA|LSGM|P-PSCFN单电池用CH4和C3H8作为燃料,在850℃下分别获得了较高的输出功率 0.6 W/cm2和0.94 W/cm2。因此,K-PSCFN-CFA复合阳极用氢气/碳氢化合物作燃料提高的性能主要归因于在K-PSCFN基质中存在很好分散的纳米尺寸的CFA。
2.3 抗硫阳极材料
碳基燃料中通常有含硫的有机化合物,Matsusaki等人[72]用阻抗分析的方法研究了过程变量对H2S毒化Ni基阳极程度的影响。他们发现Ni-YSZ金属陶瓷阳极的SOFCs在1 273 K下很容易受到2 ppm H2S(1 ppm=10-6)的毒化。尽管在H2S浓度低于15 ppm时,性能的损失是可逆的,但是在较低的电池工作温度下,毒化效应是显著的,并且在低的H2S浓度(<100 ppm)下毒化时间相对不变。他们也发现H2S毒化的弛豫时间随工作温度的提高而降低。因此,人们非常期望研制出在含硫燃料气体中不失活的新型阳极材料。
合适的抗硫阳极材料必须是电子电导、化学和热稳定的、并且对氧化H2S,H2和CO具有催化活性。Wang等人[73]将Y0.9Ca0.1FeO3(CYF)在900℃暴露于96%H2和4%H2S的混合气体中,制备了CYF基硫化物材料,并进一步得到了锂化的硫化物。研究了锂化的硫化物作为使用含H2S气体燃料的SOFCs阳极的性能。发现向硫化物中添加锂显著地提高了电导,但是没有导致显著的相结构的变化。在650℃下,电导大约为0.02 S/cm。但是,没有研究这一材料的催化活性和长期稳定性。
研究发现氧化铈基材料除了具有抗积碳功能外,还具有一定的抗硫毒化能力。Gorte等人[74]研究了低温下用含有H2S的H2为燃料工作的Cu-CeO2-YSZ阳极的抗硫毒化性能。发现当H2S的浓度低于450 ppm时,电池在800℃时工作对阳极的性能没有影响。而在较高的H2S的浓度下,观察到阳极性能发生衰退,这归因于CeO2与H2S发生反应,生成Ce2O2S。Kurokawa等人[75]将氧化铈纳米颗粒负载在传统的Ni/YSZ阳极上在973 K下显示出很好的抗H2S性能。对于阳极没有负载氧化铈的电池,在H2中添加40 ppm H2S导致电池的电压在几分钟内降到零;相反,在阳极负载氧化铈纳米颗粒的电池,燃料气体中加入40 ppm的H2S,电池电压在几分钟内从0.78 V降到了0.6 V,但是在500 h运行中性能相对稳定。当燃料切换回纯氢,电池也恢复初始性能。最初性能的衰减可能是由于Ni的中毒,此后,氧化铈起电催化剂的作用,表现出稳定的性能。
Mukundan等人[76]在1 000℃下和含有H2S的H2/H2O燃料中研究了YSZ/La1-xSrxBO3(B=Mn,Cr,Ti)阳极材料的抗硫性能。发现在氢气燃料中存在高达5 000 ppm 的 H2S,Sr0.6La0.4TiO3/YSZ(50/50 wt%)阳极性能没有表现出衰退。当用含有1%H2S的氢气作为燃料,阳极能够运行8 h;当燃料切换回氢气,没有出现性能衰退。
浸 渍 贵 金 属 Pd 的 Sr0.88Y0.08TiO3-δ(SYT)/La0.4Ce0.6O1.8(LDC)复合材料被研究用于La0.8Sr0.2Ga0.83Mg0.17O3-δ电解质支撑电池的抗硫阳极材料[77]。发现在多孔的SYT/LDC阳极中浸渍Pd显著地提高了阳极的性能。当在阳极中添加1.5 wt.%Pd,与没有添加Pd的电极相比,阳极过电势降低一半。含有浸渍Pd的SYT/LDC阳极的单电池以干燥的H2作为燃料,在850℃和800℃下电池最大的功率密度分别为1 006 mW/cm2和577 mW/cm2,是没有浸渍Pd电池的两倍。浸渍Pd的复合阳极表现出好的抗硫性能,在含有高达50 ppm H2S的气氛下,性能基本没有衰退。
Y掺杂的SrTiO3(SYTiO3)-YSZ多孔电极骨架浸渍纳米尺寸的CeO2和Ru也被发现具有很好的抗硫性能[78]。在SYTiO3-YSZ孔壁上浸渍的颗粒大小为30~200 nm,显著地改善了SYTiO3-YSZ阳极的性能。浸渍的CeO2覆盖了SYTiO3-YSZ孔壁的大部分表面,而Ru是以单个纳米颗粒分散的。含有CeO2和Ru浸渍的SYTiO3-YSZ阳极的阴极支撑的电池在含有10~40 ppm H2S的润湿的氢气气氛下表现出高的抗硫性能,在1 073 K和含有10 ppm H2S的燃料气氛下,电池的功率密度为470 mW/cm2。他们的结果表明CeO2和Ru浸渍的SYTiO3-YSZ阳极比Ni-YSZ阳极具有较高的抗硫性能,因此,有可能使用成本有效的浸渍纳米尺寸催化材料的混合离子导体——YSZ阳极作为SOFCs抗硫阳极材料。
烧绿石结构的阳极材料Gd2Ti1.4Mo0.6O7也表现出优异的抗硫性能[79]。在10%H2S和90%H2的气体混合物中,阳极/电解质界面阻抗只有0.2 Ω·cm2,最大功率密度为342 mW/cm2。燃料电池工作6天,没有观察到明显的性能衰退,表明使用这一材料作为阳极的固体氧化物燃料电池有可能用容易得到的含硫气体的碳氢化合物作为燃料。
此外,在碳基燃料气体进入SOFCs阳极之前先经过氧化铈或氧化镧基催化剂脱硫处理,可以有效地将燃料中的含硫化合物可再生地去除,从而保护阳极材料免受造成电池不可逆功率损失的硫化反应[80]。
3 结语
本文讨论了最常使用的Ni-YSZ金属陶瓷阳极的优点和缺点。研究替代的阳极材料、重整和脱硫催化剂对于开发碳基燃料的SOFCs及其商业化非常重要。本文主要介绍了具有萤石和钙钛矿型结构的替代阳极材料。尽管最近十多年已经发现了几种有希望的可以直接氧化碳氢化合物燃料的替代阳极材料,但是,迄今为止这些阳极材料仍然存在一些问题,主要问题是与Ni相比具有低的催化活性。此外,在高温工作条件下,一些材料还不够稳定。为了改善电化学性能,这些阳极材料的组成和微观结构也需要进一步优化。浸渍一些纳米结构的阳极催化剂和电子电导相可以有效地提高表面积和三相边界,已经被证明是一种改进燃料电池性能的有效技术。利用原位的色质联谱结合光谱技术,将有助于搞清楚碳基燃料的一些催化反应机理,从而为更好地设计新型阳极材料提供指导。此外,第一性原理计算也将在合理地设计新阳极材料和理解催化反应机理方面起重要作用。
[1]Singhal S C,Kendall K.High Temperature Solid Oxide Fuel Cells:Fundamentals,Design,and Applications[M].Amsterdam:Elsevier,2003.
[2]Atkinson A,Barnett S,Gorte R J,et al.Advanced anodes for high-temperature fuel cells[J].Nat Mater,2004,3:17-27.
[3]Mclntosh S,Gorte R J.Direct hydrocarbon solid oxide fuel cells[J].Chem Rev,2004,104 :4845-4865.
[4]Jiang S P,Chan S H.A review of anode materials development in solid oxide fuel cells[J].J Mater Sci,2004,39:4405-4439.
[5]Mogensen M,Kammer K.Conversion of hydrocarbons in solid oxide fuel cells[J].Annu Rev Mater Res,2003,33:321-331.
[6]Fergus J W.Oxide anode materials for solid oxide fuel cells[J].Solid State Ionics,2006,177:1529-1541.
[7]Sun C W,Stimming U.Recent anode advances in solid oxide fuel cells[J].J Power Sources,2007,171:247-260.
[8]Lashtabeg A,Skinner S J.Solid oxide fuel cells-a challenge for materials chemists?[J]J Mater Chem,2006,16:3160-3170.
[9]Fuel Cell Handbook,7th ed.,US Department of Energy,Morgantown,WV,2004,www.netl.doe.gov[EB/OL].
[10]Gorte R J,Vohs J M.Novel SOFC anodes for the direct electrochemicaloxidationofhydrocarbons[J].JCatal,2003,216:477-486.
[11]Brown M,Primdahl S,Mogensen M.Structure/performance relations for Ni/ytrria-stabilized zirconia anodes for solid oxide fuel cells[J].J Electrochem Soc,2000,147:475-485.
[12]Tanner C W,Fung K Z,Virkar A V.The effect of porous composite electrode structure on solid oxide fuel cell performance.1.Theoretical analysis[J].J Electrochem Soc,1997,144:21-30.
[13]Wilson J R,Kobsiriphat W,Mendoza R,et al.Three-dimensional reconstruction of a solid-oxide fuel-cell anode,Nat.Mater,2006,5:541-544.
[14]Brandon N P,Skinner S,Steele B C H.Recent advances in materials for fuel cells[J].Annu Rev Mater Res,2003,33:183-213.
[15]Suzuki T,Hasan Z,Funahashi Y,et al.Impact of anode microstructureonsolidoxidefuelcells[J].Science,2009,325:852-855.
[16]Minh N Q.Ceramic fuel-cells[J].J Am Ceram Soc,1993,76:563-588.
[17]Zhu W Z,Deevi S C.A review on the status of anode materials forsolidoxidefuelcells[J].MaterSciEng,A2003,362:228-239.
[18]Steele B C H.Appraisal of Ce1-yGdyO2-y/2electrolytes for ITSOFCoperationat500℃[J].SolidStateIonics,2000,129:95-110.
[19]Murray E P,Tsai T,Barnett S A.A direct-methane fuel cell with a ceria-based anode[J].Nature,1999,400:649-651.
[20]Park S,Vohs J M,Gorte R J.Direct oxidation of hydrocarbons in a solid-oxide fuel cell[J].Nature,2000,404:265-267.
[21]McIntosh S,Vohs J M,Gorte R J.Role of hydrocarbon deposits in the enhanced performance of direct-oxidation SOFCs[J].J Electrochem Soc,2003,150:A470-A476.
[22]Kim H,Lu C,Worrell W L,et al.Cu-Ni ceramet anodes for direct oxidation of methane in solid-oxide fuel cells[J].J Electrochem Soc,2002,149:A247-A250.
[23]Lee S,Vohs J M,Gorte R J.A study of SOFC anodes based on Cu-Ni and Cu-Co bimetallics in CeO2-YSZ[J].J Electrochem.Soc,2004,151:A1319-A1323.
[24]Xie Z,Zhu W,Zhu B,et al.FexCo0.5-x-SDC anodes for low-temperature solid oxide fuel cells[J].Electrochim Acta,2006,51:3052-3057.
[25]Sun C W,Sun J,Xiao G L,et al.Mesoscale organization of nearly monodisperse flowerlike ceria microspheres[J].J Phys Chem B,2006,110:13445-13452.
[26]Skorodumova N V,Simak S I,Lundqvist B I,et al.Quantum origin of the oxygen storage capability of ceria[J].Phys Rev Lett,2002,89:166601.
[27]Marina O A,Mogensen M.High-temperature conversion of methane on a composite gadolinia-doped ceria-gold electrode[J].Appl Catal A,1999,189:117-126.
[28]Saeki M J,Uchida H,Watanabe M.Nobel metal catalysts highly-dispersed on Sm-doped ceria for the application to internal reforming solid oxide fuel cells operated at medium temperature[J].Catal Lett,1994,26:149-157.
[29]Hibino T,Hashimoto A,Yano M,et al.Ru-catalyzed anode materials for direct hydrocarbon SOFCs[J].Electrochim Acta,2003,48:2531-2537.
[30]Zhan Z,Barnett S A.An octane-fueled solid oxide fuel cell[J].Science,2005,308:844-847.
[31]Sun C W,Xie Z,Xia C R,et al.Invesitigations of mesoporous CeO2-Ru as a reforming catalyst layer for solid oxide fuel cells[J].Electrochem Commun,2006,8:833-838.
[32]Ramirez-Cabrera E,Atkinson A,Chadwick D.The influence of point defects on the resistance of ceria to carbon deposition inhydrocarboncatalysis[J].SolidStateIonics,200,136:825-831.
[33]Antonucci V,Faro M L,Rosa D L.Proceedings International Hydrogen Energy Congress and Exhibition IHEC 2005[C]//Turkey,Istanbul:2005.
[34]Wisniewski M,Boreave A,Gelin P.Catalytic CO2reforming of methaneoverIr/Ce0.9Gd0.1O2-x[J].CatalCommun,2005,6:596-600.
[35]Hibino T,Hashimoto A,Yano M,et al.High performance anodes for SOFCs operting in methane-air mixture at reduced temperatures[J].J Electrochem Soc,2002,149:A133-A136.
[36]Ahn K,He H P,Vohs J M,et al.Enhanced thermal stability of SOFC anodes made with CeO2-ZrO2solutions[J].Electrochem Solid-State Lett,2005,8:A414-A417.
[37]Ye X F,Huang B,Wang S R,et al.Preparation and performance of a Cu-CeO2-ScSZ composite anode for SOFCs running on ethanol fuel[J].J Power Sources,2007,164:203-209.
[38]Hirabayashi D,Hashimoto A,Hibino T,et al.Bi-based oxide anodes for direct hydrocarbon SOFCs at intermediate temperatures,Electrochem[J].Solid-State Lett,2004,7:A108-A110.
[39]Yang L,Choi Y,Qin W,et al.Promotion of water-mediated carbon removal by nanostructured barium oxide/nickel interfaces in solid oxide fuel cells[J].Nature Commun,2011,2.DOI:10.1038/ncomms1359.
[40]Boukamp B A.The amazing perovskite anode[J].Nat Mater,2003,2:294-296.
[41]Tao S W,Irvine J T S.A redox-stable efficient anode for solid oxide fuel cells[J].Nat Mater,2003,2:320-323.
[42]Zha S W,Tsang P,Cheng Z,et al.Electrical properties and sulfur tolerance of La0.75Sr0.25Cr1-xMnxO3under anodic conditions[J].J Solid State Chem,2005,178:1844-1850.
[43]Huang Y H,Dass R I,Denyszyn J C,et al.Synthesis and characterization of Sr2MgMoO6-δ[J].J Electrochem Soc,2006,153:A1266-A1272.
[44]Huang Y H,Dass R I,Xing Z L,et al.Double perovskites as anode materials for solid-oxide fuel cells[J].Science,2006,312:254-257.
[45]Zhang P,Huang Y,Cheng J,et al.Sr2CoMoO6anode for solid oxide fuel cell running on H2and CH4fuels[J].J Power Sources,2011,196:1738-1743.
[46]Yang L,Wang S,Blinn K,et al.,Enhanced sulfur and coking tolerance of a mixed ion conductor for SOFCs:BaZr0.1Ce0.7Y0.2-xYbxO3-δ[J].Science,2009,326:126-129.
[47]Vernoux P,Guillodo M,Fouletier J,et al.Alternative anode material for gradual methane reforming in solid oxide fuel cells[J].Solid State Ionics,2000,135:425-431.
[48]Sauvet A L,Fouletier J.Electrochemical properties of a new type of anode material La1-xSrxCr1-yRuyO3-δfor SOFC under hydrogen and methane at intermediate temperatures[J].Electrochim Acta,2001,47:987-995.
[49]Sauvet A L,Fouletier J,Gaillard F,et al.Surface properties and physicochemical characterizations of a new type of anode material,La1-xSrxCr1-yRuyO3-δ,for a solid oxide fuel cell under methaneatintermediatetemperature[J].JCatal,2002,209:25-34.
[50]Sauvet A L,Irvine J T S A.Catalytic activity for steam methane reforming and physical characterization of La1-xSrxCr1-yNiyO3-δ[J].Solid State Ionics,2004,167:1-8.
[51]Liu J,Madsen B D,Ji Z Q,et al.A fuel-flexible ceramicbased anode for solid oxide fuel cells[J].Electrochem Solid-State Lett,2002,5:A122-A124.
[52]Chen X J,Liu Q L,Khor K A,et al.High-performance(La,Sr)(Cr,Mn)O3/(Gd,Ce)O2-δcomposite anode for direct oxidation of methane[J].J Power Sources,2007,165:34-40.
[53]Jiang S P,Chen X J,Chan S H,et al.GDC-impregnated(La0.75Sr0.25)(Cr0.5Mn0.5)O3anodes for direct utilization of methane in solid oxide fuel cells[J].J Electrochem Soc,2006,153:A850-A856.
[54]Zhu X,Lv Z,Wei B,et al.Fabrication and performance of membrane solid oxide fuel cells with La0.75Sr0.25Cr0.5Mn0.5O3-δimpregnated anodes[J].J Power Sources,2010,195:1793-1798.
[55]Jiang S P,Ye Y,HeT,et al.Nanostructured palladium-La0.75Sr0.25Cr0.5Mn0.5O3/Y2O3-ZrO2composite anodes for direct methane and ethanol solid oxide fuel cells[J].J Power Sources,2008,185:179-182.
[56]Sin A,Kopnin E,Dubitsky Y,et al.Antonucci,Stabilisation of composite LSFCO-CGO based anodes for methane oxidation in solid oxide fuel cells[J].J Power Sources,2005,145:68-73.
[57]Faro M L,Rosa D L,Nicotera I,et al.Electrochemical behavior of propane-fed solid fuel cells based on low Ni content anode catalysts[J].Electrochimica Acta,2009,54:5280-5285.
[58]Slater P R,Fagg D P,Irvine J T S.Synthesis and electrical characterization of doped perovskite titanates as potential anode materials for solid oxide fuel cells[J].J Mater Chem,1997,7:2495-2498.
[59]Mukundan R,Brosha E L,Garzon F H.Sulfur tolerant anodes for SOFCs[J].Electrochem Solid-State Lett,2004,7:A5-A7.
[60]Balachandran U,Eror N G.Electrical conductivity in strontium titanate[J].J Solid State Chem,1981,9:351-359.
[61]Kolodiazhnyi T,Petric A.The applicability of Sr-deficient ntypeSrTiO3forSOFCanodes[J].JElectroceramics,2005,15:5-11.
[62]Marina O A,Canfield N L,Stevenson J W.Thermal,electrical,and electrocatalytical properties of lanthanum-doped strontium titanate[J].Solid State Ionics,2002,149:21-28.
[63]Li X,Zhao H,Shen W,et al.Synthesis and properties of Y-doped SrTiO3as an anode material for SOFCs[J].J Power Sources,2007,166:47-52.
[64]Périllat-Merceroz C,Gauthier G,Roussel P,et al.Synthesis and study of a Ce-doped La/Sr titanate for solid oxide fuel cell anode operating directly on methane[J].Chem Mater,2011,23:1539-1550.
[65]Hui S,Petric A.Evaluation of yttrium-doped SrTiO3as an anode for solid oxide fuel cells[J].J Eur Ceram Soc,20023,22:1673-1681.
[66]Vernoux P,Djurado E,Guillodo M.Catalytic and electrochemical properties of doped lanthanum chromites as new anode materials for solid oxide fuel cells[J].J Am Ceram Soc,2001,84:2289-2295.
[67]Ruiz-Morales J C,Canales-vazqzez J,Savaniu C,et al.Disruption of extended defects in solid oxide fuel cell anodes for methane oxidation[J].Nature,2006,439:568-571.
[68]Bastidas D M,Tao S W,Irvine J T S.A symmetrical solid oxide fuel cell demonstrating redox stable perovskite electrodes[J].J Mater Chem,2006,16:1603-1605.
[69]Liu Q,Dong X,Xiao G,et al.A novel electrode material for symmetrical SOFCs[J].Adv Mater,2010,22:5478-5482.
[70]Ruiz-Morales J C,Canales-Vazquez J,Pena-Martinez J,et al.On the simultaneous use of La0.75Sr0.25Cr0.5Mn0.5O3-δas both anode and cathode material with improved microstructure in solid oxide fuel cells[J].Electrochim Acta,2006,52:278-284.
[71]Yang C,Yang Z,Jin C,et al.Sulfur-tolerant redox-reversible anode material for direct hydrocarbon solid oxide fuel cells[J].Adv Mater,2012,24:1439-1443.
[72]Matsuzaki Y,Yasuda I.The poisoning effect of sulfur-containing impurity gas on a SOFC anode:Part I.Dependence on temperature,time,and impurity concentration[J].Solid State Ionics,2000,132:261-269.
[73]Wang S Z,Liu M L,Winnick J.Stabilities and electrical conductivities of electrode materials for use in H2S-containing gases[J].J Solid State Electrochem,2001,5:188-195.
[74]He H P,Gorte R J,Vohs J M.Highly sulfur tolerant Cu-ceria anodes for SOFCs[J].Electrochem Solid-State Lett,2005,8:A279-A280.
[75]Kurokawa H,Sholklapper T Z,Jacobson C P,et al.Ceria nanocoating for sulfur tolerant Ni-based anodes of solid oxide fuelcells[J].ElectrochemSolidStateLett,2007,10:B135-B138.
[76]Mukundan R,Brosha E L,Garzon F H.Sulfur tolerant anodes for SOFCs[J].Electrochem Solid-State Lett,2004,7:A5-A7.
[77]Lu X C,Zhu J H,Yang Z G,et al.Pd-impregnated SYT/LDC composite as sulfur-tolerant anode for solid oxide fuel cells[J].J Power Sources,2009,192:381-384.
[78]Kurokawa H,Yang L,Jacobson C P,et al.Y-doped SrTiO3based sulfur tolerant anode for solid oxide fuel cells[J].J Power Sources,2007,164:510-518.
[79]Zha S W,Cheng Z,Liu M L.A sulfur-tolerant anode material forSOFCs[J].ElectrochemSolid-StateLett,2005,8:A406-A408.
[80]Flytzani-Stephanopoulos M,Sakbodin M,Wang Z.Regenerative adsorption and removal of H2S from hot fuel gas streams by rare earth oxides[J].Science,2006,312:1508-1510.
Recent anode advances in solid oxide fuel cells with carbon-based fuels
Sun Chunwen1,2,Sun Jie3,Yang Wei1,2,Ma Zhaohui1,2,Li Shuai1,2,Xian Cunni1,2,Wang Shaofei1,2,Xiao Ruijuan1,2,Shi Siqi1,2,Li Hong1,2,Chen Liquan1,2
(1.Beijing National Laboratory for Condensed Matter Physics,Institute of Physics,Chinese Academy of Sciences,Beijing 100190,China;2.Key Laboratory for Renewable Energy,Chinese Academy of Sciences,Beijing Key Laboratory for New Energy Materials and Devices,Beijing 100190,China;3.Lab of Renewable Energy and Energy Safety,Institute of Chemical Defense,Beijing 102205,China)
Solid oxide fuel cells(SOFCs)are electrochemical reactors that can directly convert the chemical energy of a fuel gas into electrical energy with high efficiency and in an environment-friendly way.The recent trends in the research of solid oxide fuel cells concern the use of available hydrocarbon fuels,such as nature gas.The most commonly used anode material Ni/YSZ cermet exhibits some disadvantages when hydrocarbons were used as fuels.Thus it is necessary to develop alternative anode materials which show a mixed conductivity under fuel conditions.This article reviews the recent developments of anode materials for SOFCs with carbon-based fuels.The future trend in this field is briefly summarized as well.
solid oxide fuel cells;anode materials;carbon-based fuels;coking resistance;sulfur tolerance
O621.25
A
1009-1742(2013)02-0077-11
2012-11-05
国家重点基础研究发展计划“973计划”资助项目(2012CB215402);国家自然科学基金项目(51172275);中国科学院物理所人才启动项目(Y1k5018E11)
孙春文(1972—),男,河北阳原县人,副研究员,研究方向为固体氧化物燃料电池;E-mail:csun@iphy.ac.cn

