研究G-四链体与其配体相互作用的技术方法概述
吉妍娟 陈兴来 刘晶华
(浙江工业大学药学院,浙江 杭州 310014)
0 前言
G-四链体是由富含鸟嘌呤(G)的DNA序列通过自身折叠形成的特殊DNA二级结构[1]。该结构通常存在于染色体端粒末端及重要原癌基因的启动子区域,包括 c-myc、c-kit、bcl-2、kRAS,VEGF、胰岛素基因等[2]。研究表明,某些基因的启动子区域在形成G-四链体结构后,相应基因的转录和表达受到了影响;G-四链体的形成可能涉及到体内的一些重要生理过程,比如细胞凋亡、信号传导和肿瘤发展等[3]。因此,G-四链体被认为是小分子抗肿瘤药物研发中的新靶点[4],而从分子水平考察小分子配体与G-四链体DNA作用的技术方法显得尤为重要。目前,文献报道中研究G-四链体与小分子配体之间相互作用的方法有十余种:紫外光谱、荧光光谱、圆二色谱、凝胶阻滞实验、表面等离子体共振、荧光共振能量转移、分子模拟、电喷雾电离质谱、核磁共振、X-射线衍射等。本文根据每种方法的研究目的进行分类阐述。
1 G-四链体结构鉴定技术
富含碱基G的DNA序列能够在特定的离子强度和pH条件下,四条、两条单链之间或一条单链内的G残基通过Hoogsteen氢键形成G-四分体 (G-quartets),如图1所示。几个G-四分体堆积到一起形成一种特殊的二级结构,即G-四链体(G-quadruplex)[5]。富含碱基G的DNA序列在不同的环境条件下主要形成三种典型的构型:平行,反平行和混合G-四链体DNA(图2)。
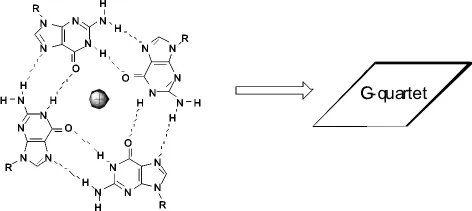
图1 四个鸟嘌呤通过Hoogsten氢键连接而成的G-四分体
1.1 圆二色谱
圆二色谱(CD)是目前最方便和最直接获得DNA二级结构的技术,它被广泛应用于研究G-四链体的结构变化。平行型G-四链体在265 nm附近有正的最大吸收,240 nm有负的最大吸收;反平行型G-四链体在295 nm附近有正最大的吸收,260 nm有负的最大吸收;混合式的G-四链体构型则包括了290 nm附近的正吸收以及特征的265 nm附近的肩峰[6]。Jyotirmayee等[7]对含有20个碱基的c-kit2 DNA序列形成的G-四链体DNA的特征CD谱图分析表明,在K+溶液中DNA主要以平行式的G-四链体存在。
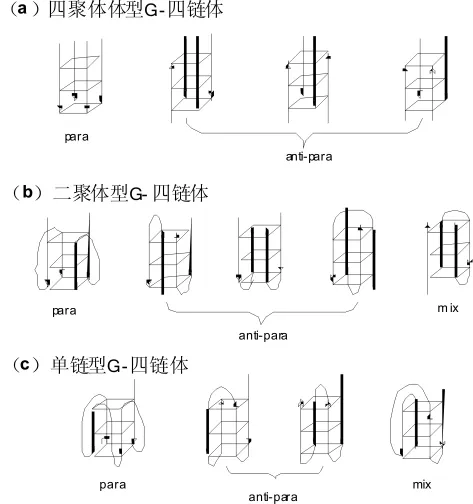
图2 不同G-四链体结构
1.2 凝胶阻滞实验
凝胶阻滞实验(EMSA)方法近来被广泛用于研究G-四链体DNA与小分子配体相互作用的检测中。一般而言,分子量不同,分子紧密程度不同的DNA片段在同等电压的作用下通过聚丙烯酰胺凝胶孔径的速率是不同的[8]。因此,当DNA样品与小分子配体作用后,诱导形成稳定的G-四链体结构时,样品的电泳迁移率与阴性对照相比就会有变化。D Sun[9]等人利用聚丙烯凝胶电泳研究了寡聚核苷酸HTG21在无化合物存在下,几乎以单体的形式存在,随着化合物的加入,出现了分子间的G-四链体二聚体,当化合物浓度达到30 mM时,二聚体的条带更加明显,如图3所示。

图3 凝胶电泳分析化合物诱导寡聚核苷酸HTG21的作用
1.3 核磁共振波谱法(NMR法)
对大多数的寡聚核苷酸所形成的G-四链体拓扑结构都能够运用NMR谱来进行研究,这种技术能提供关于四链体的构象和动力学行为的结构信息[10]。NMR研究利用谱图中可交换质子的共振信号来分析DNA结构。从缓慢交换的鸟嘌呤亚胺氢的数量可推测DNA链的数量以及G-四分体的数量和四链体的对称性。亚胺质子化学位移>12.5 ppm表示Watson-Crick碱基对存在(NH…N氢键);亚胺质子化学位移在10.5-12 ppm表示鸟嘌呤的NH…O氢键的存在,即形成了G-四分体[11]。
1.4 X-ray晶体衍射分析法
作为唯一可以对结构进行研究的直接方法X-ray晶体衍射技术,在研究G-四链体的结构中扮演着一个重要角色。该方法能获得G-四链体及G-四链体-配体复合物的精确并详细的结构信息[12]。X-ray单晶衍射分析所得到的晶体结构非常明确,它能够给出金属离子的位置,小分子配体的结合位置,以及沟槽的水合作用情况。但是,有些晶体的结构并不一定是溶液中存在的最优、最主要的结构,因为晶格能和结晶条件会影响G-四链体结构。
2 研究配体与G-四链体结合力的实验技术
在药物研发过程中,针对靶G-四链体,为了提高药物的专一性,发现特异性较强诱导G-四链体形成和使之稳定的配体成为研究者们追逐的目标。小分子与不同结构的G-四链体作用的亲和力不同,对G-四链体和双链DNA的选择性亲和能力也不同[13]。因此,研究它们的不同亲和力的技术方法是非常重要的。
2.1 表面等离子共振技术
表面等离子体子共振(SPR)技术可以不用任何标记物来考查小分子化合物与DNA之间特异性的相互作用性质,包括它们的结合,解离速率以及它们的亲和力等。该方法将待测的DNA通过共价结合方式固定到特定载体上,待测小分子化合物跟随流动相注射流过固化DNA的表面,小分子不断地与固定化的DNA结合,通过记录载体表面的折射应答信号 (Ru),可以给出出相关动力学参数(结合常数、解离常数)[14]。因此,可以利用SPR技术高通量筛选小分子化合物与目标G-四链体结合能力。
2.2 荧光共振能量转移技术
荧光共振能量转移(FRET)技术,将寡聚核苷酸的一端标记一个荧光供体 (FAM),另一端标记了一个荧光受体,即荧光淬灭体 (如TAMRA)。方法原理如图4所示,当无序的单链在K+存在条件下形成G-四链体后,荧光供体和受体之间的距离减小,引起供体激发能量转移至受体,导致荧光淬灭。反之,当四链体结构熔解拆散,受体和供体距离增大,这时就重新产生很高的荧光信号[15]。因此,可利用这一技术能用于研究不同G-四链体结构的热力学稳定性 (熔点),以及评估不同小分子配体对四链体结构的稳定能力。Jyotirmayee等[16]利用FRET实验,分析11种化合物对端粒、c-kit四链体以及对双链DNA的选择性识别能力和稳定能力。
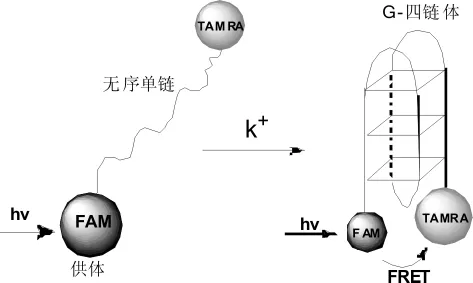
图4 荧光共振能量转移技术原理图
3 研究配体与G-四链体作用模式及计量关系的实验技术
G-四链体DNA具有区别于双链DNA的特殊几何构造,导致小分子配体与G-四链体结合模式及结合位点的多样化。研究表明,G-四链体DNA与小分子配体结合的位点包括G-四分体、沟槽(groove)、loop和离子通道;结合的模式主要包括:尾部堆积模式、内部嵌插模式和沟槽结合模式[17](如图5所示)。为了详尽探究小分子与G-四链体的作用机制,有必要研发高效、实用及准确的考察配体与G-四链体作用模式的实验技术。
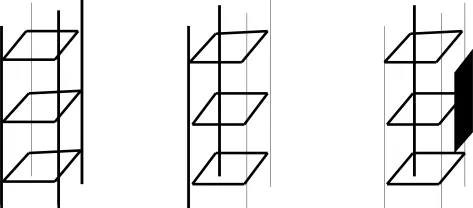
图5 小分子配体与G-四链体的结合模式
3.1 电喷雾质谱技术
电喷雾质谱(ESI-MS)凭借其快速、灵敏等特点被广泛用于研究小分子配体与G-四链体的共价或非共价相互作用。ESI-MS已成功运用于DNA与配体作用的化学计量学研究中。Alessandro等[18]采用电喷雾质谱法分析得出化合物TAS2C与端粒四链体以及双链DK66的结合比例分别为1:1和1:2,与c-kit序列结合的计量比为1:1。
3.2 紫外、荧光光谱技术
紫外可见吸收光谱(UV-Vis)是研究小分子与DNA相互作用的一种最简便、最常用的技术。许多小分子化合物在紫外可见光区有吸收峰,当小分子与DNA发生相互作用时,会导致其吸收谱带变宽、吸收峰红移及减色效应。当小分子以嵌插方式结合在DNA碱基对之间时,红移和减色效应要明显大于沟槽结合和静电结合作用[19]。荧光光谱法(FS)也是研究小分子化合物与G-四链体DNA相互作用的一种简单技术手段。荧光物质的荧光强度会因为与DNA作用而发生变化,研究此变化过程可以获取结合模式、结合常数、结合位点和分子间距等信息。小分子化合物嵌插到DNA的G-四分体之间中时,由于受到DNA碱基疏水环境的保护,自身的振动将受到抑制,荧光强度将出现一定程度的增强;静电结合或沟槽结合则不会限制分子的自由旋转,荧光强度没有明显变化[20]。
3.3 分子模拟技术
近年来,随着计算机化学技术的发展、靶标DNA晶体结构的快速增长,分子模拟(Molecular modeling)已经成为虚拟筛选药物分子,评价配体与受体结合能力和结合模式的一种重要方法。在研究小分子配体与G-四链体之间相互作用时,通常可以使用两类计算机分子模拟方法,即分子对接和分子动力学模拟[21]。分子对接是按照几何互补、能量互补以及化学环境互补的原则来找到受体与配体之间的最佳结合模式。分子动力学是按照分子瞬时的运动状态,把相互作用的两个体系作为一个复合体系,模拟体系之间的非键相互作用和体系内部各个构象变化。Wei-Bin Wu等[22]利用分子模拟研究表明,化合物以表面堆垛的模式与G-四链体作用,侧链伸入沟槽稳定四链体结构,且含有两条侧链的化合物与G-四链体的结合能力更强。

图6 化合物与G-四链体相互作用的分子模拟
4 结语
本文综述了研究G-四链体结构、小分子诱导并稳定G-四链体的能力、小分子与G-四链体作用模式的技术手段,为设计实验方案研究小分子和G-四链体的作用,以及筛选靶向G-四链体的小分子提供了必要的技术支撑及有价值的参考。
[1]Ou T,Lu Y,Tan J,et al.G-Quadruplexes:Targets in Anticancer Drug Design[J].ChemMedChem,2008,3:690-713.
[2]Qin Y,Hurley L H.Structures,folding patterns,and functions of intramolecular DNA G-quadruplexes found in eukaryotic promoter regions[J].Biochimie,2008,90:1149-1171.
[3]Maizels N.Dynamic roles for G4 DNA in the biology of eukaryotic cells[J].Nature Structural Molecular Biology,2006,13:1055-1059.
[4]Shankar B,Laurence H H,Stephen N.Targeting G-quadruplexes in gene promoters:a novel anticancer strategy[J].Nature Reviews Drug Discovery,2011,10:261-275.
[5]Burge S,Parkinson G N,Hazel P,et al.Quadruplex DNA:Psequence,topology and structure[J].Nucleic Acids Res.,2006.34:5402-5415.
[6]Michaela V,Iva K,Janos S,et al.Circular dichroism and guanine quadruplexes[J].Methods,2012,57(1):64-75.
[7]Jyotirmayee D,G Dan Pantos,et al.Synthesis and Binding Studies of Novel Diethynyl-Pyridine Amides with Genomic Promoter DNA G-Quadruplexes[J].Chem.Eur.J.,2011,17:4571-4581.
[8]Nambiar M,Goldsmith G,Moorthy Balaji T,et al.Formation of a G-quadruplex at the Bcl-2 major breakpoint region of the t(14;18)translocation in follicular lymphoma[J].Nucleic Acids Research,2011,39(3):936-948.
[9]Sun D,Zhang R,Yuan F,et al.Studies on characterization,telomerase inhibitory properties and G-quadruplex binding of η6-arene ruthenium complexes with 1,10-phenanthroline-derived ligands[J].Dalton Trans.,2012,41:1734-1741.
[10]M Webba da Sliva,et al.NMR methods for studying quadruplex nucleic acids[J].Methods,2007,43:264-277.
[11]Feigon J,Koshlap K M,Smith F W,et al.1H NMR spectroscopy of DNA triplexes and quardruplexes[J].Methods Enzymol,1995,261:225-255.
[12]Campbell N H,Parkinson G N,et al.Crystallographic studies of quadruplex nucleic acids[J].Methods,2007,43:252-263.
[13]Kieltyka R,Fakhoury J,Moitessier N,et al.Platinum phenanthroimidazole complexes as G-quardruplex DNA slective binders[J].Chemistry a European Journal,2008,14(4):1145-1154.
[14]Xu L,Wu W,Ding J.A pyridyl carboxamide molecule selectively stabilizes DNA G-quadruplex and regulates duplex-quadruplex competition[J].RSC Advances,2012,2:894-899.
[15]Allain C,Monchaud D,et al.FRET templated by G-quadruplex DNA:a specific ternary interaction using an original pair of donor acceptor partners[J].J.Am.Chem.Soc.,2006,128(36):11890-11893.
[16]Jyotirmayee D,Rabindra Nath D,Nagaratna H,et al.Synthesis of Bis-indole Carboxamides as G-Quadruplex Stabilizing and Inducing Ligands[J].Chem.Eur.J.2012,18:554-564.
[17]Haq I,Ladbury J.Drug-DNA recognition:energetics and implications for design[J].J.Mol.Recognit.,2000,13:188-197.
[18]Alessandro A,Marco F,Daniele N,et al.Total Synthesis of Taspine and a Symmetrical Analogue:Study of Binding to G-Quadruplex DNA by ESI-MS [J].European J.Org.Chem.,2013,1:191-196.
[19]Mergny J L,Phan A T,Lacroix L.Following G-quartet formation by UV-spectroscopy[J].FEBS Lett.,1988,435:74-78.
[20]Kumar C V,Asuncion E H.DNA binding studies and site selective fluorescence sensitization of anthryl probe[J].J.Am.Chem.Soc.,1993,115(19):8547-8553.
[21]Sponer J,Spackova N A.Molecular dynamics simulations and their application to four-stranded DNA[J].Methods,2007,43(4):278-290.
[22]Wu W B,Chen S H,Hou J Q,et al.Disubstituted 2-phenyl-benzopyranopyrimidine derivatives as a new type of highly selective ligands for telomeric G-quadruplex DNA[J].Org.Biomol.Chem.,2011,9:2975-2986.

