二氢杨梅素-镍配合物的合成及抗菌活性的研究
杨 文,李海霞,陈丽珍,翟锐锐
(1.海南医学院热带医学与检验医学院,海南海口571199;2.海南医学院药学院,海南海口 571199)
二氢杨梅素(dihydromyricetin,DMY)是一种重要的黄酮类化合物,是一种具有广泛生物活性的重要中药有效成分,并且是一种重要的功效添加成分,其结构具有超高的离域度、完整的大π键共轭体系及强配位氧原子与合适的空间构型,与金属离子具有较强的螯合作用。研究报道[1-2],黄酮类金属配合物的生物活性通常与金属中心离子的性质有关,且黄酮类与金属离子螯合生成配合物后生物活性增强,甚至有新的药理活性产生。二氢杨梅素(DMY)是具有抗菌、抗病毒、护肝、抗氧化、影响肝内重要的药物(毒物、致癌物)代谢酶细胞色素P450等作用的黄酮类化合物[3-4]。镍是所有生命体必需的微量元素,主要作用是激活人体中的各种酶,具有独特的协调和催化电子转移特性,对维持人体生理功能起重要作用[5-6]。本文利用天然产物藤茶有机活性成分二氢杨梅素,考察二氢杨梅素配合镍的合成、表征及其对临床常见的金黄色葡萄球菌、大肠埃希菌和白假丝酵母菌的抗菌活性,为其他天然产物的药物及食品添加剂研制开发提供借鉴。
1 材料与方法
1.1 材料与仪器
藤茶 产地广西;二氢杨梅素 为实验室自制[7];乙酸镍 西陇化工股份有限公司,分析纯;无水乙醇广州化学试剂厂,分析纯;水解酪蛋白(Mueller-Hinton,MH)琼脂培养基、MH液体培养基、沙氏琼脂培养基、沙氏液体培养基 杭州天和微生物试剂有限公司。
JASCO-FI-IR-4100型傅立叶变换红外光谱仪华洋科仪公司;AE 100型电子分析天平 苏州市莱顿科学仪器有限公司;85-2型恒温磁力搅拌器 常州澳华仪器有限公司;SHB-B95A型循环水式真空泵 西安太康生物科技有限公司;全自动高压蒸汽灭菌器美国致微(厦门)仪器公司;生化培养箱 上海博迅仪器有限公司;DZF-6021型真空干燥箱 上海精宏实验设备有限公司;三口烧瓶。
1.2 配合物的合成
将0.3202g(1mmol)二氢杨梅素加入50mL无水乙醇,在100mL的圆底烧瓶中于50℃加热搅拌溶解。加入无水醋酸钠,反应一定时间,调反应液的pH为7.5;按摩尔比1∶1加入乙酸镍(1mmol),搅拌回流6h。冷却至室温,抽滤,用无水乙醇反复洗涤沉淀,然后于50℃真空干燥10h,得土黄色固体。
1.3 抑菌方法
1.3.1 培养基的制备 按试剂使用说明进行配制并高压灭菌处理,4℃冷藏备用。
1.3.2 实验药物的配制 二氢杨梅素金属镍配合物DMY-Ni的配制:称取0.0400g,加入1.8%盐酸3滴助溶,加无菌注射用水定容至50mL,药物的最终浓度800μg/mL。二氢杨梅素DMY的配制:称取0.0400g,热溶于50mL蒸馏水中,药物的最终浓度800μg/mL。分别称取以上两种合成药物DMY-Ni和DMY,并配成药物终浓度为800μg/mL,经115℃10min高温灭菌处理备用。
1.3.3 活化菌种 斜面活化菌种,37℃培养18~20h后接种至MH琼脂平板,酵母菌28℃48h接种至沙氏琼脂平板。
1.3.4 菌悬液的制备 取传出新鲜菌株编号排序,并分别制成相当0.5麦氏单位标准比浊管浓度菌液,再用液体培养基稀释成105CFU/mL实验菌液备用。
1.3.5 最低抑菌浓度(MIC)测定采用 试管二倍稀释法进行,分别取上述药物DMY-Ni和DMY,在无菌条件下用MH肉汤分别以二倍稀释法将药物稀释,使各药物含有不同浓度的应用液,分别为400、200、100、50、25、12.5、6.25、3.125、1.5625、0.78125μg/mL共10个浓度,每管1mL。同样方法用沙氏液体培养基将药物稀释成10个浓度。同时设药物空白、阴性、阳性对照管。在上述10个不同浓度及阳性对照管中,每管加入实验菌液0.1mL,充分混匀,置37℃培养18~20h,观察并记录结果。酵母菌置28℃培养48h,观察并记录结果。以药物空白管、阴性对照管无菌生长,无药阳性对照管菌株生长良好,标准株(ATCC)为对照。以肉眼观察无菌生长的试管中所含药物的最低浓度即为最低抑菌浓度,重复3次。
1.3.6 最低杀菌浓度(MBC)测定 将未见细菌或真菌生长管,每管取出0.1mL培养液接种于相应的固体培养基上,置37℃培养18~20h,观察并记录结果。酵母菌置28℃培养48h,观察并记录结果。在药物空白管、阴性对照管无菌生长,阳性对照管菌株生长正常的条件下,凡接种的平板上菌落少于5个或未见细菌生长的最低药物浓度即为MBC,重复3次。
2 结果与讨论
2.1 二氢杨梅素-镍金属配合物的表征
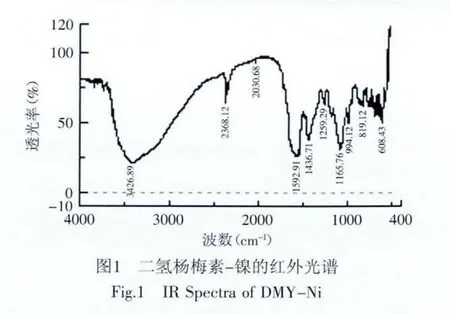
2.1.1 配合物的红外光谱 采用KBr压片法,对DMY-Ni配合物进行红外光谱扫描,结果见图1。由图1可知,3426.89cm-1是苯环上的羟基O-H伸缩振动吸收,说明配合物存在羟基;2368.12cm-1归属于苯环上的C-H伸缩振动吸收;二氢杨梅素在1641.45cm-1处有强吸收峰,这是由于4位羰基与5位羟基偶合作用,形成二氢杨梅素-镍(Ⅱ)配合物后,由于金属离子成键作用,使得4位羰基碳氧双键更弱,吸收峰位置移至1592.91cm-1处,向低波数移动了48.54cm-1;配合物和二氢杨梅素的ν(C-O-C)相比,变化较小,也表明了C环上的氧并未与金属离子发生作用;配合物在608.43cm-1处出现了ν(O-M),说明镍离子与二氢杨梅素发生了作用并形成以Ni-O键结合的二氢杨梅素-镍配合物。
2.1.2 紫外光谱 以二甲基亚砜为溶剂,测量了二氢杨梅素及其镍配合物的紫外光谱,见图2~图3。由图2知,二氢杨梅素在292.5nm处有最大吸收峰,与Ni(Ⅱ)配位后,其在308nm处出现最大吸收,最大吸收峰红移了15nm,证明镍与二氢杨梅素形成了配合物,使其二氢杨梅素的结构发生了改变。


表1 二氢杨梅素-镍配合物的抑菌情况(n=3)Table 1Antibacterial activity of DMY-Ni(n=3)
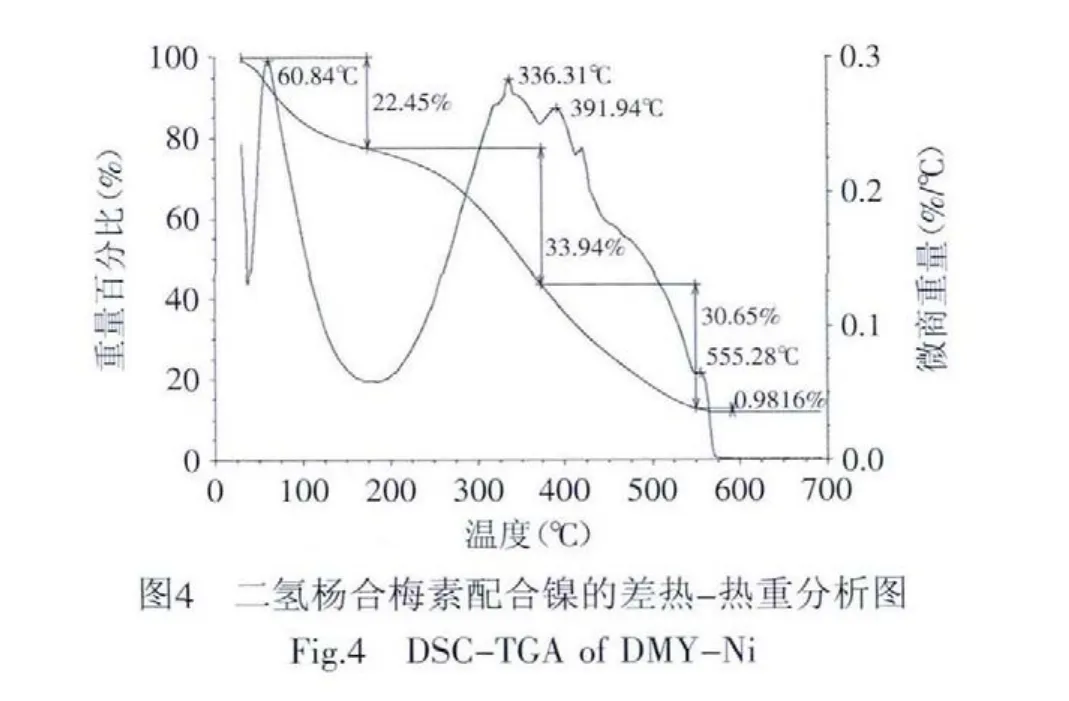
2.1.3 热重分析 二氢杨梅素镍配合物的热重分析见图4。配合物的第一失重阶段在50~150℃之间,失重率为22.45%,此阶段失重的水为配合物分子外的结晶水,与失去7个水分子的量相当。第二个阶段从220~550℃,配体迅速燃烧分解,为骨架断裂峰,失重率为65.57%,与失去1个配体分子及两个氯原子相当。最终分解产物是镍的氧化物。推测配合物的组成为[Ni(C15H11O8)Cl2]·7H2O。
2.2 二氢杨梅素-镍配合物的抑菌活性
试管液体随药物浓度降低,菌株生长梯度抑制程度下降,证明实验成功,结果可靠。二氢杨梅素及二氢杨梅素-镍配合物的抑菌及杀菌结果见表1~表3。
由表1~表3可知,二氢杨梅素-镍配合物对所测白假丝酵母菌均显示出较强的抑菌和杀菌作用,白假丝酵母菌MIC为6.25~12.5μg/mL,MBC为6.25~25μg/mL,但对金黄色葡萄球菌和大肠埃希菌无明显的抑制和杀菌作用。而二氢杨梅素对所测的金黄色葡萄球菌和大肠埃希菌有一定的抑菌和杀菌作用,其中金黄色葡萄球菌MIC为50~100μg/mL,MBC为50~100μg/mL;大肠埃希菌MIC为200~400μg/mL,MBC为200~400μg/mL,但对白假丝酵母菌无明显的抑制和杀菌作用。
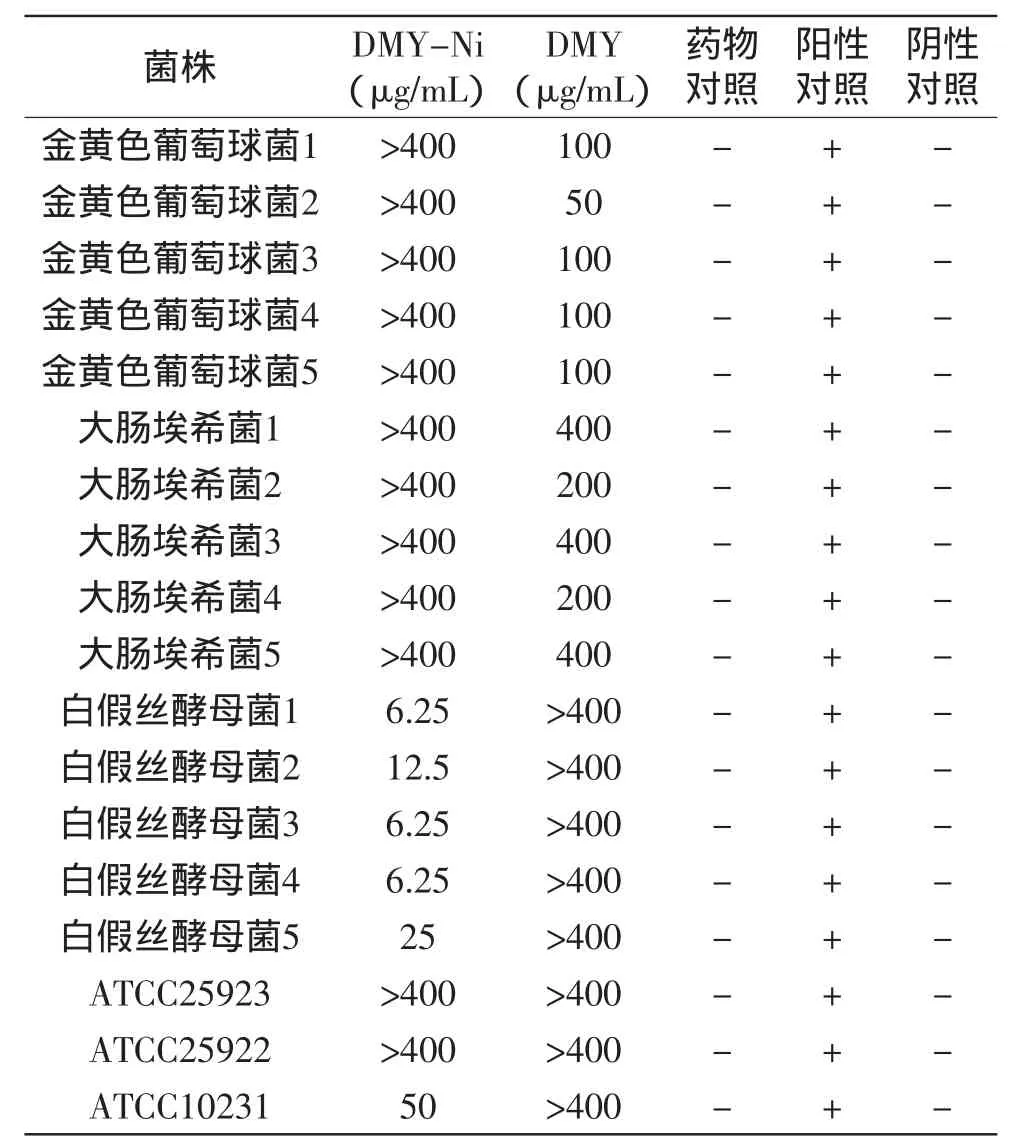
表2 二氢杨梅素-镍配合物与二氢杨梅素的MBC值(n=3)Table 2The germicidal dosage of DMY and DMY-Ni(n=3)
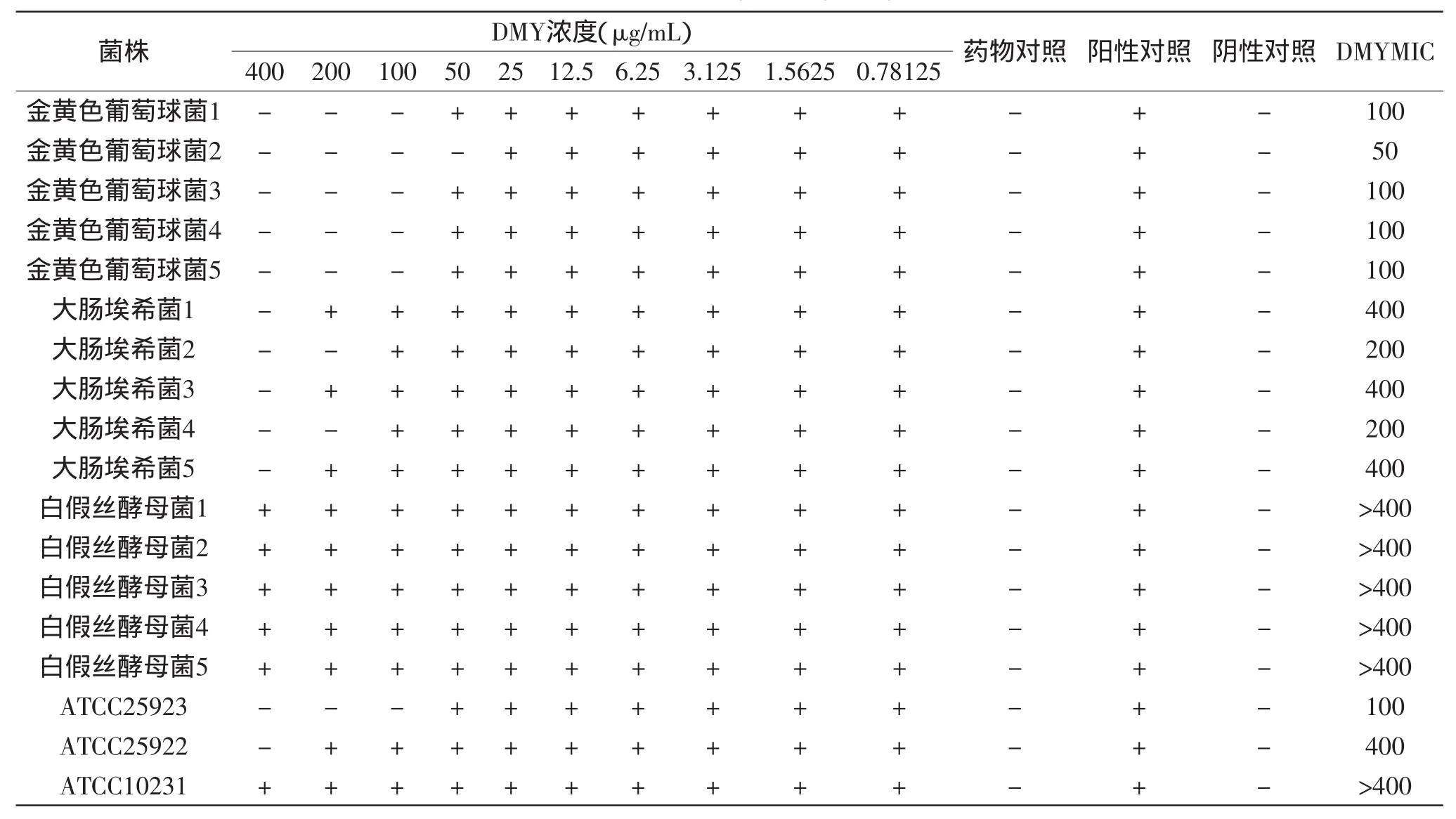
表3 二氢杨梅素的抑菌情况(n=3)Table 3 Antibacterial activity of Dihydromyricetin(n=3)
部分金属的配合物与其配体相比,抗菌活性明显提高的原因,可能是配合物本身的脂溶性增加,有强烈的渗透到微生物膜内部的特性[8-9]。二氢杨梅素-镍配合物对白假丝酵母菌显示出较强的抑菌和杀菌作用,这表明形成配合物后,更容易渗透到白假丝酵母菌膜内部,金属离子与配体二氢杨梅素可能产生协同作用,增强了抑菌和杀菌效果[10]。但是配合物对金黄色葡萄球菌和大肠埃希菌的抑菌和杀菌作用不明显,此结果的阐明,应从杀菌机理入手,有待于进一步研究。
3 结论
二氢杨梅素与镍离子发生配位形成二氢杨梅素-镍(Ⅱ)配合物,根据红外光谱、紫外光谱及热重分析的结果,可以推断配合物的组成为[Ni(C15H11O8)Cl2]·7H2O。二氢杨梅素-镍配合物对白假丝酵母菌的抑菌作用明显,这可为临床疾病的治疗提供一个可参考的途径,但二氢杨梅素-镍配合物对机体是否存在毒性,有待进一步的体内实验。二氢杨梅素对细菌(金黄色葡萄球菌和大肠埃希菌)有不同程度的抑菌和杀菌作用,但对酵母菌无明显的抑制和杀菌作用,这与之前报道的相一致[11-12]。二氢杨梅素资源丰富,与金属镍配合可以发挥不同的抗菌活性,为黄酮类药物的研究提供一种新的思路和途径。
[1]曹治权.中药药效的物质基础和作用机理研究新思路(1)—中药中化学物种形态和生物活性关系的研究[J].上海中医药大学学报,2000,14(1):36-40.
[2]刘文胜,罗维早,张志荣,等.中药研究的新学说——中药配位化学[J].华西药学杂志,2001,16(4):293-294.
[3]Qiukai Zheng,Linli Xu,Linhua Zhu,et al.Preliminary investigations of antioxidation of Dihydromyricetin in polymers[J].Bull Mater Sci,2010,33(3):273-275.
[4]Ying Xu,Fei Wang,Le Wang,et al.Baocheng Yang,Baoxian Ye,Sensitive voltammetric sensor of dihydromyricetin based on Nafion/SWNT-modified glassy carbon electrode[J].J Solid State Electrochem,2012,16:1473-1480.
[5]Marchela Pandelova,Walkiria Levy Lopez,Bernhard Michalke,et al.Ca,Cd,Cu,Fe,Hg,Mn,Ni,Pb,Se,and Zn contents in baby foods from the EU market:Comparison of assessed infant intakes with the present safety limits for minerals and trace elements[J].Journal of Food Composition and Analysis,2012,27(2):120-127.
[6]Yan Zhang,Gladyshev,Vadim N.General Trends in Trace Element Utilization Revealed by Comparative Genomic Analyses of Co,Cu,Mo,Ni,and Se[J].Journal of Biological Chemistry,2010,285(5):3393-3405.
[7]李海霞,陈丽珍,翟锐锐,等.薄层色谱法在二氢杨梅素螯合锰合成工艺中的应用[J].海南医学院学报,2011,17(4):445-447,455.
[8]Chohan Z H,Arif M,Sarfraz M.Metal-based antibacterial and antifungal amino acid derived Schiff based:Their synthesis,characterization and in vitro biological activeity[J].Appl Organomet Chem,2007,21(4):294-302.
[9]周美锋,何其庄,费菲.纳米稀土谷氨酸咪唑三元配合物的合成、表征及抗菌活性研究[J].中国稀土学报,2007,25(5):549-555.
[10]冯小强,李小芳,杨声,等.壳聚糖镧配合物的制备、表征及其抑菌性能[J].食品工业科技,2010,31(2):304-310.
[11]萧力争,银霞,刘素纯,等.二氢杨梅素抗菌活性研究[J].食品科技,2008(4):140-143.
[12]杨书珍,张友胜,宁正祥,等.二氢杨梅素对几种食品常见菌的抑制效果[J].天然产物研究与开发,2003,15(1):40-42.

