呋喃它酮代谢物5-甲基吗啉-3-氨基-2-恶唑烷酮单克隆抗体的制备、鉴定与胶体金免疫层析试纸条的研制
张晓丽,颜 露,向军俭,邹军辉,唐 勇
(广东省分子免疫与抗体工程重点实验室,暨南大学抗体工程中心,广东广州510632)
呋喃它酮属于硝基呋喃类抗生素药物,曾被广泛应用于家禽、家畜、水产养殖等的传染病预防与治疗,具有良好的抗球虫及抗菌作用[1]。但原药及其代谢物5-甲基吗啉-3-氨基-2-恶唑烷酮(AMOZ)具有相当大的毒性与副作用,能致突变、畸胎、诱发癌症[2]。1995年起欧盟、美国、加拿大等开始禁止在食用性畜禽及水产动物中使用硝基呋喃类药物,且规定残留标准为不得检出。2002年起我国也将硝基呋喃类药物列为禁用兽药,规定动物源性食品中不得检出该类药物。呋喃它酮原药在生物体内代谢迅速,难以直接检测[3],而其代谢产物AMOZ可与蛋白质结合,在生物体内稳定存在数月。因此,可以通过检测体内AMOZ水平来达到检测呋喃它酮原药残留的目的。目前常用的检测呋喃它酮及AMOZ的方法多为分析仪器法,如HPLC、HPLC-MS/MS,UHPLCMS/MS 等[4-7],该类方法检测准确、灵敏,但需要辅助大型检测仪器,对检测人员的专业技术要求较高,因而不太适应基层现场检测工作的需要。免疫学检测方法的发展,为呋喃它酮及AMOZ的检测提供了一种更简便的手段。Pimpitak[8]等用制备得到的AMOZ单克隆抗体建立了检测虾中AMOZ残留的竞争ELISA法,最低检测限达0.16μg/L。国内检测呋喃它酮及AMOZ的相关报道多是利用现成的免疫检测试剂盒来检测某样品如水产品[9]、鸡肉[10]中 AMOZ的残留,其方法灵敏度可达0.1μg/L。胶体金免疫层析技术是上世纪80年代初期出现的一种快捷的检测方法,对操作人员无技术要求,适合基层使用。而国内外并没有有关AMOZ的胶体金试纸条的研制的报道。本研究旨在制备高特异性的AMOZ单克隆抗体,并建立胶体金免疫侧向层析检测方法,实现AMOZ进行现场快速检测。
1 材料与方法
1.1 材料与仪器
BALB/c小鼠,6~8周龄,雌性 南方医科大学实验动物中心;AMOZ、对醛基苯甲酸、弗氏完全佐剂、不完全佐剂、PEG 2000、BSA、氯金酸 sigma公司;NHS、DCC pierce公司;Sp2/0骨髓瘤细胞 本实验室自存;羊抗小鼠IgG-HRP、羊抗鼠IgG 鼎国公司;NC膜 Millipore;PVP底板、聚酯膜、玻璃纤维 上海金标;细胞培养板 Greiner公司;其他试剂均为国产分析纯。
酶标仪、CO2培养箱 Thermo Labsystem;点膜仪、切条机 上海金标科技有限公司;UV-2550紫外分光光度计 日本 SHIMADZU公司;低温离心机 eppendorf。
1.2. 实验方法
1.2.1 抗原的合成及鉴定 半抗原CP-AMOZ的合成:将3mL 13.4g/L的AMOZ溶液缓慢加入1mL浓度为45g/L 4-CBA溶液中,搅拌反应1h。过滤收集沉淀,水洗三次,50℃烘干得白色粉末CP-AMOZ。取少量溶于甲醇,高效液相色谱串联质谱法(LC-MS)进行鉴定。
免疫抗原CP-AMOZ-BSA的合成:CP-AMOZ,NHS,DCC 均称取 0.1mmol,溶于 1mL DMF 中,室温下搅拌反应过夜,离心收集上清。称取70mg BSA溶于4mL PBS,然后加入上清溶液中,4℃搅拌反应过夜,离心收集上清。PBS透析3d,冷冻干燥,-20℃保存备用。检测抗原CP-AMOZ-OVA同法制备。SDS-PAGE、紫外光谱扫描鉴定完全抗原合成效果。
1.2.2 单克隆抗体的制备
1.2.2.1 动物免疫 取5只6~8周龄雌性健康BALB/c小鼠,首次免疫将CP-AMOZ-BSA与等体积弗氏完全佐剂混合,颈背部皮下多点注射,100μg/只。其后每间隔14d,免疫原与等量不完全佐剂混合再次免疫,共3次。融合前 3d,腹腔注射 100μg/只 CPAMOZ-BSA,加强免疫。
1.2.2.2 细胞融合与阳性杂交瘤细胞的筛选 参照常规细胞融合方法,并结合本实验室经验进行小鼠脾细胞与Sp2/0骨髓瘤细胞融合[12]。
以50μg/L检测抗原CP-AMOZ-OVA包被微孔板,CP-AMOZ作为竞争物进行阳性杂交瘤细胞的筛选。选择抑制率较高,细胞长势良好的阳性孔进行亚克隆,待细胞阳性率达100%后扩大培养,建株并冻存。
1.2.2.3 腹水型抗体的制备及纯化 采用小鼠体内诱生法[13]制备腹水型抗体。饱和硫酸铵沉淀法纯化腹水抗体,BCA试剂盒测定其蛋白含量。
1.2.3 单克隆抗体的鉴定
1.2.3.1 抗体效价与CP-AMOZ敏感性的测定 以50μg/L CP-AMOZ-OVA包被,间接ELISA法测定抗体效价。
采用方阵滴定[14]确定最适抗原包被浓度及抗体反应浓度,建立间接竞争 ELISA法,测定抗体对CP-AMOZ的半抑制浓度(IC50),以 IC50衡量抗体敏感度。
1.2.3.2 抗体特异性分析 间接竞争ELISA法检测抗体与其他几种硝基呋喃类代谢物及其衍生物的交叉反应性,计算各自的IC50及交叉反应率:
交叉反应率(CR,%)=IC50(CP-AMOZ)/IC50(其他)×100
1.2.4 胶体金试纸条的研制
1.2.4.1 胶体金颗粒的制备与鉴定 取干净的250mL的锥形瓶,加入100mL 0.01%氯金酸溶液,搅拌加热至沸腾,迅速加入1%的二水合柠檬酸三钠2mL,继续煮沸10min。溶液冷却后4℃下保存备用。采用紫外分光光度计及透射电镜检测金颗粒的粒径及均匀度。
1.2.4.2 抗CP-AMOZ单克隆抗体的胶体金标记取制备的胶体金溶液10mL,用0.25mol/L K2CO3溶液调节 pH至 8.5,搅拌均匀;加入 0.15mg抗CP-AMOZ单克隆抗体,继续搅拌反应20min;逐滴加入10mL 5g/L BSA搅拌反应25min;12000r/min离心15min,弃上清液;加入1mL含1g/L BSA、0.05g/L叠氮化钠pH8.5的0.05M Tris-HCl溶液使金-抗体复合物重悬,2μL/cm喷于聚酯膜结合垫上。
1.2.4.3 样品垫预处理 用含1g/L BSA、1g/L海藻糖、0.02g/L叠氮化钠和0.1g/L Tween-20的pH7.4,0.015M PBS溶液浸泡玻璃纤维样品垫,室温干燥12h后备用。
1.2.4.4 检测线、对照线蛋白包被 将CP-AMOZBSA和羊抗鼠IgG分别稀释至0.03、0.08g/L,用点膜仪以1μL/cm喷于NC膜上,分别作为检测线(T线)和质控线(C线),37℃干燥48h备用。
1.2.4.5 试纸条的组装 将样品垫、胶体金垫、NC膜与吸水纸按图1所示粘贴于PVC底板后,用切割机切成0.44mm宽的纸条,装入卡壳内。
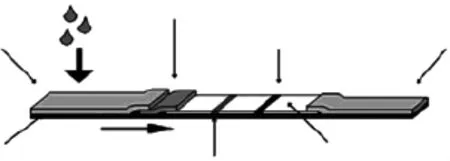
图1 胶体金试纸条结构图Fig.1 The structure chart of Test strip
1.2.5 试纸条灵敏度测试 配置不同浓度的CP-AMOZ溶液滴加于胶体金试纸条加样孔上,3~5min后肉眼观察结果。以T线肉眼完全不可见时最低浓度的CP-AMOZ浓度为该试纸条灵敏度。
1.2.6 试纸条交叉性实验 将硝基呋喃类药物代谢物 SEM、AHD、AOZ和 AMOZ及其相应衍生物CP-SEM、CP-AHD及CP-AOZ溶液滴加到试纸条加样孔上,观察结果。
2 结果与讨论
2.1 抗原的鉴定
2.1.1 半抗原的鉴定 从图2~图3中可以看到[M+H]+m/z为334.4,[M-H]-m/z为 332.5,证明半抗原CP-AMOZ(分子质量333)合成成功,且具有较高的纯度。
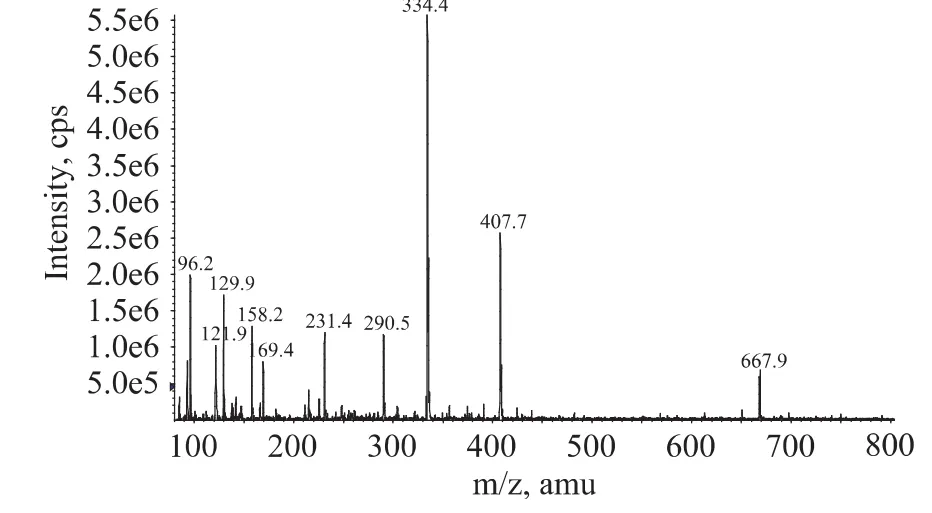
图2 CP-AMOZ正离子质谱图Fig.2 Positive hydronium mass spectra of CP-AMOZ
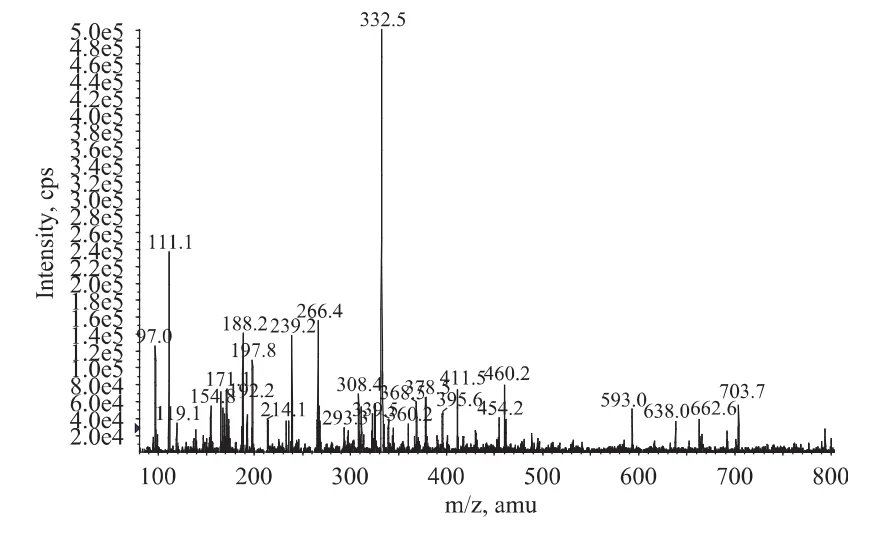
图3 CP-AMOZ负离子质谱图Fig.3 Negative hydronium mass spectra of CP-AMOZ
2.1.2 完全抗原的鉴定 SDS-PAGE结果见图4所示,CP-AMOZ-BSA条带相对于BSA条带,检测抗原CP-AMOZ-OVA条带相对于OVA条带出现了滞后。紫外光谱扫描结果显示CP-AMOZ-BSA(最大吸收峰291nm)相对于BSA(最大吸收峰280nm)与CPAMOZ(最大吸收峰294nm),CP-AMOZ-OVA(最大吸收峰291nm)相对于OVA(最大吸收峰278nm)与CP-AMOZ在最大紫外特征吸收峰上均发生了偏移(图略)。这些结果表明完全抗原CP-AMOZ-BSA和CP-AMOZ-OVA偶联成功。
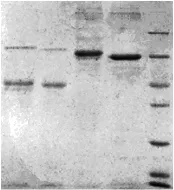
图4 AMOZ相关抗原及载体蛋白SDS-PAGE图Fig.4 SDS-PAGE patterns of AMOZ corresponding antigens and carrier proteins
2.2 小鼠抗血清效价及灵敏度测定
经5次免疫,间接ELISA检测5只免疫小鼠抗血清效价均大于1∶80000(结果未给出)。选取适宜的血清稀释倍数,进行间接竞争ELISA检测。图5结果显示,5只小鼠抗血清均能与CP-AMOZ竞争,其中4号小鼠抗血清抑制曲线的变化斜率(y=-0.259x+1.626)最高,故选择4号小鼠进行融合。
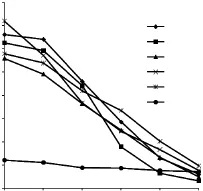
图5 间接ELISA测定小鼠抗血清灵敏度Fig.5 icELISA for sensitivity of antiserum
2.3 细胞融合及阳性杂交瘤细胞株的建立
经细胞融合,ELISA检测筛选,4次亚克隆后获得1株能稳定分泌特异性抗CP-AMOZ单抗的杂交瘤细胞株1A11D12D11B5。将上述细胞进行扩大培养、建株并制备腹水型单抗。腹水单抗经饱和硫酸铵沉淀,BCA试剂盒检测,腹水抗体的蛋白含量为1.2g/L。
2.4 抗CP-AMOZ单克隆抗体的鉴定
2.4.1 抗体效价测定 间接ELISA检测,1A11D12D11B5株腹水型单抗效价为1∶1.6×105。
2.4.2 抗体对CP-AMOZ敏感性的确定 经方阵滴定,确定最适抗原包被浓度为5μg/L,最适抗体反应浓度为30μg/L。建立间接ELISA法,并绘制其竞争标准曲线。由图6可见,标准曲线呈典型的S型。根据标准曲线的回归方程y=-37.43x+47.50计算得到CP-AMOZ 50%抑制率质量浓度为0.86μg/L,10%抑制率质量浓度(LOD)约为0.07μg/L。
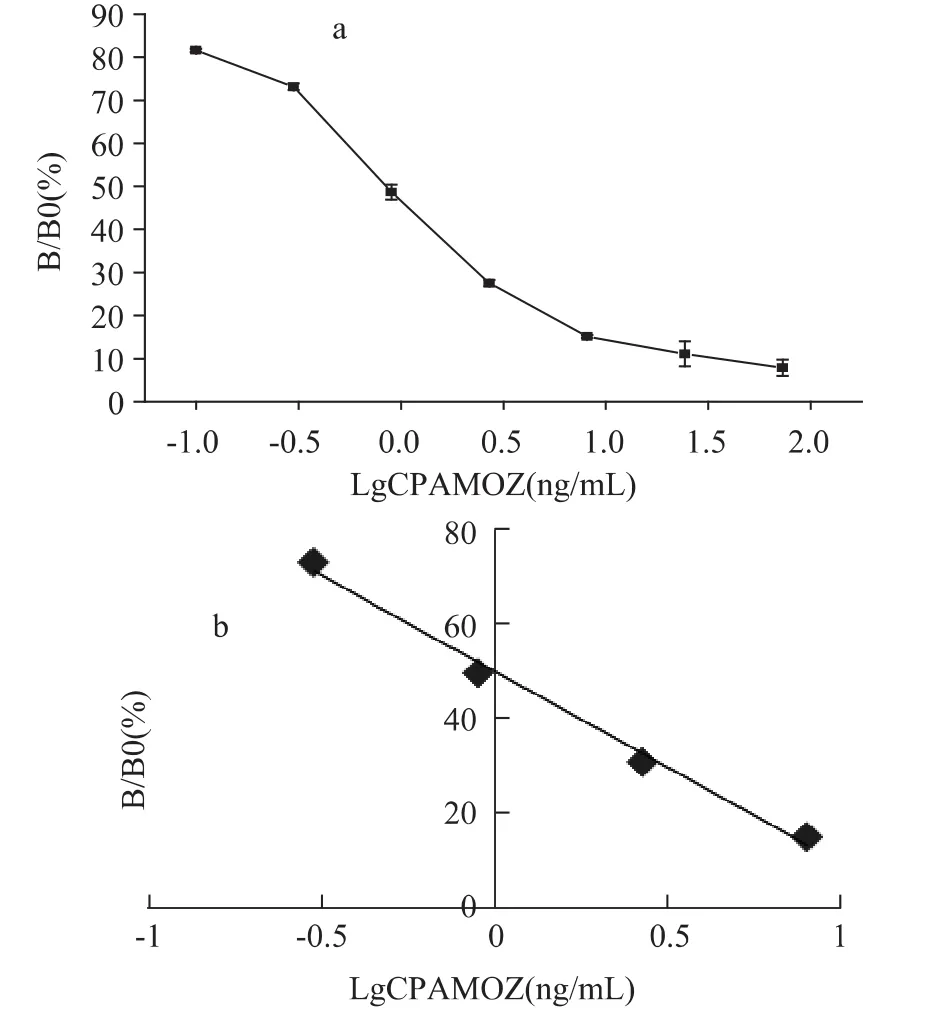
图6 CP-AMOZ的竞争标准曲线Fig.6 Representative inhibition curve for CP-AMOZ
2.4.3 抗体特异性分析 表1结果表明,所制备的腹水单抗仅与CP-AMOZ特异性反应,而与其他硝基呋喃类代谢物及其衍生物的交叉反应性均小于0.1%。

表1 CP-AMOZ单抗与其他硝基呋喃类代谢物及衍生物的交叉反应性Table 1 Cross reactivity of anti-CP-AMOZwith other nitrofuran metabolites
2.5 胶体金试纸条的研制
2.5.1 胶体金颗粒的制备及鉴定 所制备的胶体金颗粒的最大特征吸收峰出现在520nm处,在透射电镜下金颗粒形状规则且分布均匀,其粒径在20nm左右。
2.5.2 胶体金与单克隆抗体偶联前后光谱分析 偶联抗体后的胶体金可见光最大吸收峰出现了红移,说明抗体已偶联到胶体金颗粒上(图8)。
2.5.3 试纸条灵敏度的测定 当滴加CP-AMOZ标准品的浓度为2.5、3μg/L时,试纸条T线未完全消失,但相较于阴性对照(PBS稀释液)明显变浅,呈弱阳性;当CP-AMOZ标准品的浓度提高到5μg/L及以上时,试纸条T线完全消失。因此,将5μg/L定为该胶体金试纸条的灵敏度。
2.5.4 试纸条交叉测定 将CP-AMOZ试纸条分别检测硝基呋喃类药物代谢物SEM、AHD、AOZ、AMOZ及其相应衍生物CP-SEM、CP-AHD及CP-AOZ,结果显示该试纸条与最高100ppb的SEM、AHD、AOZ、AMOZ及其相应衍生物 CP-SEM、CP-AHD及CP-AOZ均无交叉反应,说明该试纸条特异性良好。

图7 胶体金颗粒的透射电镜图(×135000)Fig.7 The size of naked colloidal gold observed by TEM(×135000)
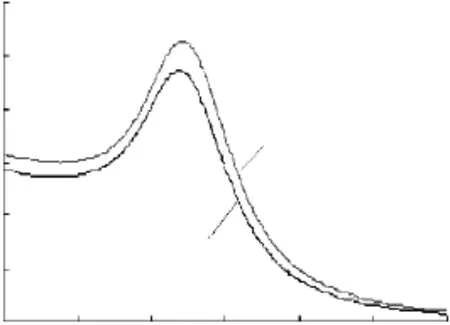
图8 胶体金可见光光谱扫描图Fig.8 Visible optical spectrum scan

图9 5胶体金试纸条灵敏度的检测Fig.9 The sensitivity of ICA with different CP-AMOZ standards

表2 试纸条与CP-AMOZ和类似物的交叉反应性测定Table 2 Cross-reactivity with CP-AMOZ and analog compounds
3 结论
3.1 AMOZ分子量仅为201,本身不具备免疫原性,必需将其与大分子载体蛋白相偶联成完全抗原,才能刺激机体产生免疫应答。虽然AMOZ可以通过活性基团氨基直接与载体蛋白偶联,但其分子结构过于简单且在形成的抗原结构中与载体蛋白的空间间隔小,因而无法形成有效的抗原表位刺激动物体产生针对AMOZ的抗体。本研究通过引入偶联剂对醛基苯甲酸,在AMOZ空间结构上增加苯环,将其衍生为CP-AMOZ,使其更适合作为抗原表位。衍生过程只使用了一种有机溶剂DMF,且仅需进行简单的水洗过滤就能得到CP-AMOZ。经LC-MS的鉴定,本方法能准确制备得到半抗原CP-AMOZ,且目标产物具有很高的纯度,整个方法简单易行。后经动物免疫获得高效价、高灵敏度的抗血清,也说明所合成的人工完全抗原能提供有效的AMOZ抗原表位,具有良好的免疫原性。
3.2 通过抗体特异性分析表明,制备的腹水型单抗与硝基呋喃类其他代谢物及衍生物均表现出较低的交叉反应性,仅与CP-AMOZ特异性的结合。就单抗的效价和间接ELISA IC50而言,与前期文献[15]相比都有所提高。
3.3 在单抗的基础上,成功建立了胶体金免疫层析试纸条,灵敏度达到5μg/L,样品前处理完成后只需3~5min即可观察结果,传统仪器法相比具有快速、灵敏、高效等特点,适合现场大规模筛查。由于单抗对CP-AMOZ有很高的特异性,所以在样品前处理的过程中应有严格的衍生过程要求,因此需要进一步研究样品前处理的方法,并优化试纸条的体系,两者相配合使该试纸条适合基层推广使用。
[1]沈小婉,李明元,叶树德.色谱法在食品分析中的应用[M].北京:北京大学出版社,1992:172-173.
[2]张仲秋,郑明.畜禽药物使用手册[M].北京,农业大学出版社,2000:74.
[3]Pawinee Thongsrisomboon,Boonsom Liawruangrath,Saisunee Liawruangrath,et al.Determination of nitrofurans residues in animal feeds by flow injection chemiluminescence procedure[J].Food Chemistry,2010,123(3),834-839.
[4]Cooper KM,Mulder PPJ,van Rhijn JA,et al.Depletion of Four Nitrofuran Antibiotics and Their Tissue-bound Metabolites in Porcine Tissues and Determination Using LC-MS/MS and HPLC-UV[J].Food Additives and Contaminants,2005,22(5):406-414.
[5]TribalatLaure,PaisseOlivier,DessalcesGuy,etal.Advantages of LC-MS-MS compared to LC-MS for the determination of nitrofuran residues in honey analytical and bioanalyticalchemistry[J] .Analytical and Bioanalytical Chemistry,2006,386(8):2161-2168.
[6]Radovnikovic Anita,Moloney Mary,Byrne Paddy,et al.Detection of banned nitrofuran metabolites in animal plasma samples using UHPLC-MS/MS[J].Journal of Chromatography B-analytical technologies in the biomedical and life sciences,2011,879(2):159-166
[7]Barbosa Jorge,Freitas Andreia,Mourao Luis Jose,et al.Determination of furaltadone and nifursol residues in poultry eggs by liquid chromatography-electrospray ionization tandem mass spectrometry[J].Journal of agricultual and food chemistry.2012,60(17),4227-4234.
[8]Umaporn Pimpitak,Songchan Putong,Kittinan Komolpis,et al.Development of a monoclonal antibody-based enzyme-linked immunosorbent assay for detection of the furaltadone metabolite,AMOZ,in fortified shrimp samples[J].Food Chemistry,2009,116(3):785-791.
[9]宋琍琍,张晓辉,王扬,等.酶联免疫法快速测定水产品中呋喃唑酮、呋喃它酮代谢物[J].浙江农业学报,2008,20(4):296-299.
[10]苏宪红,李永强.鸡肉中呋喃它酮代谢物(AMOZ)残留检测方法-酶联免疫吸附实验[J].河北北方学院学报(自然科学版),2009,25(3):67-70.
[11]P Tijssen.Practice and Theory of Enzyme Immunoassay[M].Amsterdam:Elsever,1985.
[12]Xiang Junjian,Zhai Yifan,Tang Yong,et al.A competitive indirect enzyme-linked immunoassay for lead ion measurement using mAbs against the lead-DTPA complex[J].Environmental Pollution,2010,158(5):1376-1380.
[13]Wu Jiangxiang,Zhou QingLing,Xue-ping,et al.Production of monoclonal antibodies against broad bean wilt virus[J].Journal of Zhejiang University,1999,25(2):247-250.
[14]Jung F,Meyer HD,Hamm RT.Development of a sensitive enzyme-linked immunosorbentaassay for the fungicide fenpropimorph[J].Agricand Food Chemistry,1989,37:1183-1187.
[15]范国英,张海棠,杨艳艳,等.呋喃它酮代谢物AMOZ单克隆抗体的制备与免疫学特性鉴定[J].西北农业学报2011,20(6):38-42.

