紫荆花红色素对模型动物血糖和血脂的影响研究
王金亭,吴广庆,杨敏一
(聊城大学东昌学院,山东聊城252000)
紫荆(Cercis chinensisBge.)是豆科紫荆属落叶小乔木或灌木,在全国各地均有栽培,花量资源丰富,花期长,花色艳丽,色素含量较高。紫荆花红色素是花色苷类色素,主要成分为芍药色素-3,5-双葡萄糖苷[1],经大孔树脂纯化后固体粉末紫红色,易溶于水和乙醇,性质稳定[2],无毒无害,具有抗氧化和抑菌活性[3-4],应用价值较高。文献表明:蓝莓花色苷[5-6]具有抑制肿瘤作用,紫甘薯花色苷[7]、黑豆红花色苷[8]具有降血糖作用,笃斯越桔花色苷和锦葵花色苷具有降血脂的作用[9-10],但文献检索未见紫荆花红色素对血糖、血脂调节作用的报道。在前期研究的基础上,进行了紫荆花红色素对模型动物血糖和血脂水平的影响实验,旨在充分了解其生理活性,为该红色素的进一步开发研究提供相应的理论数据。

表1 色素对小鼠血糖的影响(¯x±s,n=10)Table 1Effect of pigment on serum glucose in rats(¯x±s,n=10)
1 材料与方法
1.1 材料与仪器
紫荆花 聊城市区;昆明种小白鼠(20~25g)、SD大鼠(80~92g) 济南山东医科大学实验动物中心,实验用清洁级;普伐他丁(10mg×7片/盒) 上海施贵宝制药有限公司;胆固醇(25g/瓶)、去氧胆酸钠(10g/瓶,进口分装) 上海缘聚生物科技有限公司;丙硫氧嘧啶片(50mg×100片/盒) 深圳市中联制药有限公司;猪油 市售;吐温-80 蚌埠化学试剂厂;TC、TG、HDL-C、LDL-C试剂盒 南京建成生物工程研究所;四氧嘧啶(ALX) 美国Sigma公司,使用时用0.9%生理盐水(PSS)溶解,按ALX 150mg和PSS 18mL的比例充分溶解,过滤消毒。
TU-1810APC型紫外可见分光光度计 北京普析;AR1140电子天平 美国-奥豪斯;RE-52A旋转蒸发仪 上海亚荣;PHS-3C酸度计 上海雷磁;血糖测定仪 美国强生。
1.2 实验方法
1.2.1 色素的制备 紫荆干花→粉碎→85%乙醇超声提取→抽滤、旋蒸→紫红色提取液→AB-8大孔树脂纯化→真空浓缩→冷冻干燥至恒重→紫红色色素。
1.2.2 紫荆花红色素对正常小鼠血糖的影响
1.2.2.1 糖尿病小鼠模型的制备参考文献[11]建立四氧嘧啶致糖尿病模型。小鼠适应性饲养1周,末次进食12h后,称量空腹体重并断尾取血测定血糖浓度。选取血糖浓度为3.5~5.5mmol/L的小白鼠55只,随机取10只为对照组,其余分两次腹腔注射四氧嘧啶,第一次120mg/kg·BW,第二次80mg/kg·BW,两次间隔24h,给药后5h,每只腹腔注射质量分数50%的葡萄糖0.5mL。7d后禁食不禁水12h,称体重并断尾取血测定血糖浓度。血糖浓度超过11.1mmol/L的可判定为造模成功。
1.2.2.2 实验动物的分组和检测指标 10只正常鼠为对照组,40只造模成功的小鼠随机等分成4组,即模型组、高剂量组(High dose group,HDG)、中剂量组(Middle dose group,MDG)和低剂量组(Low dose group,LDG),根据每日体重连续灌胃强饲15d。低、中、高剂量组分别按体重灌胃色素样品100、200、300mg/kg,对照组、模型组灌胃0.9%生理盐水。末次给药后禁食不禁水12h,断尾取血测定血糖浓度。
1.2.3 紫荆花红色素对SD大鼠血脂的影响
1.2.3.1 高脂乳剂的制备参考文献[12-13]稍加改变,制备高脂乳剂。丙硫氧嘧啶于乳钵中研细,猪油于40℃水浴加热融化,备用。取乳钵,依次加入40g猪油、20g胆固醇、1g丙硫氧嘧啶,充分搅拌、溶解,再徐徐加人10%去氧胆酸钠水溶液20mL、搅拌,然后加入5mL吐温-80,均匀乳化,最后加蒸馏水至100mL。装入密闭容器中,冷藏备用,使用时先于37℃水浴融化。
1.2.3.2 高脂血症大鼠模型的制备参考文献[14-15]改进方法制备模型。SD大鼠适应性饲养7d,随机分为对照组(10只)和模型组(52只),基础饲料自由饮食。模型组大鼠每天定时腹腔注射高脂乳剂10mL/kg,正常组给予等体积去离子水。7d后,禁食不禁水12h,各组大鼠断尾取血,测定其血清TC和TG水平,TC、TG值明显高于正常组视为模型制备成功。
1.2.3.3 实验动物的分组和检测指标 50只成功造模的 SD大鼠,随机等分成5组,即阳性对照组(Positive control group,PCG)、高脂模型组(Highlipid model group,HMG)、色素 HDG、MDG 和 LDG组;10只正常SD大鼠为阴性对照组(Negative control group,NCG)。每天上午 PCG、LDG、MDG、HDG、HMG定时按体重灌胃10mL/kg高脂乳剂,NCG灌胃生理盐水;下午定时分别灌胃普伐他丁4mg/kg、紫荆花红色素10、20、30mg/kg、生理盐水。各鼠均饲以基础饲料,每天两次喂食,自由饮水。28d后,禁食不禁水12h,断尾取血,分离血清,按试剂盒要求方法步骤测定TC、TG、LDL-C及HDL-C水平,按公式计算动脉硬化指数(AI)。
1.2.4 统计学分析 采用SPSS 17.0统计软件进行数据处理,结果用¯x±s表示,组间比较采用t检验,p<0.05为差异有统计学意义。
2 结果与分析
2.1 色素对糖尿病小鼠血糖的影响
四氧嘧啶是一种自由基激活剂,可以选择性的损伤胰岛β细胞,导致胰岛素原合成障碍,引起内分泌功能紊乱、代谢失调,从而使动物血糖升高,机体消瘦而体重下降[11]。表1显示:与对照组比较,各组小鼠体重明显下降,血糖值明显升高(p<0.01),说明四氧嘧啶造模成功。与模型组比较,紫荆花红色素中、高剂量组小鼠体重显著增大,血糖极显著降低(p<0.01)。低剂量组对小鼠体重也有影响(p<0.05),对小鼠血糖的影响不显著。可见,紫荆花红色素对四氧嘧啶致糖尿病小鼠的血糖有调节作用。色素调节血糖的机制,一是可能减缓四氧嘧啶对胰岛β细胞的毒害损伤,部分恢复胰岛素的分泌功能;二是清除自由基、降低MDA浓度、增强SOD活性[4],从而提高肝脏的抗氧化能力,降低血糖浓度。
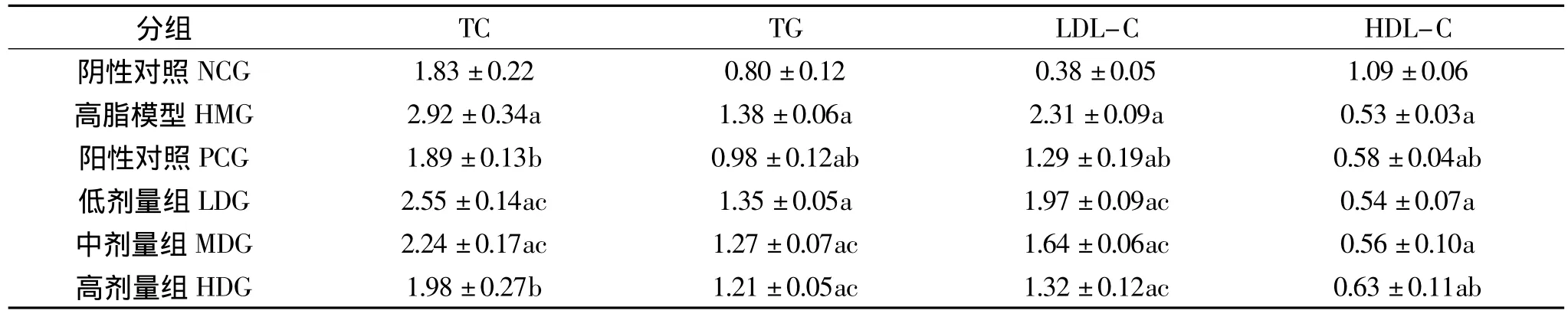
表2 色素对SD大鼠血脂的影响(n=10,¯x±s,mmol·L-1)Table 2Effect of pigment on serum lipids in SD rats(n=10,¯x±s,mmol·L-1)
2.2 色素对高脂血症大鼠的影响
表2显示:与正常对照组比较,高脂模型组大鼠血清TC、TG、LDL-C水平显著升高,HDL-C水平显著降低(p<0.01),说明高脂血症大鼠模型制备成功。与模型组比较,阳性对照组能有效降低血清TC、TG和LDL-C水平,升高HDL-C水平(p<0.01);不同剂量的色素均能显著降低TC和LDL-C水平,MDG和HDG显著降低TG水平(p<0.05),HDG对HDL-C水平具有明显的调节作用(p<0.01)。
图1显示:与高脂模型组比较,PCG和中、高剂量组的AI和LDL-C/HDL-C显著降低(p<0.01),低剂量组AI降低(p<0.05),LDL-C/HDL-C变化不明显。

图1 色素对SD大鼠动脉硬化指数的硬性Fig.1 Effect of pigment on atherogenic index of serum in SD rats
脂质代谢异常是导致高血脂的直接原因,高血脂是引发动脉粥样硬化(atherosclerosis,AS)的主要诱因。高水平TC、TG和LDL-C使AS形成的几率增高,HDL-C与AS呈负相关;AI和 LDL-C/HDL-C比值较HDL-C、LDL-C更能准确地反映血脂水平与AS、冠心病之间的关系,较低的AI和LDL-C/HDL-C比值对冠心病具有保护作用[16],AI和LDL-C/HDL-C越小,HDL-C越高,抗AS的作用越强[17]。紫荆花红色素能够明显降低血清 TC、TG、LDL-C、AI、LDL-C/HDL-C,明显升高HDL-C,因此对调节脂类代谢、预防AS和冠心病具有积极意义。
3 结论
本研究制作了糖尿病和高脂血症动物造模,测定了不同剂量紫荆花红色素对模型动物血糖和血脂水平的影响。结果表明,紫荆花红色素 MDG(200mg/kg)、HDG(300mg/kg)对四氧嘧啶致糖尿病小鼠体重显著增大,血糖明显降低(p<0.01);LDG(10mg/kg)只对小鼠体重有影响(p<0.05),对血糖的影响不明显。不同剂量的色素均能显著降低高脂乳剂致高脂血症SD大鼠TC和LDL-C水平,MDG(20mg/kg)、HDG(30mg/kg)能显著降低 TG水平(p<0.05),HDG对 HDL-C水平具有明显的调节作用(p<0.01);计算 AI和LDL-C/HDL-C,中、高剂量组的AI和LDL-C/HDL-C显著降低(p<0.01),低剂量组AI降低(p<0.05),LDL-C/HDL-C变化不明显。综上说明:紫荆花红色素对四氧嘧啶致糖尿病小鼠血糖水平、高脂血症大鼠的血脂水平有显著调节作用,能够促进糖代谢和脂代谢的良性循环,其作用机制尚需进一步深入研究。
[1]王金亭,吴广庆,鞠秀萍.紫荆花红色素化学结构的初步鉴定[J].中国食品添加剂,2010(4):97-100.
[2]王金亭,吴广庆,鞠秀萍,等.紫荆花红色素稳定性的研究[J].西北农业学报,2009,18(5):280-283.
[3]吴广庆,王金亭,鞠秀萍.紫荆花红色素体外抗氧化活性的研究[J].江苏农业科学,2009(4):317-318,340.
[4]王金亭.紫荆花红色素抑菌和体内抗氧化活性的研究[J].食品科技,2011,36(9):238-241.
[5]Weiguang Y,Casimir C A,Joan Fischer,et al.Effects of phenolic compounds in blueberries and muscadine grapes on HepG2 cellviability and apoptosis[J].Food Research International,2006,39(5):628-638.
[6]李颖畅,孟宪军,孙靖靖,等.蓝莓花色苷的降血脂和抗氧化作用[J].食品与发酵工业,2008(10):46-47.
[7]刘荣,赵静,王振宇,等.笃斯越桔花色苷对高脂血症大鼠血脂水平的影响[J].食品工业科技,2011,32(5):381-383.
[8]Zhenyu W.Impact of anthocyanin from Malva sylvestris on plasma lipids and free radical[J].Journal of Forestry Research,2005,16(3):228-232.
[9]孙晓侠.紫甘薯花色苷结构鉴定及抗氧化、降血糖功能的研究[D].天津:天津科技大学,2006.
[10]张继曼.黑豆红花色苷的优化提取及其降血糖作用的研究[D].合肥:安徽农业大学,2010.
[11]杨润军,李青旺,赵蕊.四氧嘧啶与链脲佐菌素诱导小鼠糖尿病模型效果的比较[J].西北农林科技大学学报,2006,34(2):17-20.
[12]张加雄,范开华,万丽,等.小鼠高脂血症模型建立方法的改进[J].中国药师,2006,9(8):723-724.
[13]熊静悦,周桢昊,赵璐,等.脂肪乳剂建立高脂血症小鼠的比较研究[J].中国药学刊,2006,24(8):1507-1508.
[14]李运,段博文,卫阳飞,等.复方尼阿措提取物对高脂血症大鼠的调血脂作用[J].中国新药杂志,2011,20(20):2022-2025.
[15]闫志芳,王永辉,刘季英,等.建立高血脂症动物模型的实验研究[J].山西中医学院学报,2004,5(4):15-16.
[16]Castelli WP,Anderson K,Wilson PW,et al.Lipids and risk of coronary heart disease.The F:amingham Study[J].Annals of Epidemiology,1992(2):23-28.
[17]蔡秀成,于力光,邢立新,等.松籽油对大鼠血脂及脂质过氧化的影响[J].食品科学,1999,20(6):54-57.

