养殖大黄鱼在自然海区降温不同阶段抗氧化水平及血清酶活性的变化
张晓丽, 胡玉珍, 李明云, 苗 亮, 陈 炯, 史雨红, 陆新江
(宁波大学 海洋学院 应用海洋生物技术教育部重点实验室, 浙江 宁波 315211)
大黄鱼(Pseudosciaena crocea)为暖水性近距离洄游鱼类, 主要分布于黄海南部、东海和琼州海峡以东的南海北部沿岸, 是我国特有的海水养殖种类之一。近年来由于全球环境破坏, 导致气候异常, 我国南方沿海地区常受寒流侵袭, 年年有大黄鱼被冻死,遇到冻害严重年份损失尤为惨重, 使大黄鱼养殖业受到严重影响, 故研究大黄鱼的抗寒机理, 具有重要意义。
对鱼类及其他水生变温动物来说, 水温是影响其自身生理活动的重要活动因子, 低温会破坏内环境稳态、影响抗氧化系统[1-3], 孔祥会等[4]研究显示低温下锯缘青蟹(Scylla serrataForskal)SOD、CAT等抗氧化酶活性升高, 是对低温适应的一种积极反应。血液与机体的代谢、营养状况及疾病有着密切的关系, 当机体受到外界因子的影响而发生生理或病理变化时, 会在血液指标中反映出来[5-6]。目前在低温对鱼类血液生化指标的影响方面已有较多报道, 如石桂城等[7]的研究显示当水温由 28℃降至 15℃时, 吉富罗非鱼(Oreochromis niloticus)血清ALT和AST活力均显著升高; Lermen等[8]的研究显示银鲶(Rhamdia quelen)经过冷刺激后血糖浓度降低, 甘油三酯含量升高; 何福林等[9]、向建国等[10]的研究显示水温会影响虹鳟(Salmoirideus)的红细胞数量, 血清酶活性等指标[7-8]。
在低温对大黄鱼的影响方面, 目前仅冀德伟等[11]研究了人工低温胁迫对大黄鱼血清生化的影响, 李明云等[12]对低温胁迫大黄鱼肝脏蛋白质组进行了双向电泳分析。而养殖大黄鱼在自然海区降温不同阶段抗氧化水平及血清酶含量的变化尚未见报道。作者通过研究自然越冬季节水温降低过程中大黄鱼肝脏、肌肉抗氧化水平及血清酶活性的变化来探讨水温对大黄鱼抗氧化能力的影响, 以期为大黄鱼耐低温机理的研究提供理论依据。
1 材料与方法
1.1 材料
实验于2008年冬季在浙江象山港湾水产苗种有限公司进行, 试验鱼为网箱养殖的二龄大黄鱼(体长22~25 cm, 体质量190~210 g)。每天早、中、晚测量网箱水温各 1次, 在日平均水温达到 20、16、12、10和8 ℃并稳定后进行取样, 每次取样20尾。取样时间和水温如表1。

表1 冬季自然降温过程中大黄鱼取样时间Tab. 1 Sampling time of P. crocea during natural cooling in winter
取样时将鱼快速从水中捞起, 尾静脉取血, 血样于4 ℃静置5 h后, 4 000 r/min低温离心15 min, 收集上层血清, 冷冻保存待测。同时取其肌肉和肝脏,液氮速冻后-80℃低温保存待测。
1.2 方法
1.2.1 肌肉和肝脏抗氧化指标的测定
用南京建成生物工程研究所生产的试剂盒分别测定肌肉和肝脏中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性、总抗氧化能力(T-AOC)以及谷胱甘肽(GSH)和丙二醛(MDA)的含量,操作均按照说明书进行。
1.2.2 血清生化指标的测定
用全自动生化分析仪(日立 7600-110型)测定血清生化指标, 检测指标为谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、血清脂肪酶(LIP)、腺苷脱氨酶(ADA)、乳酸脱氢酶(LDH)、γ-谷氨酰转肽酶(GGT)9种血清酶。
1.3 数据处理
实验所得数据采用SPSS16.0软件包中的单因素方差进行统计分析并用LSD法进行多重范围比较进行分析。结果以平均数±标准差表示(x±s),P<0.05 表示差异显著。
2 结果
2.1 自然降温不同阶段大黄鱼肝脏和肌肉中抗氧化指标的变化
由图1可知, 肝脏和肌肉中SOD的变化趋势截然相反。水温由20℃降至8℃的过程中, 肝脏中SOD活性逐渐增加, 8℃时的活性为63.09 U/mg蛋白, 显著高于 20℃时的 48.65 U/mg蛋白(P<0.05), 但 16℃→12℃→10℃的降温过程中SOD活性虽逐渐升高但差异不显著(P>0.05); 肌肉中 SOD活性总体呈下降趋势,在 20℃→12℃的降温过程中活性显著降低(P<0.05)。水温由20℃降至16℃时肝脏中 POD活性由1.04 U/mg蛋白显著升高至2.10 U/mg蛋白(P<0.05), 之后又显著降低(P<0.05); 肌肉中 POD活性随水温下降而降低,8℃时活性明显低于20℃(P<0.05)。肝脏和肌肉中CAT活性均随水温的下降呈降低趋势。8℃时肝脏中 CAT活性与20、16、12℃这3个水温组之间相比均显著降低(P<0.05); 肌肉中 CAT活性随着水温由 20℃降至12℃的过程中显著降低(P<0.05)。

图1 自然降温不同阶段大黄鱼肝脏和肌肉SOD、POD和CAT活性的变化Fig.1 Changes in activity of SOD, POD and CAT in liver and muscle of P. crocea during natural cooling in winter
总体可见, 3种抗氧化酶在肝脏中的活性均高于肌肉中, 而且自然降温过程中, 肝脏和肌肉中各种抗氧化酶变化趋势也存在差异(图 1)。10℃和 8℃两水温组之间, 肝脏和肌肉中SOD、POD及CAT活性变化不明显。8℃与20℃两个水温组相比, 肝脏和肌肉中的POD和CAT的酶活性均显著降低(P<0.05)。
由图2可知, 水温由20℃降至8℃, 肝脏和肌肉中 GSH含量变化趋势截然相反, 大黄鱼肝脏中GSH含量呈先升高后降低的变化规律, 即20℃降至16℃时 GSH 含量显著升高(P<0.05), 达最大值12.24 nmol/mg蛋白, 水温降至 12℃时又显著下降(P<0.05), 当水温达 8℃时 GSH含量又显著降低(P<0.05); 而在肌肉中 GSH含量却呈现先降低后升高的趋势, 即水温由 20℃降至 12℃时含量显著降低(P<0.05), 其含量由2.60 nmol/mg蛋白降至1.28 nmol/mg蛋白。当水温降至 8℃时 GSH含量又显著升高至2.90 nmol/mg蛋白(P<0.05)。各个水温组中肝脏的GSH含量均高于肌肉。在整个水温变化过程中, 肝脏中MDA含量呈先升高后降低的变化趋势, 16℃时显著高于其他各水温组(P<0.05); 肌肉中 MDA含量呈现先降低后升高的变化趋势, 12℃、10℃MDA含量显著低于其余3组(P<0.05), 而其余3组间差异不显著(P>0.05)。
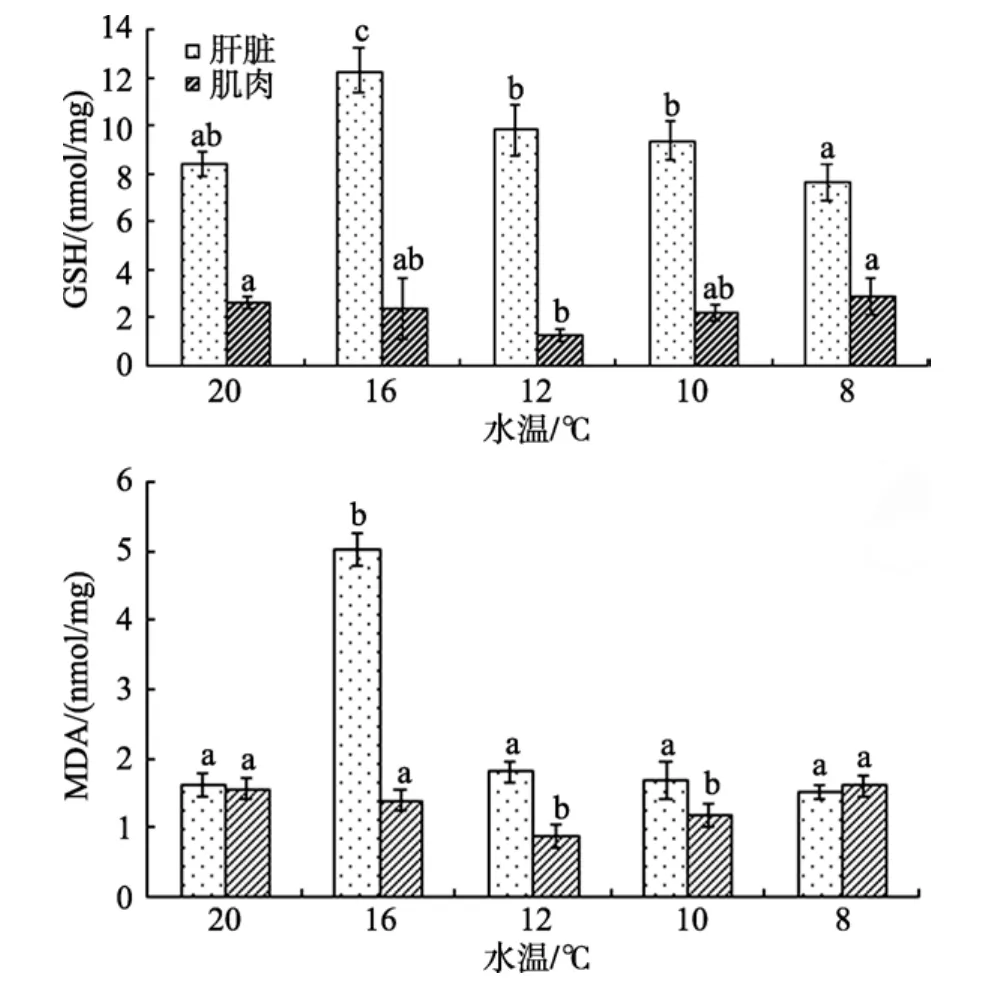
图2 自然降温过程中大黄鱼肝脏和肌肉GSH、MDA含量的变化Fig. 2 Changes in contents of GSH and MDA in liver and muscle of P. crocea during natural cooling in winter
随着水温降低, 肝脏和肌肉中总抗氧化能力(T-AOC)随水温降低均呈波动变化(图 3)。肝脏中T-AOC16℃和10℃出现两个峰值, 分别为1.13 U/mg蛋白和0.93 U/mg蛋白, 且这两组显著高于其余3组(P<0.05), 12℃活性最低为 0.42 U/mg蛋白; 肌肉中T-AOC在 10℃时最低, 为0.23 U/mg蛋白, 其余各组差异不显著(P>0.05)。
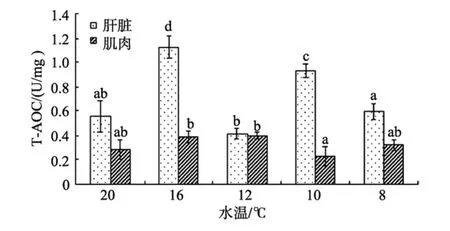
图3 自然降温过程中大黄鱼肝脏和肌肉总抗氧化能力(T-AOC)的变化Fig. 3 Changes in total antioxidant capacity (T-AOC)in liver and muscle of P. crocea during natural cooling in winter
2.2 自然降温不同阶段大黄鱼血清酶活性的变化
本试验中测定了大黄鱼9种血清酶活性, 由图4可知, 谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)及肌酸激酶同工酶(CK-MB)随水温自然下降酶活性均呈现降低趋势,即这5种血清酶在水温为20℃时活性最高。其中AST酶活性呈现较缓的降低趋势, 20℃时酶活性最高, 为84.40 U/L, 与其余 4个水温组均具有显著性差异(P<0.05)。16℃与12℃、10℃与8℃酶活性差异不显著(P>0.05), 而16℃、12℃的酶活性与10℃、8℃时相比均呈现差异显著性; 碱性磷酸酶 ALP活性在10℃时降至最低点, 为4.14 U/L, 而到8℃时略有回升, 其值为 6.31 U/L; 随着水温降低, 乳酸脱氢酶LDH活性降低呈三阶段, 20℃和16℃, 12℃和10℃差异不显著(P>0.05), 而这两组间差异显著(P<0.05),当水温降至 8℃时酶活性明显降低, 其值为 448.80 U/L, 与其他各个水温组间存在显著性差异(P<0.05);肌酸激酶同工酶 CK-MB, 在水温开始下降时, 16℃酶活性比20℃有所降低, 但差异不显著(P>0.05), 水温继续下降至 12℃时酶活性显著下降(P<0.05)。CK-MB从 12℃到 8℃降温过程中保持稳定的水平,各水温酶含量差异不显著(P>0.05)。
肌酸激酶CK和血清脂肪酶LIP活性随着水温降低呈先上升再下降的趋势。两种酶在 12℃、10℃时酶活性较高, 水温降至8℃时两种血清酶活性均降至最低。CK活性在8℃时降至2435.23 U/L, 与其他各水温组之间均存在显著性差异(P<0.05); LIP活性在8 ℃时与 20、16℃时数值接近, 差异不显著(P>0.05)。

图4 自然降温过程中血清酶活性变化Fig. 4 Changes in serum enzyme activity of P. crocea during natural cooling in winter
腺苷脱氢酶ADA和谷氨酰转肽酶GGT活性随水温降低呈上升趋势(图4)。当水温由20℃降至16℃时 ADA活性由 4.04 U/L显著升高至 4.53 U/L(P<0.05), 当水温降至 12℃时 ADA活性又显著升高至 5.30 U/L(P<0.05), 而水温由 12℃→10℃→8℃过程中ADA活性变化不显著(P>0.05); 水温由20℃降至16℃时, GGT活性由1.52 U/L显著升高至2.07 U/L(P<0.05)。
3 讨论
3.1 自然降温对大黄鱼肝脏和肌肉中抗氧化能力的影响
McCond等[13]提出的自由基伤害学说, 已广泛用于需氧生物抗逆境伤害机理的研究。动植物在经受环境胁迫(如低温、干旱等)过程中产生的损伤在很大程度上与产生过量的活性氧有关。在通常情况下,动植物体内产生的活性氧(如H2O2, -OH, O2-等)不足以使动植物受到伤害, 因为其体内有一套行之有效的抗氧化系统可以清除产生的活性氧自由基[14]。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是体内重要的保护酶, 在清除自由基中起重要作用。水温是直接影响鱼类生理活动的环境因子,主要对鱼类代谢反应速率起控制作用从而成为影响鱼类活动和生长的重要环境变量[1]。从本试验的结果可以看出当水温变化时, 大黄鱼肝脏和肌肉中SOD、POD及CAT 3种抗氧化酶的活性也随之变化。
SOD被认为是机体对抗自然水温暴露的保护剂[15]。孔祥会等[4]对低温驯化锯缘青蟹鳃抗氧化防护、ATPase及膜脂肪酸组成变化进行了研究, 发现 SOD活性随水温的降低而升高。这与本试验肝脏中 SOD活性变化趋势一致。肝脏中 POD活性仅见 16℃及12℃有显著升高。李建设等[16]认为在保护酶系统中,SOD、POD的活性起主要的调节作用, 且肝脏是机体主要的代谢器官, 各种酶种类及含量均较丰富,在机体适应调解中起重要作用。当水温变化, 肝脏能首先增加相关酶含量, 来适应环境改变, 所以水温降低时肝脏中的SOD和POD活性显著升高。从自由基伤害学说的角度解释出现这种趋势可能是由于水温下降后, 机体受到水温降低的影响, 产生大量的活性氧自由基, 使机体需要提高抗氧化酶活性来消除因此带来的损害。
肌肉中SOD和POD活性随着水温的降低呈下降的趋势, 这与肝脏中呈现相反的变化趋势, 可能是组织间的差异与肝脏相比肌肉在低温调节的滞后性或不敏感性, 酶的产生速度低于肝脏。也可能是低温对抗氧化系统有一定程度的影响, 使超氧阴离子自由基、过氧化氢、单态氧和羟自由基等自由基急剧增加, 它们直接作用于细胞, 损伤或破坏生物膜系统, 造成细胞结构和功能的损害[17-18], 从而使肌肉中的SOD和POD活性下降。
肝脏和肌肉中, CAT活性随水温的自然降低均呈下降趋势, 这可能是由于其敏感性低于其余两种酶[19-20]。
在整个自然降温过程中, 10℃和8℃两水温组之间, 肝脏和肌肉中SOD、POD及CAT抗氧化酶的活性变化不明显, 这可能是由于水温降低的幅度不够大或时间短, 也可能存在其他影响因素; 8℃时肝脏和肌肉中POD和CAT活性与20℃水温组相比较均显著下降, 而低温刺激肝脏中SOD活性显著升高。由此可见, 随水温的降低大黄鱼有一定的氧化应激反应, 为了维持鱼体内氧自由基的平衡, 在 POD、CAT活性显著降低时, SOD活性明显升高, 也可能存在其他影响因素, 有待于后续研究。
MDA是机体脂质过氧化作用的产物, 其含量高低间接反映了机体细胞受自由基攻击的严重程度,并代表机体或组织的氧化水平的高低[21]。16℃时肝脏中 MDA显著高于其他各水温组(P<0.05), 这可能是大黄鱼为了维持机体的代谢平衡而增加了脂质的代谢, 但由于水温继续降低导致机体氧化水平降低,所以MDA含量显著降低。在整个自然降温过程, 肌肉中 MDA含量降低后升高, 但与 20℃相比没有明显升高, 这也可能是温度降低肌肉中氧化水平降低。
GSH是生物体内重要的抗氧化剂, 由谷氨酸、半胱氯酸及甘氨酸组成, 既可作为谷胱甘肽过氧化物酶(GPx)和谷胱甘肽硫转移酶(GST)的底物, 通过这两种酶清除活性氧自由基, 又可直接与生物体内的氧自由基及亲电化台物结合, 清除活性氧自由基[22]。Leggatt等[23]和李大鹏等[24]研究表明, 相对高的驯化水温可增加各组织中GSH含量, 即低温会使GSH含量下降, 但本文中在水温下降初期, 肝脏 GSH含量有明显上升, 之后缓慢下降, 这可能由于降温初期体内活性氧自由基增多, 使机体提高抗氧化能力有关, 也可能是随水温的降低机体有一定的氧化应激反应, 为了维持鱼体内氧自由基的平衡GSH含量显著升高。
T-AOC是总抗氧化能力, 用于衡量机体抗氧化系统功能状况的综合性指标。T-AOC的大小可代表和反映机体抗氧化酶系统和非酶系统对外来刺激的代偿能力以及机体自由基代谢的状态, 由于 T-AOC具有很强的代表性所以是机体反映体内组织抗氧化功能的一个良好指标[25]。对南极鱼类和温带鱼类的比较研究表明, 栖息水温影响鱼体抗氧化水平, 鱼体抗氧化能力与水温之间具有较高相关性[26]。本试验中随着水温降低, 总抗氧化能力随之波动性变化,8℃、12℃和 20℃时肝脏中 T-AOC值较低, 可能是在水温较低和较高时, 鱼类机体内自由基增多, 导致防御体系的抗氧化物质减少, 从而引起 T-AOC降低[27]。在16℃和 10℃时最高, 从作者其他抗氧化酶分析, 不难得出16℃时总抗氧化能力最高, 而10℃时的升高,有可能是因为SOD活性的升高, 也可能是其他抗氧化因素的产生, 如维生素、氨基酸、金属蛋白质等都可能产生抗氧化能力的升高。
从本试验的结果可发现肌肉中 GSH含量和T-AOC值均明显低于肝脏, 可以进一步说明肝脏对清除自由基具有重要作用, 在抗氧化调节方面起到主要作用, 而肌肉组织表现出一定的滞后性。
3.2 自然降温对大黄鱼血清酶的影响
血清酶是血液学中最重要的指标之一, 绝大部分血清酶是特定的组织器官产生的, 其活性高低与相应组织器官的代谢水平和功能状态有关, 因此血清酶的变化可在一定程度上反映组织器官功能状态的变化, 如 AST可反映肝脏和心脏等器官的细胞的病变[28]; LDH是糖代谢中催化丙酮酸向乳酸转化的酶, LDH和 CK-MB也可反映心肌的受损程度,CK-MB肌酸激酶是由M和B亚基构成的杂化型二聚体, 主要存在于心肌细胞的外浆层, 是心肌酶谱中最有特异性的酶[29]; ALP是生物体内一种重要的代谢调控酶, 在生物体内直接参与磷酸基团的转移和代谢等生理过程, 对体内钙磷的吸收与代谢、维持体内适宜的钙磷比例起重要作用[30]; 肌酸激酶(CK)是诊断急性心肌梗死重要的酶学指标之一。当机体器官发生病变时, 器官中的酶会逸出进入血液, 而导致血清酶的升高, 以此来判断器官的损伤。如肝细胞出现1%异常, 足以使血清中的酶活性增加1倍[31],即在一定程度上反映出水温对于机体器官有一定的损伤。但不能完全从器官损坏来解释越冬季节血清酶的变化。
当适宜水温下, 酶活性基本保持不变, 但当水温超过适宜的水温, 酶活性呈快速下降趋势[30]。本试验中随着越冬季节水温自然下降, 多数血清酶呈现下降趋势, 如ALT、AST、ALP、LDH及CK-MB等血清酶, 这几种酶在 20℃时活性最高, 这与中华鲟(Acipenser sinensis)幼鱼的血清酶ALT、AST和LDH的最适温度相同[27], 这可能是由于冬季水温下降,机体代谢减慢而引起酶活性的下降。而这种变化是否由机体损伤所致, 还是由代谢等其他原因导致,有待于进一步研究。
肌酸激酶 CK是一种分布在骨骼肌和心肌等肌肉组织中的酶, 是神经肌肉损伤的酶学指标。CK活性先升高后降低, 这可能由于开始降温时, 机体为了适应水温的变化而增加能量代谢所致[32]。CK酶活性在 8℃时降至 2435.231 U/L, 明显低于其他各组(P<0.05), 可能是由于水温过低大黄鱼活动减少, 代谢减慢, 某些组织受损或疾病能致机体免疫功能下降而引起肌酸激酶含量改变,从而导致血清中肌酸激酶活性降低。血清脂肪酸 LIP是催化脂肪代谢的关键酶, 随水温降低LIP也先升高再降低, 这可能是由于低温时鱼类进食减少, 机体转换代谢方式, 代谢体内脂肪加剧, 而糖类代谢减少。
GGT和ADA主要来源于肝脏, 是肝细胞的胞浆酶, 该酶可以作为反映肝实质损伤的指标[33]。任何原因造成的肝细胞损伤, 都会使其肝细胞膜的通透性就会增强, 从而致使血清中的 ADA和 GGT酶的含量升高。本试验中越冬期间随水温的降低 GGT和ADA活性均呈上升趋势, 很可能是水温的降低对大黄鱼的肝细胞造成损伤, 而使得肝脏中ADA和GGT释放到血液中所致[10,33], 综上所述水温是影响大黄鱼的血清酶活性的主要影响因素之一, 从而影响大黄鱼的生长代谢。
[1]Martínez-lvarez R M, Morales A E, Sanz A. Antioxidant defenses in fish:Biotic and abiotic factors [J].Rev Fish Biol Fisher,2005,15:75-88.
[2]Lushchak V I, Bagnyukova T V. Temperature increase results in oxidative stress in goldfish tissues.1.Indices of oxidative stress[J]. Comparative Biochemistry and Physiology, 2006, 143 C: 30-35.
[3]王银, 朱艺峰, 陈芝丹. 变温对鱼类抗氧化防御影响的Meta分析[J]. 生态科学, 2011, 30(3): 301-308.
[4]孔祥会, 王桂忠, 李少菁. 低温驯化锯缘青蟹鳃抗氧化防护、ATPase及膜脂肪酸组成变化[J]. 水生生物学报, 2007, 31(1): 59-66.
[5]Adams S. Biological indicators of stress in fish[J].American Fisheries Society, Bethesda, M D, 1990, 1-8.
[6]章雪丹, 叶超霞, 冼健安, 等. 鱼类低温应激研究进展[J]. 饲料工业, 2013, 34(6):17-22.
[7]石桂城, 董晓慧, 陈刚, 等. 饲料脂肪水平对吉富罗非鱼生长性能及其在低温应激下血清生化指标和肝脏脂肪酸组成的影响[J]. 动物营养学报, 2012, 24(11):2154-2164.
[8]Lermen C L, Lappe R, Crestani M, et al. Effect of different temperature regimes on metabolic and blood parameters of silver catfishRhamdia quelen[J]. Aquaculture, 2004, 239(1–4): 497-507.
[9]何福林, 向建国. 水温对虹鳟四种血清酶活性影响的比较研究[J]. 内陆水产, 2008, 33 (06):45-46.
[10]向建国, 何福林, 钟蕾. 不同水温下虹鳟血清酶的活性[J]. 淡水渔业, 2008, 38(2): 74-75.
[11]冀德伟, 李明云, 王天柱, 等. 不同低温胁迫时间对大黄鱼血清生化指标变化指标的影响[J]. 水产科学,2009, 28(1): 1-4.
[12]李明云, 冀德伟, 吴海庆, 等. 低温胁迫下大黄鱼肝脏蛋白质组双向电泳分析[J]. 农业生物技术学报,2010, 18(2): 323-328.
[13]McCond P, Fridorich L. The role of oxygen free radicals in biological process[J]. Biol Chem, 1969, 244:6049-6055.
[14]Elstner E F. Oxygen activation and oxygen toxicity[J].Ann Rev Plant Physiol, 1982, 33: 73-96.
[15]Filho D W, Giulivi C, Boveris A. Antioxidant defences in marine fish.I:Teleosts[J]. Comp Biochem Physiol,1993, 106C: 409-413.
[16]李建设, 查丁石, 吴雪霞. 低温胁迫对茄子幼苗生理生化指标的影响[J]. 中国蔬菜, 2006, 11: 21-23.
[17]Kihara K, Itosu C. Structure of demersal fish community in the South China Sea[J]. Nip Suis Gakk, 1989,55(4): 639-642.
[18]孙金辉, 徐赟霞, 季延滨, 等. 温度骤降对南美白对虾仔虾抗氧化机能的影响[J]. 天津农学院学报, 2008,15 (3): 7-10,28.
[19]张秀芳, 李明堂. 2-氯硝基苯对鲫鱼体内抗氧化酶的影响[J]. 吉林农业大学学报, 2009, 31(1): 69-72.
[20]梁拥军, 孙向军, 孙砚胜, 等. 复方中草药对宝石鲈抗氧化能力及免疫功能的影响[J]. 安徽农业科学,2009, 37(15): 7026-7029.
[21]陈汉, 王慧君, 李学蜂. 甲肇苯内胺对大鼠脑组织中NO、SOD和MDA的影响[J]. 中国药物依赖性杂志, 2007, 16(2): 102-104.
[22]Stein J, Collier T, Reichert W, et al. Bioindicators of contaminant exposure and sublethal effects studies with benthic fish in Puget Sound, Washington[J]. Environmental Toxicology and Chemistry, 1992, 11: 701-714.
[23]Leggatt R, Brauner C, Schulte P, et al. Effects of acclimation and incubation temperature on the glutathione antioxidant system in killifish and RTH-149 cells[J]. Comparative Biochemistry and Physiology, Part A,2007 (146): 317-326.
[24]李大鹏, 刘松岩, 谢从新, 等. 水温对中华鲟血清活性氧含量及抗氧化防御系统的影响[J]. 水生生物学报, 2008, 32 (3): 327-332.
[25]Lewis S E, Boyle P M, McKinney K A, et al. Total antioxidant capacity of seminal plasma is different in fertile and infertile men[J]. Fertility and Sterility, 1995,64(4): 868-870.
[26]Gieseg S P, Cuddihy S, Jonathan V H, et al. A comparison of plasma vitamin C and E levels in two Antarctic and two temperate water fish species[J].Comparative Biochemistry and Physiology, 2000,125B: 37l-378
[27]冯广朋, 庄平, 章龙珍, 等. 温度对中华鲟幼鱼代谢酶和抗氧化酶活性的影响[J]. 水生生物学报, 2012,36 (1): 137-142.
[28]王媛, 杨康健, 吴中, 等. 氯氰菊酯对鲫鱼血清中谷丙转氨酶及谷草转氨酶活力的影响[J]. 水产科学,2005, 24(9): 6-10.
[29]崔杰峰, 潘柏申. 急性心肌梗死血清酶标志物沿革[J]. 上海医学检验杂志, 2000, 15(1): 13-14.
[30]张继平, 林建成, 谢进金,等. 草鱼碱性磷酸酶的分离纯化与部分性质研究[J]. 厦门大学学报(自然科学版), 2005, 44(5): 684-687.
[31]杨晴. 血清转氨酶长期升高的原因和处理[J]. 实用乡村医生杂志, 1999, 6(1): 14-16.
[32]杨玉英, 李士泽, 袁学军, 等. 水温对中国荷斯坦奶牛血液某些生化指标的影响[J]. 应用与环境生物学报, 2002, 8(2): 171-173.
[33]徐克诚, 孟宪镛. 临床肝胆病学[M]. 天津: 天津科技出版社, 1987: 282-283.

