流式细胞术分析小鼠肝纤维化时机体免疫细胞的变化
刘 新 娄金丽* 白 丽 张晓慧 丁 美 段钟平
(1.首都医科大学附属北京佑安医院临检中心,北京100069;2.首都医科大学附属北京佑安医院人工肝中心,北京100069)
肝纤维化是乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)等各种病因引起的慢性肝损伤发展为肝硬化的必经病理过程,阻断或者逆转肝纤维化是治疗慢性肝病的重要目标[1]。就HBV感染而言,世界上每年约有3.5亿人感染HBV,其中100多万人死于肝病末期[2],因此研究免疫因素对纤维化的调节作用,对控制纤维化的进展、控制慢性肝损伤的病死率有重要意义。流式细胞术(flow cytometry,FCM)分析四氯化碳(carbon tetrachloride,CCl4)诱导的肝纤维化小鼠的外周血和肝组织浸润的Tregs、NK1.1+细胞、CD4+细胞和 CD8+细胞频率的变化,以阐述肝脏局部浸润肝纤维化时不同免疫细胞的变化,初步探讨Tregs等免疫细胞在纤维化中的作用。
1 材料与方法
1.1 小鼠分组与肝纤维化模型的建立
无特定病原体(specific pathogen free,SPF)级C57BL/6J雄性小鼠,体质量(20±2)g,由中国人民解放军军事医学科学院提供〔实验动物许可证号:SCXK-(军)2007-004〕。采用数字表法随机分成2组,分别为对照组和肝纤维化组,每组5只。肝纤维化组腹腔注射CCl4(浓度从2% 逐渐增加至30% ,0.1 mL/10 g,2次/周,6周),对照组腹腔注射等量0.9%氯化钠注射液。
1.2 血清转氨酶检测
眼球采血分离血清,生化法检测血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)。
1.3 病理学观察
用10%中性甲醛固定肝组织,包埋、切片、行 HE染色及Masson染色,显微镜下观察肝组织炎性反应及纤维化程度。
1.4 肝组织非实质细胞的分离
常规取小鼠肝脏,研磨肝组织后,加IV型胶原酶(终浓度0.5 mg/mL,美国 Sigma 公司)、DNaseⅠ (终浓度50~100 U/mL,美国Sigma公司),放震荡孵箱(37℃,40 min)进行消化、离心细胞并进行冲洗。用Ficoll液分离,取雾状白膜层细胞,洗后计数细胞稀释至106/mL以备染色,进行流式检测。
1.5 流式细胞仪检测
小鼠外周血细胞Foxp3抗体胞内染色需固定破膜,按试剂说明书操作程序进行染色。肝的非实质细胞提取后,镜下计数调整至合适的浓度,取大约105个细胞进行染色,不需要裂解红细胞,方案与血液的染色方案基本相同。所用流式细胞仪FC500(Beckman Coulter),所用抗体Anti-mouse CD4 FITC(clone:GK1.5)、Anti-mouse CD8a PE-Cy7(clone:53-6.7)、Antimouse CD25 FE-Cy5(clone:PC61.5)、Anti-mouse Foxp3 PE(clone:NRRF-30)、Rat IgG2a K Isotype Control PE、NK1.1 PE及固定破膜剂均来自于eBioscience公司。
1.6 统计学方法
采用SPSS 17.0统计软件,计量数据以均数±标准差(ˉ±s)表示,Levene’s分析组间方差齐性,符合方差齐性的采用独立样本t检验,方差不齐采用校正t检验;肝脏和血液中的差异分析采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CCl4诱导的小鼠肝纤维化的建立
1)肝功能的改变
肝纤维化组小鼠血清ALT〔(567.33 ±242.53)U/L〕高于对照组〔(41.63 ±18.40)U/L,P <0.05,n=3〕。
2)肝组织病理学改变
肝脏大体观,肝纤维化组小鼠肝组织触之较对照鼠肝脏稍硬,表面和切面呈弥漫小结节,有细颗粒感。HE染色显示纤维化组肝细胞索排列紊乱,肝小叶结构破坏或消失,纤维隔内有大量炎性细胞及成纤维细胞浸润。Masson染色镜下观察,纤维化组肝组织汇管区、中央静脉可见大量胶原,肝小叶被大量胶原纤维束分割并包绕,形成纤维间隔(图1),提示肝纤维化成功建立。
2.2 纤维化小鼠调节性T细胞上升
与对照组小鼠比较,可以看到纤维化时肝中浸润的调节性T细胞 CD25+Foxp3+/CD4+增加(P<0.01,表1、图2),与此同时,纤维化肝组织CD4+细胞中CD25+细胞的表达频率以及CD25+细胞中Foxp3+细胞的表达频率均上升(P<0.05)。在外周血中,检测结果与肝组织的检测结果趋势相同,但与对照组比较,差异无统计学意义(表1)。
2.3 纤维化时肝内NK1.1+细胞下降
NK1.1+细胞在对照组肝脏中的表达为(19.80±5.97)%远远高于其在血液中的表达(1.06±0.63)%(P <0.01,n=5),肝纤维化小鼠肝组织中 NK1.1+细胞占淋巴细胞的百分比为(9.53±2.25)%,显著低于对照组(P<0.05,n=5),肝纤维化小鼠血液中NK1.1+细胞占淋巴细胞的百分比为(0.38±0.13)%,低于对照组的表达(P <0.05,n=5),详见图3。
2.4 肝纤维化时CD4+细胞、CD4+/CD8+比值下降
肝纤维化时机体处于免疫耐受的状态,结果均显示肝纤维化组肝组织中CD4+细胞的比例下降,CD4+/CD8+比值下降,但差异无统计学意义(P>0.05),血液中亦如此,详见表2。

图1 实验小鼠6周时肝组织病理学改变Fig.1 Pathological changes of liver of C57BL/6J mice in the sixth weeks(100×)Black arrow:collagenous fiber bundle.

表1 肝脏内和外周血中调节性T细胞的变化Tab.1 Changes of Tregs frequency in liver and peripheral blood n=3(%)
3 讨论
目前采用流式细胞术对肝纤维化的研究主要集中于对血液细胞的分析,也有对脾脏中细胞变化进行研究的。但是这些细胞都不能很好的说明肝脏局部免疫细胞的变化,因此本研究建立了肝非实质细胞的流式细胞术检测方法,分析肝脏局部的免疫应答状态。
Kvakan等[3]研究证实Tregs细胞对心脏纤维化过程具有抑制作用,Claassen等[4]研究发现Tregs对HCV感染导致的肝纤维化可能具有抑制作用。基于Tregs细胞在器官纤维化中的作用,本研究进一步研究其与小鼠肝纤维化的相关性。结果显示,肝纤维化时,肝脏中浸润的CD4+CD25+Foxp3+调节性T细胞比例上升,提示调节性T细胞参与了CCl4介导的小鼠肝纤维化过程中的免疫调节,也就意味着纤维化时肝组织局部处于免疫耐受状态,笔者在肝纤维化Balb/c小鼠的肝组织中也发现了相同的情况,并且这种上升不仅表现为CD25+Foxp3+/CD4+的升高,而且CD25+细胞中Foxp3+的表达也升高;血中Tregs占淋巴细胞的比例也有轻微的上升,但差异无统计学意义。因此笔者推测肝局部浸润Tregs可能对肝纤维化起到一定的抑制作用。
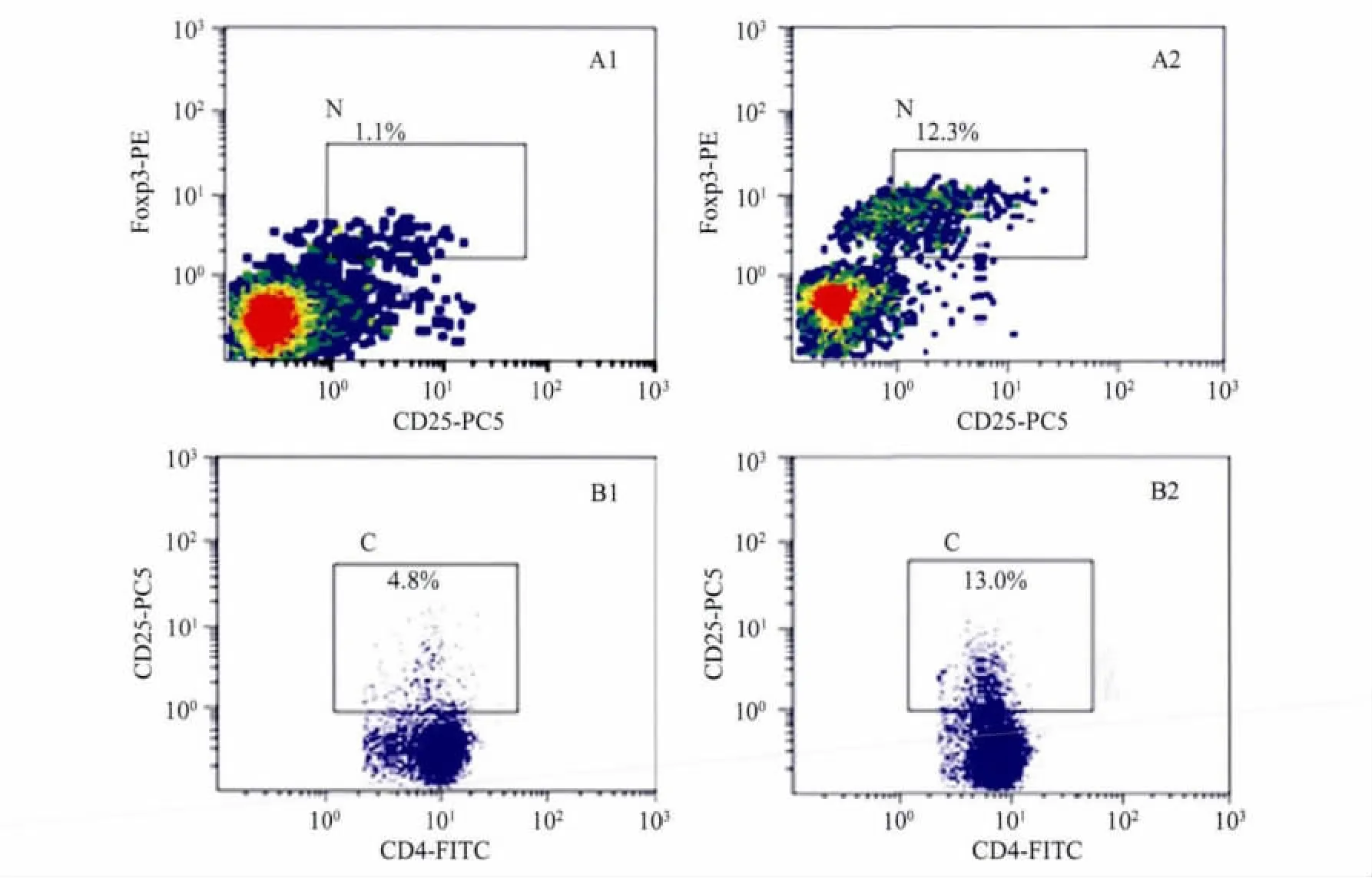
图2 肝纤维化组肝脏内浸润的Tregs上升Fig.2 The intrahepatic infiltrating Tregs increased in fibrosis group
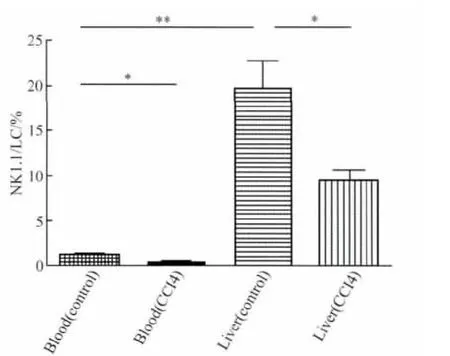
图3 外周血和肝脏内浸润的NK1.1+细胞的比较Fig.3 Comparisons of NK1.1+cells in peripheral blood and liver
结果还显示纤维化小鼠肝组织和血中的Tregs上升的同时,CD4+、CD4+/CD8+细胞呈现下降的趋势,差异无统计学意义,可能是由于例数过少。先前很多的文献[4]报道CD4+CD25+调节性 T细胞可以抑制CD4+、CD8+细胞的活化和增生,并且这种抑制作用是非特异的,因此推测肝纤维化时 CD4+、CD4+/CD8+T细胞比值的下降可能是由Tregs介导的。
目前已证实NK1.1是小鼠自然杀伤细胞(natural killer cell,NK)、NKT细胞特异性分子标志,本研究的流式结果显示NK1.1+细胞在小鼠肝组织中的表达显著高于其在血液中的表达。据文献[4,6]报道,与其他器官相比较,小鼠肝内的NKT细胞比例是最高的。笔者还发现肝纤维化时,伴随肝组织Tregs升高的同时,NK1.1+细胞下降。Hong 等[7]认为体外 Tregs可以直接抑制NKT细胞的功能,消除小鼠体内的Tregs可以增强NKT细胞的抗肿瘤活性;另外,Tregs对NK细胞具有抑制作用[8],其抑制作用包括降低NK细胞的细胞毒作用和下调NK细胞分泌IFN-γ的能力[9]。

表2 肝脏中和外周血中CD4+细胞与CD4+/CD8+比值的比较Tab.2 Comparisons of CD4+cells and ratios of CD4+cells to CD8+cells in peripheral blood and liver %
综上所述,本研究认为肝纤维化时机体处于免疫耐受状态,表现为Tregs的升高,且肝脏局部的升高更明显,NK1.1+细胞、CD4+细胞比例下降,并且这些细胞的下降可能受Tregs的调节。
[1]王慧,贾继东.慢性HBV感染自然史及治疗对转归的影响[J].首都医科大学学报,2010,31(5):582-585.
[2]Lu F M ,Zhuang H.Management of hepatitis B in China[J].Chin Med J(Engl),2009,122(1):3-4.
[3]Kvakan H,Kleinewietfeld M,Qadri F,et al.Regulatory T cells ameliorate angitensin Ⅱ-induced cardiac damage[J].Circulation,2009,119(22):2904-2912.
[4]Claassen M A,de Knegt R J,Tilanus H W,et al.Abundant number of regulatory T cells localize to the liver of chronic hepatitis C infected patients and limit the extent of fibrosis[J].J Hepatol,2010,52(3):315-321.
[5]Ghiringhelli F,Ménard C,Terme M,et al.CD4+CD25+regulatory T cells inhibit natural killer cell functions in a transforming growth factor-beta-dependent manner[J].J Exp Med,2005,202(8):1075-1085.
[6]Bendelac A,Savage P B,Teyton L.The biology of NKT cells[J].Annu Rev Immunol,2007,25:297-336.
[7]Hong H,Gu Y,Zhang H,et al.Depletion of CD4+CD25+regulatory T cells enhances natural killer T cell-mediated anti-tumour immunity in amurine mammary breast cancer model[J].Clin Exp Immunol,2010,159(1):93-99.
[8]Strauss L,Bergmann C,Szczepanski M,et al.A unique subset of CD4+CD25highFoxp3+T cells secreting interleukin-10 and transforming growth factor-beta 1 mediates suppression in the tumor microenvironment[J].Clin Cancer Res,2007,13(15 Pt 1):4345-4354.
[9]Zhou H,Chen L,You Y,et al.Foxp3-transduced polyclonal regulatory T cells suppress NK cell functions in a TGF-β dependent manner[J].Autoimmunity,2010,43(4):299-307.

