分子伴侣及信号肽对毕赤酵母中分泌蛋白表达水平的影响
杜济良,赵洪亮,薛冲,任敏,刘志敏
军事医学科学院 生物工程研究所,北京 100071
酵母是一种具有重要应用价值的低等真核表达系统,提高酵母表达外源蛋白水平的工艺方法研究一直备受关注。传统的高效表达思路主要是目的基因的高拷贝、强启动子转录目的基因,乃至分泌信号肽优化筛选等,对于这些提高表达的策略已有较深入的研究。但也有不少研究发现某些外源蛋白质的表达水平并非与基因拷贝数呈线性相关,相反地,当蛋白质表达水平达到一定程度后即开始下降,这提示还有其他因素制约蛋白表达水平[1]。之后,人们又发现当蛋白高水平表达时,易发生蛋白质在内质网中的错误折叠和积累,甚至出现沉淀,而错误折叠的蛋白被禁止转运出内质网,或被蛋白酶体降解清除。因此,有人推测新生肽链在细胞中的转运加工过程可能是限制外源蛋白表达水平阈值的又一个重要原因[2]。
分析以往外源蛋白质在酵母中高效表达的文献不难发现,大多数研究限定于某一种因素对蛋白质表达效率的影响,而忽视了蛋白质表达是一个多细胞定位的功能系统之间协调互动的有序整体,其中任何一种因素的影响都有一定限度,过分强调某种因素,如基因拷贝数、启动子效率等,对蛋白质表达影响的评价将是有失偏颇的。目前,对于如何提高外源蛋白在酵母中的表达水平,我们更应该关注不同因素之间协调配合的潜力。
分子伴侣是一大类在生物大分子折叠、组装及降解过程中起重要的协同作用,但自身并不发生任何变化的蛋白质分子[3]。不同细胞定位的分子伴侣具有不同的功能。细胞质中的分子伴侣的主要功能是协助蛋白质核糖体转运到内质网膜上,同时分子伴侣之间相互作用,促进错误折叠蛋白多聚体解聚和降解,维护细胞正常的生理代谢状态。内质网膜上的分子伴侣蛋白主要是介导蛋白质核糖体结合到到内质网膜上,并组成蛋白质多肽连转运通道,例如Sec61、Sec62和Sec63组成的转运通道能转运多肽进入内质网腔中[4-6]。内质网腔中的分子伴侣对保证蛋白质正确折叠具有重要作用。
近来研究发现,在鼠淋巴细胞瘤中辅助免疫球蛋白重链折叠的分子伴侣以复合物的形式存在,包括Bip、GRP94、PDI、ERdj3、Erp72、GRP170。各分子伴侣之间相互作用的同时,也与待折叠蛋白相互作用。其中Bip和GRP94含量丰富,进而形成以Bip为主的分子伴侣系统,另一个主要的分子伴侣系统是以钙联蛋白(calnexin)和钙网蛋白(calretieulin)为主的伴侣系统[7]。已有研究表明,将2种或2种以上分子伴侣同时转入菌体,多种分子伴侣协同作用,表达量的提高更明显[8]。
另外,酵母表达系统对于信号肽序列有着特殊的选择性,常用的信号肽有α交配因子(αMF)、酸性磷酸酯酶(PHO1)、菊粉酶信号肽序列(INU)、蔗糖酶(SUC2)等内源性信号肽,均可提高外源蛋白的表达效率;同时,翻译共转运信号肽和翻译后转运信号肽对外源蛋白的表达也有明显的影响。我们根据已知的影响外源蛋白质在毕赤酵母中表达的因素,选取分子伴侣和信号肽作为研究对象,以酵母内源性胞外-β-1,3-葡聚糖酶(EXG1)为报告蛋白,探讨了分子伴侣及其与分泌信号肽是否对蛋白质的表达有影响。
1 材料和方法
1 材料
巴斯德毕赤酵母宿主菌GS115是组氨酸营养缺陷型酵母,在BMGY培养基中于30℃摇床上培养并诱导表达,由本室保存;大肠杆菌DH5α感受态细胞购自全式金生物科技公司;大肠杆菌-酵母穿梭型质粒pPIC9购自Invitrogen公司,含有Amp抗性基因及AOX强启动子,可用甲醇诱导表达目的蛋白;pPBLArg-IX质粒由本室保存。
Pushion超保真DNA聚合酶、限制性内切酶、牛小肠碱性磷酸酶(ACIP)、T4DNA连接酶均购自NEB公司;EXG1酶促反应底物对硝苯基-B-D-吡喃半乳糖苷(pNPG)购自Sigma公司;In-Fusion Aavan⁃tage PCR Cloning试剂盒购自Clontech公司;电击转化仪购自BioRad公司;Unico UV-2100紫外分光光度计购自UNICO公司。PCR引物由上海生工公司合成
BMGY培养基(1 L):10 g酵母浸出物、20 g蛋白胨溶于700 mL水,121℃高压灭菌20 min,冷却至室温,加入100 mL 1 mol/L磷酸缓冲液(pH6.0)、100 mL 13.4%YNB、2 mL 0.02%生物素、100 mL 20%甘油,混匀备用。
MD培养基平板:20 g琼脂、160 mL无菌水,121℃高压灭菌20 min,冷却至室温,加入20 mL 10×YNB、20 mL 20%葡萄糖、40 μL 500×生物素,混匀备用。
1.2 报告蛋白EXG1不同类型信号肽基因的克隆及表达载体构建
根据PUBMED公布的EXG1序列及αMF、Bip的信号肽序列设计引物(表1),通过双酶切方式将携带不同信号肽的EXG1基因片段(图1)定向插入pPIC9质粒(图2)。
以毕赤巴斯德酵母GS115基因组中EXG1基因序列为模板,分别以引物F1和F8及引物F2和F8扩增EXG1(自身信号肽)和EXG1-αMF的基因片段。以GS115基因组中EXG1基因序列为模板,先以引物F4与F8进行PCR扩增,再以该PCR产物为模板,用引物F3与F8扩增EXG1-αPre片段。以GS115基因组中EXG1基因序列为模板,用引物F6与F8以引物F7与F8的PCR产物为模板进行PCR,再以此PCR产物为模板,用引物F5与F8进行PCR,扩增得到EXG1-Bip片段。
上述PCR反应体系为:10×Pyrobest缓冲液5 μL,2.5 μmol/L dNTP 4 μL,2 μL引物Fn(n=1~7),2 μL 引物 F8,1 μL 模板,0.3 μL Pyrobest聚合酶,36 μL H2O。PCR 反应条件均为:94℃变性 30 s,56℃退火30 s,72℃延伸(1 min/kb),25个循环。
PCR产物经1%琼脂糖凝胶电泳鉴定分析,片段大小与预期值一致,回收PCR产物,用相应的限制性内切酶酶切2 h,连接到pPIC9[BamHⅠ(或XhoⅠ)/EcoRⅠ]质粒上,转化大肠杆菌DH5α感受态细胞,筛选阳性单克隆,并送英骏公司测序,测定的基因序列与数据库序列一致,即该载体构建成功。

图1 几种不同类型信号肽结构示意图

图2 EXG1-pPIC9重组质粒示意图
1.3 分子伴侣质粒的构建
1.3.1 pBLArg-IX质粒启动子的重建 pBLArg-IX质粒原有的启动子是甲醇诱导型启动子AOX1,为充分表达分子伴侣,须用组成型启动子GAP替换AOX1。根据Invitrogen公司公布的GAP启动子(483 bp)序列,设计引物 5'端 F9(NheⅠ,CAGTGCT AGCTTTTTGTAGAAATGTCTTGGTGTC)和 3'端 F10(EcoRⅠ,AAGAATTCCGATCGATGGATCCTTAGTT GTTCAATTGATTGAAATA),在 F10引 物 中 引 入BamHⅠ酶切位点。
按照以下顺序加入PCR反应组分:10×Pyrobest缓冲液 5 μL,2.5 μmol/L dNTP 4 μL,2 μL 引物F8,2 μL引物 F9,1 μL GAP片段模板,0.3 μL Py⁃robest聚合酶。PCR反应条件:94℃变性30 s,56℃退火30 s,72℃延伸40 s,25个循环。PCR产物经1%琼脂糖凝胶电泳鉴定分析,片段大小与预期值基本一致,回收PCR产物,用NheⅠ-HF和EcoRⅠ-HF酶切2 h,试剂盒回收,连接至pBLArg-IX(NheⅠ-HF/EcoRⅠ)质粒,转化大肠杆菌DH5α感受态细胞,筛选阳性单克隆,并送英骏公司测序,测定的基因序列与基因数据库序列一致,即为构建成功。
1.3.2 分子伴侣及其组合质粒的构建 Sec61α和Sec61β、Ydj1、Ssa1、Hsp104、Bip、EroI、PDI均 以GS115基因组为模板,HacI以酿酒酵母基因组为模板。设计相关引物。
按照以下顺序加入PCR反应组分:10×Pyrobest缓冲液 5 μL,2.5 μmol/L dNTP 4 μL,2μL 5'端引物F,2 μL 3'端引物F9,1 μL模板,0.3 μL Pyrobest聚合酶。PCR反应条件:94℃变性30 s,56℃退火30 s,72℃延伸(1 min/kb),25个循环。PCR产物经1%琼脂糖凝胶电泳鉴定分析,片段大小与预期值基本一致,回收PCR产物,用BamHⅠ-HF和EcoRⅠ-HF酶切2 h,试剂盒回收,连接pBLArg-IX(BamHⅠ-HF/EcoRⅠ)质粒,转化大肠杆菌DH5α感受态细胞,筛选阳性单克隆,并送英骏公司测序,测定的基因序列与基因数据库序列一致,即为构建成功。

表1 EXG1的引物序列及其酶切位点
因Hsp104序列中存在一个BamHⅠ和EcoRⅠ酶切位点,所以采用同源融合法构建质粒。引物中含有与pBLArg-IX序列相同的同源臂5'端引物(AATTGAACAACTAAGAAACGATGGAAGAAACAC AGTTTACAGATAGAGC)和 3'端引物(ACAGATTC CGCTTAATTAGTCGTAAAGTGGTGCTTGGCATC)。Hsp104-pBLArg-IX质粒构建方法:5×HF缓冲液10 μL,10 μmol/L dNTP 1 μL,2 μL 5'端引物,2 μL 3'端引物,1 μL GS115基因组模板,0.5 μL Pushion超保真DNA聚合酶,34 μL H2O。PCR反应条件:98℃变性 10 s,60℃退火 30 s,72℃延伸 40 s,25 个循环。PCR产物经1%琼脂糖凝胶电泳鉴定分析,片段大小与预期值基本一致,回收PCR产物。同源融合体系(10 μL):Hsp104 4 μL,pBLArg-IX(BamHⅠ/EcoRⅠ)1 μL,5×缓冲液 2 μL,In-Fusion En⁃zyme 0.5 μL,H2O 2 μL。37℃水浴 15 min,52℃水浴15 min,加入40 μL TE混匀,然后转化大肠杆菌DH5α感受态细胞,筛选阳性单克隆,并送英骏公司测序,测定的基因序列与基因数据库序列一致,即为构建成功。
分子伴侣组合表达质粒构建(以Ydj1和Ssa1为例):用NheⅠ/SpeⅠ酶切Ydj1-pBLArg-IX,取GAP+Ydj1+3'AOX表达框片段连接到经NheⅠ酶切的Ssa1-pBLArg-IX中,即为Ydj1/Ssa1-pBLArg-IX质粒。同理,将Ydj1、Ssa1表达框插入Hsp104-pBLArg-IX,得到Ydj1/Hsp104-pBLArg-IX和Ssa1/Hsp104-pBLArg-IX;将 Bip、EroI、PDI表达框插入HacI-pBLArg-IX,得 到 Bip/HacI-pBLArg-IX、EroI/HacI-pBLArg-IX、PDI/HacI-pBLArg-IX。
1.4 酵母工程菌的筛选和目的蛋白质的诱导表达
将EXG1/αMF-pPIC9、EXG1/αpre-pPIC9、EXG1/Bip-pPIC9、EXG1-pPIC9 质粒用 SalⅠ线性化,电击转化毕赤酵母GS115,在MD培养基平板上28℃培养48 h。挑取5支单克隆,在BMGY培养基中于28℃、200 r/min培养24 h,然后每12 h加入0.5%甲醇诱导表达,至48 h时,取菌液上清测定EXG1酶活,筛选阳性单克隆。取1 mL菌液,5000 r/min离心30 s,取上清500 μL加到已在37℃孵育5 min的pNPG(10 mmol/L,0.5 mL)-醋酸缓冲液(1 mL,pH5.1)混合液中,再于37℃孵育30 min,然后加入2 mL 0.2 mol/L Na2CO3终止酶促反应,当溶液颜色变为亮黄色即为EXG1表达的阳性菌。
挑取阳性单克隆菌落至5 mL YPD培养基,于28℃摇床培养24 h,测定菌液D600nm值,然后接种适量菌液到BMGY培养基,终体积为40 mL,D600nm约为1.0,每隔12 h加入0.5%甲醇诱导EXG1表达,并取菌液上清测定EXG1酶活性。
1.5 分子伴侣与EXG1的共表达诱导培养及酶活测定
将报告蛋白表达质粒线性化,并电击转化毕赤酵母GS200(His/Arg),于MD(+Arg)培养基上培养,并筛选阳性单克隆菌落。方法同报告蛋白在毕赤酵母GS115中的方法。
将分子伴侣质粒线性化,电击转化GS200(His/Arg)报告蛋白表达阳性菌,于MD培养基上培养,然后在BMGY培养基中用甲醇诱导EXG1表达。方法同报告蛋白在毕赤酵母GS115中的方法。
将0.5 mL 10 mmol/L pNPG与1.0 mL(pH5.1)醋酸缓冲液混合,37℃温育5 min;取24、36、48 h时的菌液各1 mL,5000 r/min离心30 s,取上清500 μL加入pNPG中,37℃温育30 min,再加入2 mL 0.2 mol/L Na2CO3终止酶促反应,测定酶促反应溶液的D400nm值。
2 结果
2.1 报告蛋白基因与分子伴侣基因的克隆
自身信号肽报告蛋白EXG1基因的PCR扩增产物鉴定结果见图3,相应分子伴侣基因的PCR扩增产物鉴定结果见图4。
2.2 细胞质分子伴侣对EXG1表达水平的影响
细胞分子伴侣Ydj1、Ssa1、Hsp104及其组合Ydj1/Ssa1、Ydj1/Hsp104、Ssa1/Hsp104对 EXG1-αPre及自身信号肽EXG1的表达水平均无影响。同时,它们对EXG1-αMF表达水平的提高幅度仅为10%~20%,影响不明显。Ydj1使EXG1-Bip表达水平提高了10%,其他分子伴侣及其组合对EXG1-Bip表达水平均无显著性影响,相关结果没有显示。
2.3 内质网膜分子伴侣对EXG1表达水平的影响
内质网分子伴侣Sec61α和Sec61β对各种信号肽介导的EXG1的表达水平影响较大,其中对EXG1-αMF、EXG1-αPre、EXG1-Bip表达水平的提升幅度均为20%~30%。另外,Sec61α和Sec61β使自身信号肽EXG1的表达水平分别提高了38.9%和32.4%,提高幅度略大于它们对EXG1-αMF、EXG1-αPre及EXG1-Bip表达水平的影响。而且,在提高 EXG1-αMF、EXG1-αPre及 EXG1-Bip表达的过程中,Sec61β的作用略大于Sec61α,见图5。

图3 凝胶电泳鉴定EXG1基因的PCR产物
2.4 内质网腔分子伴侣对EXG1表达水平的影响
内质网腔分子伴侣对EXG1-αMF、EXG1-αPre、EXG1-Bip和EXG1的表达水平有重要影响,而且不同分子伴侣的影响不尽相同,见表2。可以看出,EroI/HacI组合使除自身信号肽EXG1外的其他3种信号肽介导的EXG1的表达水平均有不同程度的提高。虽然EroI/HacI组合使EXG1-αPre的表达提高了3.8倍,高于EXG1-αMF表达水平提高的2.65倍,但提高后的表达水平之间基本相当,即达到EXG1的最高表达水平。Bip-HacI、EroI/HacI和PDI/HacI等3种组合使EXG1-Bip的表达水平均有小幅提高,其中EroI/HacI的影响略大于其他2种组合。结果参见图6。

图4 凝胶电泳鉴定分子伴侣及HacI基因片段的PCR产物
3 讨论
3.1 酵母表达系统优化的方向
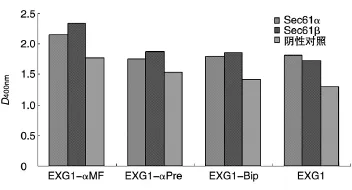
图5 Sec61α和Sec61β对EXG1-αMF、EXG1-αPre、EXG1-Bip和EXG1表达水平的影响

图6 分子伴侣Bip、EroI、PDI与HacI组合对各信号肽的EXG1表达水平的影响

表2 内质网腔分子伴侣Bip、EroI、PDI与HacI的组合对各种信号肽EXG1表达水平的影响
外源蛋白质在酵母细胞的分泌表达过程中,内质网腔中的加工是非常重要的环节,当外源蛋白质的合成水平超过了正常状态下内质网的加工能力,辅助蛋白质折叠的分子伴侣就相对不足,使得蛋白质在内质网腔中产生大量未折叠蛋白及错误折叠,进而形成蛋白质多聚体,从而对酵母细胞正常生理功能及代谢产生压力。此时,该压力将应急激活细胞内的折叠蛋白反应(unfolded protein response,UPR),然后,细胞即大量合成蛋白质折叠相关分子伴侣,以帮助内质网腔中的蛋白质进行去错误折叠、解聚,最终产生具有正确构象的蛋白质[9]。值得注意的是,虽然错误折叠的蛋白诱导UPR发生,但却不是最直接的诱导因素,根本的原因是错误折叠蛋白结合大量游离状态的分子伴侣,致使游离态分子伴侣的浓度急剧下降,才激发了UPR的发生[10]。HacI是UPR过程中重要的信号传递分子[11],然而严格地讲,HacI并不是真正意义上的分子伴侣。但是,HacI的mRNA在UPR情况下重新编辑,能促进UPR相关蛋白质及分子伴侣的高水平表达,以帮助错误折叠蛋白的解聚、去错误折叠及再折叠,最终间接地提高了蛋白质的表达水平。鉴于此,在本实验中,我们将HacI与内质网腔中的分子伴侣组合后进行研究。将HacI和分子伴侣EroI共表达时,高水平的HacI提高了折叠蛋白质相关基因的表达水平,同时EroI又激活了这些相关基因中的分子伴侣PDI的活性,而PDI能够防止新生多肽多聚体产生,而且能使错误折叠的蛋白质解聚,重新正确折叠装配。在本实验中,我们推测由于EXG1-Bip的表达水平相对较低,不会在内质网腔中产生严重的错误折叠甚至聚集现象,进而不能完全激活UPR,所以EroI-HacI组合对EXG1-Bip的作用相对不太明显。而EXG1-αMF和EXG1-αPre的高表达在内质网腔中产生大量多聚体,激活了UPR,最大程度地发挥了EroI和PDI的作用,进而大幅度提高了EXG1的表达水平。
在以往的研究中,更多关注的是某一种分子伴侣在蛋白质高水平表达过程中的作用,而本研究结果提示,分子伴侣是一个相互影响、相互作用的有机整体,如EroI与PDI之间存在的相互作用,应该根据目的蛋白的结构特征,选择合适的分子伴侣优化表达组合。如报告蛋白EXG1,相对于具有二硫键功能的Bip而言,当EXG1高水平表达的负面影响因素是多聚体时,那么PDI对EXG1的作用更为重要和明显。因此,针对分子伴侣对酵母表达系统进行优化,应该根据目的蛋白的分子特征而区别对待,构建相对应的表达工程菌,而不是寄希望于构建出一种“万能”的表达系统。
3.2 分子伴侣与信号肽对外源蛋白表达水平的影响
外源蛋白质在酵母细胞中的合成分泌过程涉及到新生多肽-核糖体复合体在细胞质中的转运,以及新生肽穿过内质网膜,在内质网腔中折叠加工修饰,再转运到胞外。在本项实验中,增加细胞质分子伴侣的表达水平未能明显提高4种信号肽介导的EXG1表达水平,同时增加内质网膜上的转运通道Sec61的数量也未能提高EXG1的表达水平,这提示多肽-核糖体复合体从胞质到内质网膜的转运过程中,这些分子伴侣与信号肽之间没有明显的相互作用。虽然内质网腔中分子伴侣Bip、EroI、PDI与HacI提高了不同信号肽的EXG1表达水平,但这种效应不是由于分子伴侣作用于αMF、αPre和Bip信号肽,而是分子伴侣作用于内质网腔中新生多肽的加工折叠的结果。鉴于此,我们认为在EXG1新生肽的合成分泌过程中,内质网腔中的分子伴侣对于该新生肽的作用不受信号肽部分的影响。
内质网腔是蛋白质生物合成加工的重要细胞器,大量研究已证实其中的分子伴侣的作用是防止蛋白质在折叠过程中由于疏水区域的暴露而形成非共价的聚合体,以及通过分子间二硫键形成共价聚合体,并且能够解聚错误折叠的蛋白质多聚体。例如,PDI加快了正确二硫键的形成速率,从而可提高蛋白质的正确折叠率和比活性[12];而Bip能够结合到转运到ER内的新生多肽并帮助其正确折叠,同时还能将错误折叠的蛋白质逆向转运出ER[10]。但是,目前有关分子伴侣之间的相互作用及它们可能形成的功能系统的作用机制尚不明了。因此,考虑到酵母表达系统被广泛应用的现实,分子伴侣的系统性研究将极具潜在的应用价值和商业价值。
综上,EXG1在毕赤酵母细胞中的表达,主要受到内质网腔分子伴侣的影响,是EXG1合成过程的限速步骤之一。通过提高内质网腔中蛋白质折叠相关分子伴侣的表达水平,能够明显提高EXG1的表达水平。特别是通过将蛋白质多聚体及错误折叠识别信号分子HacI和分子伴侣EroI共表达,能够显著提高报告蛋白EXG1的表达量。
[1]Hohenblum H,Gasser B,Maurer M,et al.Effects of gene dosage,promoters,and substrates on unfolded protein stress of recombinant Pichia pastoris[J].Biotechnol Bioeng,2004,85(4):367-375.
[2]Zhang W,Zhao H L,Xue C,et al.Enhanced secretion of heterologous proteins in Pichia pastoris following overexpres⁃sion of Saccharomyces cerevisiae chaperone proteins[J].Bio⁃technol Prog,2006,22(4):1090-1095.
[3]Nie Zhong-Qing,Wu Yong-Gang,Meng Jian-Zhou.The func⁃tion and application of molecular chaperone[J].Chinese Bull Life Sci,2006,18(1):84-89.
[4]Kelkar A,Dobberstein B.Sec61β,a subunit of the Sec61 pro⁃tein translocation channel at the endoplasmic reticulum,is in⁃volved in the transport of Gurken to the plasma membrane[J].BMC Cell Biol,2009,10:(11):1-14.
[5]Stockton J D,Merkert M C,Kellaris K V.A complex of chaperones and disulfide isomerases occludes the cytosolic face of the translocation protein Sec61p and affects transloca⁃tion ofthe prion protein[J].Biochemistry,2003,42:12821-12834.
[6]Sáncheza R,Saraleguia A,Olivos-Garcíab A.Entamoeba histo⁃lytica:intracellular distribution of the sec61 subunit of the se⁃cretory pathway and down-regulation by antisense peptide nu⁃cleic acids[J].Exp Parasitol,2005,109(4):241-251.
[7]Meunier L,Usherwood Y K,Chung K T,et a1.A subset of chaperones and folding enzymes from muhiprotein complexes in endoplasmic reticulum to bind nascent proteins[J].Mol Bi⁃ol Cell,2002,13(12):4456-4469.
[8]Smith J D,Tang B C,Robinson A S.Protein disulfide isomer⁃ase,but not binding protein,overexpression enhances secre⁃tion of a non-disulfide-bonded protein in yeast[J].Biotechnol Bioeng,2004,85(3):340-350.
[9]Bernales S,Papa F R,Walter P.Intracellular signaling by the unfolded protein response[J].Annu Rev Cell Dev Biol,2006,22:487-508.
[10]Gething M J.Role and regulation of the ER chaperone Bip[J].Semin Cell Dev Biol,1999,10:465-472.
[11]Guerfal M,Ryckaert S,Jacobs P P,et al.The HAC1 gene from pichia pastoris:characterization and effect of its overex⁃pression on the production of secreted,surface displayed and membrane proteins[J].MicrobialCellFactories,2010,9(49):1-12.
[12]徐明波,孟文华,马贤凯.PDI,PPI和伴侣分子催化重组人IL-2和GM-CSF的再折叠[J].中国科学,1994,24(7):717-723.

