牦牛肉组织蛋白酶L 提取工艺的优化*
王文婷,刘昕,余群力,田甲春,师希雄,李儒仁
(甘肃农业大学食品科学与工程学院,甘肃 兰州,730070)
牦牛(Bos grunniens),是我国青藏高原的珍稀畜种。天然的牧草高原使其肉质细嫩,具有高蛋白、低脂肪等优点,是消费者青睐的绿色食品[1-2]。嫩度是评判肉质优劣最常用的指标[3]。肉类成熟过程中嫩度的增加主要是由内源蛋白酶水解肌原纤维造成的[4-5]。目前研究发现,组织蛋白酶(Cathepsin)是主要的蛋白水解系统之一,在肉类成熟后期发挥作用[6-7]。组织蛋白酶位于溶酶体内,L、B、D、H 型与肌肉成熟有密切关系[8-9],尤以L 型活性最强,可专一性地水解荧光合成底物Z-Phe-Arg-MCA[10]。
目前,已有文献报道从小鼠、鲤鱼等中提取了组织蛋白酶B、L[11-12],提取工艺的优化多数直接采用响应面设计和分析法,事实上这种方法在确定响应面中心点之前并未进行全面的筛选,仅凭单因素试验或文献参考值,存在一定局限性,会降低试验的准确性和模型预测实际值的精确性。本试验以牦牛肉为研究对象,首次将一套完整的响应面法[13]:Plackett-Burman 试验、最陡爬坡试验、中心组合设计及响应面分析法应用于提取工艺条件的全面优选。关于牦牛肉中组织蛋白酶L 提取工艺如此系统性的优化研究国内外尚未见报道,因此为进一步分离纯化组织蛋白酶L 奠定了基础。
1 材料和方法
1.1 材料与仪器
酰胺甲基香豆素(AMC)、苄氧羰基-苯丙氨酰-精氨酰-酰胺-甲基香豆素(Z-Phe-Arg-AMC)、苄氧羰基-精氨酰-精氨酰-酰胺-甲基香豆素(Z-Arg-Arg-AMC)、精氨酰-酰胺-甲基香豆素(L-Arg-AMC)、苯甲基磺酰氟(PMSF)、半胱氨酸(L-Cys)、β-巯基乙醇(β-ME),购于美国Sigma 公司;乙二醇-双-(2-氨基乙基)四乙酸(EGTA)、聚环氧乙烷23 月桂醚(Brij35),购于美国Amresco 公司;乙二胺四乙酸(EDTA)、(NH4)2SO4、乙酸钠、氯乙酸钠等均为国产分析纯。
RF5301-PC 荧光分光光度计,日本岛津公司;XiangYi H-1850R 高速离心机,湘仪离心机仪器有限公司;756P 紫外可见分光光度计,上海光谱仪器有限公司;DS-1 型组织捣碎机,金坛市金南仪器厂;HHS型电热恒温水浴锅、AL104 型电子天平,上海佑科仪器仪表有限公司。
1.2 试验方法
1.2.1 牦牛肉组织蛋白酶L 粗酶液的提取
取牦牛背最长肌肉样100 g,去除脂肪、结缔组织,加入一定体积比(肉样质量:浸提缓冲液体积)、经优化的浸提缓冲液(一定浓度、一定pH 值,含一定浓度L-Cys、一定浓度PMSF)进行匀浆,冷冻离心(10 000 ×g,30 min,4℃),所得沉淀用含0.5 mol/L NaCl 的浸提缓冲液反复溶解离心2 次,混合所有上清液用一定饱和度的(NH4)2SO4沉淀[14],于4℃充分盐析后离心,所得沉淀用含0.2 mol/L NaCl 的浸提缓冲液溶解并充分透析,并用截留分子量为10 ku 的超滤管将透析液浓缩到适当体积,即得组织蛋白酶L 酶液。
1.2.2 牦牛肉组织蛋白酶L 浓度的测定
采用考马斯亮蓝法,以牛血清蛋白为标准品。取粗酶液10 μL,加水至1 mL,加入5 mL 考马斯亮蓝,震荡摇匀5 min 后用紫外分光光度计测595 nm 处吸光值。
1.2.3 牦牛肉组织蛋白酶L 活性的测定
参照Futoshi Aranishi[15]的方法并予以改进。测定时反应体系为980 μL 0.1% Brij35,400 μL 0.4 mol/L 乙酸钠缓冲液(含5 mmol/L EDTA,pH5.5),200 μL 10 mmol/L L-Cys 和200 μL 酶液。混合液于40℃水浴2 min,然后加入400 μL 25 μmol/L 的底物Z-Phe-Arg-AMC,在相同的温度下反应30 min 后,加入3 mL 终止液(0.1 mol/L 乙酸钠包含0.1 mol/L 氯乙酸钠,pH4.3)终止反应。利用荧光分光光度计测定其荧光强度,所用的激发波长(Excitation)为380 nm,发射波长(Emission)为460 nm。
1 个酶活单位(U):在最适反应温度(40℃)及反应pH(5.5)条件下,每分钟内催化1 μmol AMC 转化为产物所需的酶量(1 μmol AMC/min)。
酶比活力单位:U/mg(测定时所用的蛋白含量)
1.3 试验设计
1.3.1 Plackett-Burman 试验设计
在7 个因素中筛选主效因素,每个因素选取高(+1)低(-1)两个水平。试验因素水平设计见表1(N=12)。

表1 Plackett-Burman 试验因素水平Table 1 Factors and levels of Plackett-Burman
1.3.2 最陡爬坡实验设计( steepest ascent design)
根据Plackett-Burman 试验结果设计显著因素的最陡爬坡路径,爬坡方向根据实验值变化的梯度方向确定,变化步长根据各因素效应值的大小来确定[16]。
1.3.3 响应面分析法( Response surface analysis)
响应面分析法,是一种试验条件寻优的方法。与正交试验相比,优势在于可以连续地对试验的各个水平进行分析,而正交试验只能对孤立点进行分析[17]。
1.4 SDS-PAGE 电泳对牦牛肉组织蛋白酶L 的鉴定
对提取的牦牛肉组织蛋白酶L 进行SDS-PAGE电泳[18]分析。考马氏亮蓝染色,脱色至条带清晰可见为止。凝胶照相,7%的冰醋酸保存。
2 结果与分析
2.1 Plackett-Burman 试验设计及结果
运用Minitab16 进行分析,试验结果及主效应分析结果分别见表2、表3。
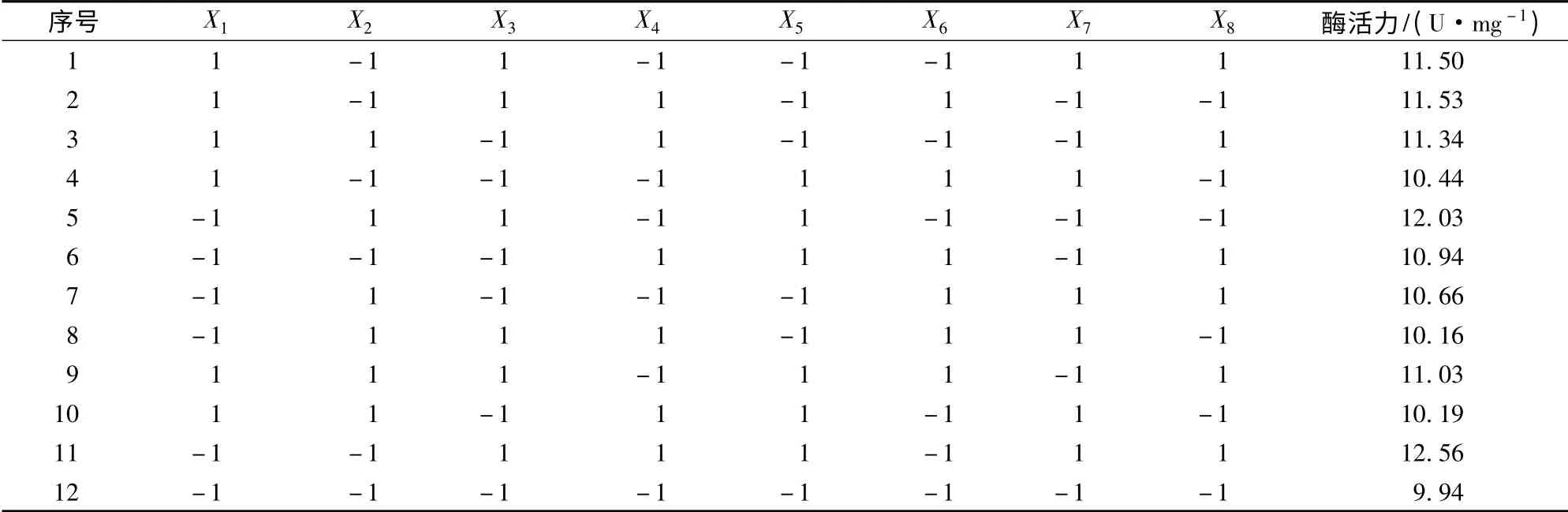
表2 Plackett-Burman 试验设计及结果Table 2 The experiment design and results of Plackett-Burman
由表3 知,对牦牛肉组织蛋白酶L 酶活力有显著影响的因素有X1、X2及X5,其中,浸提缓冲液pH 值影响极显著(P<0.01),且这3 个因素对酶活力呈现出正效应。其他因素在95%的水平上不显著。因此选择浸提缓冲液pH 值、L-Cys 及(NH4)2SO4饱和度作为最陡爬坡实验的研究对象。
2.2 最陡爬坡实验设计及结果
根据2.1 筛出的3 个显著因素及其效应,设定最陡爬坡实验步长及爬坡方向。试验设计及结果见表4。

表3 Plackett-Burman 试验各因素主效应分析(α=0.05)Table 3 Analysis of the main effect of each factor for Plackett-Burman(α=0.05)

表4 最陡爬坡试验设计及结果Table 4 The experiment design and results of steepest ascent
由表4 知,第3 组试验提取的牦牛肉组织蛋白酶L 的酶活力最高,即浸提缓冲液pH 值为5.0、L-Cys浓度为7.0 mmol/L、(NH4)2SO4饱和度为80%时,酶活力最高为13.38 U/mg。因此以试验3 的条件作为响应面实验因素水平的中心点。
2.3 响应面法优化牦牛肉组织蛋白酶L 提取工艺
2.3.1 回归方程及方差分析
在2.1 和2.2 基础之上,以组织蛋白酶L 的酶活力为响应值,运用Design expert 8.0 进行3 因素3 水平响应面中心组合试验设计。试验因素水平设计及结果分别见表5 和表6。
表5 中心组合试验设计因素水平Table 5 Factors and levels of Central composite design
采用Design expert 8.0 对试验结果进行回归分析,方差分析见表7。所得多项式回归模型为:Y=13.82+0.39A-0.30B+0.32C-0.076AB-0.63AC+0.64BC-0.47A2-0.54B2-0.65C2。该模型在α =0.01 的水平上高度显著,失拟项不显著(P>0.05)。复相关系数R2=91.03%,与实际值的拟合度很好。根据回归方程各个系数绝对值的大小可判断3 个因素对牦牛肉组织蛋白酶L 酶活力的影响顺序为浸提缓冲液pH 值>(NH4)2SO4饱和度>L-Cys。

表6 中心组合试验设计及结果Table 6 The experiment design and results of Central composite design

表7 中心组合试验回归模型方差分析Table 7 Variance analysis for regression model of Central composite design
2.3.2 响应面分析及工艺参数的确定
根据回归方程作3 因素两两交互作用的响应面图和等高线图。从图1 ~图3 可以看出,浸提缓冲液pH 值和(NH4)2SO4饱和度、L-Cys 和(NH4)2SO4饱和度的交互作用显著,浸提缓冲液pH 值和L-Cys 交互作用不显著。
对回归模型进行数学分析,得出牦牛肉组织蛋白酶L 最佳提取工艺参数为:浸提缓冲液pH 值5.68、L-Cys 浓度为6.48 mmol/L、(NH4)2SO4饱和度为76.63%。在此最优工艺条件下,牦牛肉组织蛋白酶L 的提取率为46.2%,酶活力为13.98 Unit/mg。

图1 A(浸提缓冲液pH)与B(L-Cys)交互响应面图(a)及其等高线图(b)Fig.1 A(pH of extraction buffer solution)and B(L-Cys)interaction response surface and contour line graph
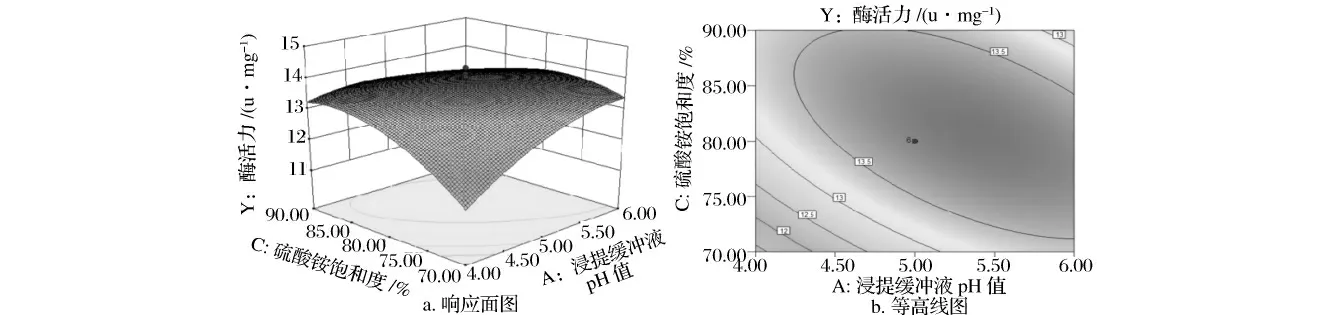
图2 A(浸提缓冲液pH)与C(硫酸铵饱和度)交互响应面图(a)及其等高线图(b)Fig.2 A(pH of extraction buffer solution)and C (ammonium sulfate saturation)interaction response surface and contour line graph
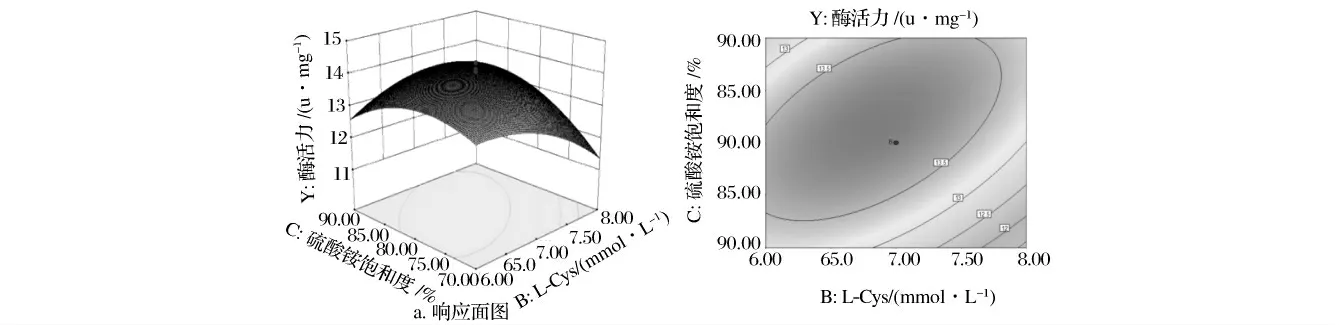
图3 B(L-Cys)与C(硫酸铵饱和度)交互响应面图(a)及其等高线图(b)Fig.3 B(L-Cys)and C(ammonium sulfate saturation)interaction response surface and contour line graph
2.3.3 验证性试验
为进一步验证模型的可靠性,在最优工艺条件下进行提取,实得牦牛肉组织蛋白酶L 酶活力为13.85 U/mg,与理论值相比,相对误差为0.94%。因此,该模型合理有效,得到的最优提取工艺参数真实可靠。
2.4 SDS-PAGE 电泳对牦牛肉组织蛋白酶L 的鉴定
SDS-PAGE 电泳图谱可知,可辨别的蛋白带很多,说明粗酶液中蛋白种类繁多。文献报道的组织蛋白酶L 分子量通常在23 ku 到30 ku 之间[19-20]。浓缩后其中一条主带非常明显,分子质量约为35 ku,即为分离提取的牦牛肉组织蛋白酶L。其分子质量与已有报道基本一致,差异可能是提取组织蛋白酶L的原料不同造成的。因此试验所筛选的工艺参数可以有效提取牦牛肉组织蛋白酶L,获得的目的酶的浓度和活力较高。
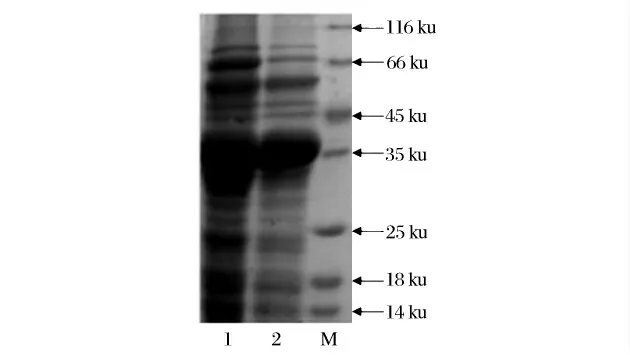
图4 牦牛肉组织蛋白酶L 分离过程的SDS-PAGE 图谱Fig.4 SDS-PAGE of Cathepsin L from yak meat in the extraction processing
3 结论
(1)通过对Plackett-Burman 试验回归系数显著性分析,发现对牦牛肉组织蛋白酶L 酶活力影响显著的因素有浸提缓冲液pH 值、L-Cys 和(NH4)2SO4饱和度,而乙酸钠缓冲液、H3PO4缓冲液、β-ME、PMSF、肉样与缓冲液体积比在试验设定的范围内影响不显著。
(2)通过对拟合二次方程中回归系数的显著性检验分析,发现显著影响牦牛肉组织蛋白酶L 酶活力的3 个主要因素依次为:浸提缓冲液pH 值>(NH4)2SO4饱和度>L-Cys。
(3)通过中心组合设计及响应面分析获得的最佳工艺参数为:浸提缓冲液pH 值5.68、L-Cys 浓度为6.48 mmol/L、(NH4)2SO4饱和度为76.63%。在最优工艺条件下,牦牛肉组织蛋白酶L 的提取率为46.2%,酶活力为13.98 U/mg。实测值为13.85 U/mg,相对误差为0.94%,说明回归模型切实可行。
(4)试验在Plackett-Burman 试验、最陡爬坡试验基础上,快速有效找出响应面试验设计的中心点,提高了中心组合设计及响应面分析结果的准确性。通过SDS-PAGE 试验进一步证实,所采用的这一整套系统化的优选方法为牦牛肉组织蛋白酶L 的提取工艺提供了拟合度很高的模型,更准确地代替真实试验点对酶活力进行预测,具有一定的实用性。
[1] Lin Y Q,Wang G S,Feng J,et al. Comparison of enzyme activities and gene expression profiling between yak and bovine skeletal muscles[J]. Livestock Science,2011,135(1):93 -97.
[2] 王喜群,王明金. 牦牛肉营养成分分析与研究[J]. 肉类研究,2006(5):24 -26.
[3] 陈阳楼,朱学伸,杨姗姗. 影响肉类嫩度的因素及其嫩化方法[J]. 肉类工业,2012,376(8):48 -50.
[4] Vito Turk,Veronika Stoka,Olga Vasiljeva,et al. Cysteine cathepsins:from structure,function and regulation to new frontiers[J]. Biochimica et Biophysica Acta,2012,1824(1):68 -88.
[5] 陈琳,徐幸莲,周光宏. 应用于肉品嫩化的组织蛋白酶的研究进展[J]. 食品科学,2009,30(1):271 -274.
[6] Cheret R,Delbarre-Ladrat C,Lamballerie-Anton M,et al.Calpain and cathepsin activities in post mortem fish and meat muscles[J]. Food Chemistry,2007,101(4):1 474-1 479.
[7] 黄明,周光宏,徐幸莲,等. 牛肉宰后嫩化机制的研究[J]. 农业工程学报,2004,20(1):198 -202.
[8] Thomas A R,Gondoza H,Hoffman L C,et al. The roles of the proteasome,and cathepsin B,L,H and D,in ostrich meat tenderisation[J]. Meat Science,2004,67(1):113 -120.
[9] 李永鹏,余群力. 肉类成熟嫩化过程中的蛋白酶系及其作用[J]. 肉类研究2010,(5):8 -12.
[10] Mu Xue,Han Jianzhong. On cathepsin in skeletal muscle[J].Meat Research,2010(5):13 -17.
[11] 黄明. 牛肉成熟机制及食用品质研究[D]. 南京:南京农业大学,2003.
[12] 于蕾,朱蓓薇,孙黎明,等. 海参肠道组织蛋白酶B 粗酶提取条件的优化[J]. 大连工业大学学报,2010,29(6):409 -412.
[13] 侯鲁娜,陈学云,聂小华,等. 鲤鱼组织蛋白酶L 活性的影响因素研究[J]. 食品工业科技,2010,31(11):75 -77.
[14] 董训江,钟婵,蔡秋凤,等. 杂色鲍组织蛋白酶L 的分离纯化与性质研究[J]. 食品工业科技,2011(12):247-250.
[15] Aranishi F,Ogata H,Hara K,et al. Purification and Characterization of Cathepsin L from Hepatopancreas of Carp Cyprinus carpio[J]. Comp Biochem PhysiolBBiochem Mol Biol. 1997,118(3):531 -537.
[16] Yan Wu,Steve W Cui,Jian Tang,et al. Optimization of extraction process of crude polysaccharides from boatfruited sterculia seeds by response surface methodology[J]. Food Chemistry,2007,105(4):1 599 -1 605.
[17] Zhi Wenbo,Song Jiangnan,Ouyang Fan,et al. Application of response surface methodology to the modeling ofαamylase purification by aqueous two-phase systems[J].Journal of Biotechnology,2008,118(2):157 -165.
[18] 李树红. 鲢鱼背肌组织蛋白酶B、L 的纯化鉴定及水解肌球蛋白的研究[D]. 北京:中国农业大学,2004.
[19] Wonnop Visessanguan,Soottawat Benjakul,Haejung An.Purification and characterization of cathepsin L in arrowtooth flounder (Atheresthes stomias)muscle[J]. Comparative Biochemistry and Physiology,2003,Part B 134:477 -487.
[20] Li S H,Zhou X Q,Zhang N,et al. Purification and characterisation of cathepsin L2 from dorsal muscle of silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry,2008,111(4):879 -886.

