连翘苷对铜绿假单胞菌黏附功能及生物被膜形成能力的影响
王业梅,程惠娟
(安徽中医学院中西医结合临床学院,安徽合肥 230038)
铜绿假单胞菌(Pseudomonas aeruginosa)是常见的院内感染的条件致病菌,被世界卫生组织公认为医院内感染的主要病原菌之一,该菌在感染机体过程中常以生物被膜方式生长,以此来阻隔抗生素的攻击[1],一旦形成生物被膜,细菌将具有极强的抗生素耐药性和逃避机体免疫系统攻击的能力[2]。鉴于此,目前国内外很多学者以生物被膜为研究对象进行新型抗菌药物的研究。课题组前期研究证实穿心莲内酯、黄芩苷、没食子酸、鱼腥草素钠等中药有效成分可抑制某些细菌生物被膜形成,并对已形成的生物被膜有明显的破坏作用[3-5]。但中药连翘的有效成分连翘苷对铜绿假单胞菌生物被膜是否能发挥作用尚未见报道,本研究采用体外建立生物被膜模型,观察连翘苷对铜绿假单胞菌生物被膜的作用,为中药治疗铜绿假单胞菌生物被膜相关感染提供依据。
1 材料
1.1 药物、菌株与培养基 连翘苷对照品(批号ZB2012060523,纯度 98%)、红霉素品(批号 30307-200716,纯度93.5%)、铜绿假单胞菌标准菌株ATcc27853均购于中国药品生物制品检定所,PBS(实验室自配),胰蛋白胨大豆肉汤(TSB:青岛高科海博生物技术有限公司),结晶紫(天津市光复精细化工研究所)。
1.2 试剂与仪器 96孔微量培养板(美国Corning公司),318-酶标仪(上海三科仪器有限公司),QYC系列全温空气摇床(上海福玛实验设备有限公司),DHP-9162型电热恒温培养箱(上海一恒科技有限公司),Sirion200型扫描电镜(FEI公司)。
2 方法
2.1 连翘苷对铜绿假单胞菌最低抑菌浓度(MIC)的检测 按文献[6]采用微量稀释法,将浊度为0.5麦氏的菌液100μL加入到事先加入了2倍稀释浓度药物的96孔板,37℃培养24 h,以无菌生长的最小药物稀释度为MIC。
2.2 连翘苷对铜绿假单胞菌早期黏附性影响的检测 按文献[4,7]并改进将浊度为0.5麦氏的菌液100μL接种于96孔板中,37℃分别培养2、4、6 h。吸弃培养基及未黏附菌,PBS清洗3次,分别加入以培养基10倍连续稀释(1000,100,10 mg/L)的连翘苷和红霉素(每个质量浓度设8个复孔,共6个96孔板),继续37℃培养24 h。吸弃药物与悬浮菌,PBS清洗3次,待自干,0.4%结晶紫染色20 min,吸弃结晶紫,PBS清洗5次,95%酒精脱色,静置15 min后于650 nm处测其A值。另设阴性对照孔(只加细菌)。
2.3 连翘苷对铜绿假单胞菌的生物膜最小抑膜浓度(SMIC)的测定 按文献 [4,7]将浊度为0.5麦氏的菌液100μL接种入96孔板中,37℃培养24 h,吸弃培养基与悬浮菌,PBS清洗3次,分别加入以培养基对倍稀释(1024、512、256、128、64、32 mg/L)的连翘苷和红霉素(每个浓度设8个复孔,共6个96孔板),再于37℃培养24 h,结晶紫染色法于650 nm处测其A值。另设阴性对照孔(只加细菌)。
2.4 连翘苷对铜绿假单胞菌生物被膜形态结构的影响[5,8]取培养皿6个,先加入浊度为0.5麦氏的菌液及培养基,同时将预先灭菌的盖玻片浸入其中,培养3 d,使之形成初步生物被膜,再分别以培养基10倍连续稀释(1000、100、10 mg/L)的连翘苷和红霉素为给药质量浓度,对各模型分别作用6 d(每48 h换1次药液),用银染法电镜观察各组的形态。另设阴性对照组(只加细菌)。
2.5 统计学处理 数据采用SPSS 11.0 for Windows软件处理。采用方差分析和t检验,以P<0.05为有显著性差异。
3 结果
3.1 对铜绿假单胞菌的浮游菌MIC及黏附功能的影响连翘苷和红霉素对铜绿假单胞菌的 MIC分别为512、32 mg/L。与阴性对照组相比,1000 mg/L的连翘苷在2、4、6 h对铜绿假单胞菌的黏附均有明显抑制作用(P<0.05或P<0.01)。100 mg/L的连翘苷对2、4 h的铜绿假单胞菌的黏附有抑制作用(P<0.05),而对6 h的黏附无明显抑制作用,100、1000 mg/L红霉素在2、4、6 h能明显抑制铜绿假单胞菌的黏附(见图1,2)。
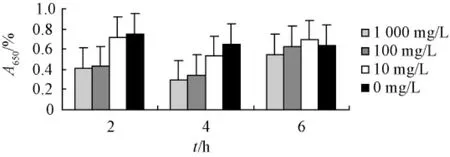
图1 不同质量浓度连翘苷对铜绿假单胞菌黏附性的影响(n=8,)
3.2 对铜绿假单胞菌生物被膜菌SMIC 连翘苷对铜绿假单胞菌生物被膜菌的SMIC50(与阴性对照相比,抑制生物被膜菌活性50%的药物质量浓度)为256 mg/L,SMIC80(与阴性对照相比,抑制生物被膜菌活性80%的药物质量浓度)为1024 mg/L。红霉素对铜绿假单胞菌生物被膜SMIC50与SMIC80分别为256、128 mg/L(见图3,图4)。
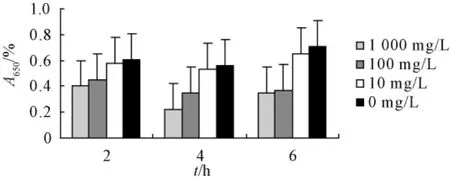
图2 不同质量浓度红霉素对铜绿假单胞黏附性的影响(n=8,)
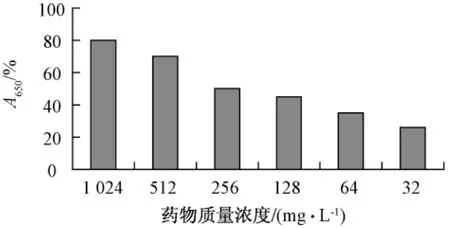
图3 不同质量浓度连翘苷对铜绿假单胞菌生物被膜形成的影响(n=8,)

图4 不同质量浓度红霉素对铜绿假单胞菌生物被膜形成的影响(n=8,)
3.3 镜下观察连翘苷对铜绿假单胞菌生物被膜形态结构的影响 扫描电镜下对照组图5A显示TSB培养3 d时生物被膜初步形成,图5B显示TSB培养7 d时生物被膜发育成熟。与对照组相比,在100 mg/L连翘苷和红霉素的分别作用下,生物被膜被破坏,但仍可见较多细菌聚集在一起(图5C为连翘苷,图5D为红霉素);而在1000 mg/L连翘苷的作用下,生物被膜被破坏的较为彻底,只可见少数细菌聚集及散落的单个细菌(图5E),在1000 mg/L红霉素作用下生物被膜被破坏的更为彻底(图5F)。
4 讨论
生物被膜是一个微生物聚集群体,是微生物不可逆地与生物或非生物组织表面接触后由自身产生的细胞外基质包裹着活菌细胞形成的微生态,是微生物在生长过程中为了适应生存环境而形成的相对于单个分散浮游状态菌细胞而言的另一种独特的微生物生存方式[1-2]。生物被膜相关感染已成为基础和临床研究必须直面的一个重要问题。连翘为木犀科落叶灌木植物连翘 Forsythia suspensa(Thunb.)Vahl的果实,味苦,性微寒,有清热解毒、疏散风热、消痈散结、强心利尿和降血压、止呕等功效[9]。连翘苷是连翘的有效成分之一。研究表明,连翘苷具有抗氧化、降血脂、调节非特异性免疫功能和破坏表皮葡萄球菌生物膜的作用[10-12]。但连翘苷对铜绿假单胞菌生物膜的作用未见报道。

图5 镀银染色法不同作用条件下细菌生长状况(×20000)
本实验采用标准菌株作为实验菌株,SMIC测定中使用的结晶紫染色法,在不破坏生物被膜结构的条件下能检测出生物被膜中菌细胞的活性。有报道证实[13]红霉素体外对细菌生物被膜具有较好的抑制作用,故本实验采用做为对照,证实实验方法正确有效。结果表明,连翘苷对铜绿假单胞菌 MIC为 512 mg/L,SMIC50与 SMIC80分别为 256、1024 mg/L。细菌生物被膜的形成要经过菌细胞黏附、微菌落形成、微菌落融合、生物被膜成熟、菌细胞从生物被膜中释放出来等5个阶段[14],由此实验设计了多个不同的时间点来研究;其中初始的黏附对生物被膜的形成来说尤其重要,因此又设计了早期黏附实验。实验结果表明,1000 mg/L的连翘苷在2、4、6 h对铜绿假单胞菌的黏附均有明显抑制作用,100 mg/L在2、4 h也显示抑制作用,提示连翘苷可以部分干预该菌生物被膜早期的发育。电子显微下观察,对照组TSB培养3 d时生物被膜已初步形成,镜下可见大量的细菌聚集在一起,部分被分泌物包裹,但细菌的形态依然可见,而培养7 d时生物被膜已发育成熟,呈团状聚集,由于其外包裹大量细菌分泌的基质物,其内细菌形态并不清楚。与对照组相比,100 mg/L与1000 mg/L连翘苷均可明显干预铜绿假单胞菌生物被膜的发育,并且随着药物浓度的增加,对该菌生物被膜的发育的抑制作用有增强趋势。以上结果表明连翘苷对铜绿假单胞菌生物被膜的形成及已形成的生物被膜均有一定的抑制作用。
文献[15]报道金丝桃属植物提取物具有抗铜绿假单胞菌生物被膜的功能。本实验证实连翘苷也有类似的作用,而抗菌药物易产生耐药性的缺点众所周知,因而中药及有效成分可望成为抗生物被膜药物研究的新方向。
[1]Costerton J W,Stewart P S,Greenberg E P.Bacterial biofilms:a common cause of persistent infections[J].Science,1999,284(5418):1318-1322.
[2]Lambert P A.Mechanisms of antibiotic resistance in Pseudomonas aeruginosa[J].J R Soc Med,2002,95(Suppl 41):22-26.
[3]程惠娟,刘 江,张 庚.穿心莲内酯抗铜绿假单胞菌生物被膜及与阿奇霉素协同抗菌作用[J].中国微生态学杂志,2012,24(2):120-123.
[4]官 妍,张 爽,马 越,等.鱼腥草素钠对表皮葡萄球菌生物被膜作用的研究[J].中国药学杂志,2011,46(10):733-736.
[5]汪长中,程慧娟,官 妍,等.没食子酸抑制白念珠菌生物膜作用的研究.中国中药杂志[J],2009,34(9):1137-1140.
[6]CooPer G L,Louie A,Balteh A L,et al.Influence of zine on Pseudo-monas aeruginosa susceptibilities to imipenem [J].J Clin Microbiol,1993,31(9):2366-2370.
[7]官 妍,马 越,程惠娟,等.苦参碱对表皮葡萄球菌生物被膜作用初探[J].微生物学通报,2011,38(1):91-96.
[8]Peeters E,Nelis H J,Coenye T.Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates[J].J Microbiol Methods,2008,72(2):157-165.
[9]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:159.
[10]刘 静.连翘苷对小鼠非特异性免疫及应激作用的实验研究[J].陕西教育学院学报,2008,24(3):59-61.
[11]赵咏梅,李发荣,杨建雄.连翘苷降血脂及抗氧化作用的实验研究[J].天然产物研究与开发,2005,17(2):157.
[12]官 妍,谢 萌,汪长中,等.连翘苷和黄芩苷对表皮葡萄球菌生物膜抑制作用的研究[J].中国微生态学杂志,2010,22(10):886-889.
[13]Nagata T,Mukae H,Kadota J,et al.Effect of erythromycin on chronic respiratory infection caused by Pseudomonas aeruginosa with biofilm formation in an experimental murine model[J]. Antimicrob Agents Chemother, 2004, 48(6):2251-2559.
[14]Stewart P S.Mechanisms of antibiotic resistence in bacterial biofilms[J].Int J Med Microbiol,2002,292(2):107-113.
[15]Sarkisian S A,Janssen M J,Matta H,et al.Inhibition of bacterial growth and biofilm production by constituents from Hypericum spp[J].Phytother Res,2012,26(7):1012-1016.

