纳米银溶胶的制备及其与荧光素相互作用的研究
刘征原,廉志红,张铁莉,于 翠
(1.河北联合大学 材料科学与工程学院,河北 唐山 063009;2.唐山师范学院 化学系,河北 唐山 063000)
纳米粒子是指直径在1-100 nm之间的粒子,也称为超微粒子。纳米粒子具有小尺寸效应、表面效应、量子尺寸效应和宏观隧道效应,因而显示出不同于常规材料的热、光、电、磁、催化等效应[1]。金属纳米粒子的表面等离子体共振可以极大地增强粒子周围的电磁场,这种局域场可以改变吸附于其表面周围的荧光体的自由空间条件,使其荧光增强或猝灭[2]。金属纳米材料以贵金属金、银、铜为代表,其中纳米银粒子在表面增强拉曼光谱、表面增强共振散射光谱、分子生物学、超分子体系等研究领域占有极为重要的地位[3]。纳米银溶胶的制备方法有多种,最常用的方法是化学还原法[4,5]。本文首次以太阳为光源,以聚乙烯吡咯烷酮为保护剂,用柠檬酸三钠还原硝酸银,制备了两种颜色的纳米银溶胶,这种制备方法克服了其他光化学还原法需要特定的光源及特制反应器的限制[6-8]。
荧光素(fluorescein,FL)[9]因具有较高的荧光量子产率而被广泛应用于 DNA杂化、生物分子的检测等方面。高浓度时 FL易发生荧光自猝灭,因此作为荧光标记物使用时,须控制在较低浓度范围内,但因荧光强度弱而给检测带来困难。在 FL体系中引入金属纳米结构,可以利用纳米结构产生的强局域场使其荧光增强[10,11]。Malicka等[10]以 FL为荧光探针在银岛膜上进行荧光素标记 DNA的研究,发现FL荧光强度提高了7倍。金属纳米结构的能量传输性质决定于光辐射与纳米结构产生的局域电磁场状态,而后者与纳米材料的显微结构、几何状态、界面结构、介电环境、与受体的结合状态等有关[12,13]。本文采用分光光度法和荧光法研究太阳光照制备得到的两种不同颜色的纳米银溶胶与荧光素的相互作用。
1 实验部分
1.1 仪器和试剂
UV2600型分光光度计(上海天美科学仪器有限公司);F-4500荧光分光光度计(日本日立公司);KQ-250E型超声波清洗器(昆明市超声仪器有限公司);SZ-93自动双重纯水蒸馏器(上海亚荣生化仪器厂);FL(AR,沈阳市试剂三厂);硝酸银(AR,天津市北方天医化学试剂厂);柠檬酸三钠(TSC)(AR,天津市化学试剂一厂);聚乙烯吡咯烷酮(PVP)(K30)(AR,国药集团化学试剂有限公司,进口分装);实验用水均为二次蒸馏水。
1.2 纳米银溶胶的制备
取 5.00 mL 2.11×10-3mol·L-1硝酸银水溶液置于 250 mL碘量瓶中,加入0.010 0 g PVP,摇匀,待其溶解后加入94 mL水,超声30 min后加入约1 mL 1%(wt) TSC水溶液,使反应溶液总体积为100 mL,继续超声30 min,得无色透明溶液。置于太阳光下照射,记录光照时间及其颜色变化,测定不同光照时间对应的 UV-Vis吸收光谱。将制得的纳米银溶胶,置于4 ℃冰箱中保存,测定放置不同时间后的UV-Vis光谱,研究其稳定性。
1.3 紫外法研究纳米银溶胶与荧光素的作用
在一系列10 mL比色管中,分别加入2.00 mL 2.50×10-5mol·L-1FL乙醇溶液,然后依次加入不同体积的按1.2制备得到的红色或蓝色纳米银溶胶(纳米银的浓度按银原子计算为 1.06×10-4mol·L-1),加水稀释至 5.00 mL,摇匀,避光放置30 min后,测定其吸收光谱。
1.4 荧光法研究纳米银溶胶与荧光素的相互作用
在一系列10 mL比色管中,分别加入2.00 mL 2.50×10-5mol·L-1FL乙醇溶液,然后分别加入不同体积的1.06×10-4mol·L-1红色或蓝色纳米银溶胶,加水稀释到5.00 mL,摇匀,避光放置30 min后,固定激发波长λex=491 nm,测定其荧光光谱。
2 结果与讨论
2.1 纳米银溶胶的制备、表征及稳定性
2.1.1 蓝色纳米银溶胶
按照1.2实验方法,在太阳光照较弱时制得了蓝色纳米银溶胶。光照过程中,反应液经历的颜色变化如表1所示,对应的UV-Vis吸收光谱如图1所示。

表1 蓝色纳米银溶胶制备过程中的颜色变化和对应的UV-Vis吸收光谱变化(光强较弱)
由表1可知,在光照3 h时间内,随着光照时间的延长,反应液的颜色依次由无色→粉红色→紫色→蓝色。贵金属纳米粒子对光的吸收是由价带电子与电磁场的相互作用产生的连续振动,即表面等离子体共振(SPR)而产生的,这是小粒子尺寸效应的表现,在块体材料中不存在。金属纳米粒子的SPR峰的位置和形状与粒子的大小、介电常数及其表面吸附情况有很大关系,银纳米粒子的SPR吸收和光散射导致其在可见光谱范围内呈现鲜亮的颜色[14]。球形纳米银粒子的SPR峰一般在400 nm附近,三角形纳米银对应的SPR峰在530-600 nm附近。从吸收峰的位置、半高宽和峰强度三个方面可以初步判断纳米银的形成情况:吸收峰的位置基本上可以定性判断纳米粒子的大小,在通常情况下,粒子越小,吸收峰的位置就越蓝移;在金属胶体中,通常吸收峰的半高宽越宽,粒子尺寸分布就越宽;若金属胶体在不同时刻其吸收峰位置、半高宽均不改变,而吸收峰的强度增大,说明金属粒子浓度增大,即单位体积内粒子数增多[15]。因此在纳米银溶胶制备过程中,不但可以从反应溶液的颜色判断纳米银溶胶的产生,而且可以通过 UV-Vis吸收光谱来证明纳米银溶胶的形成。
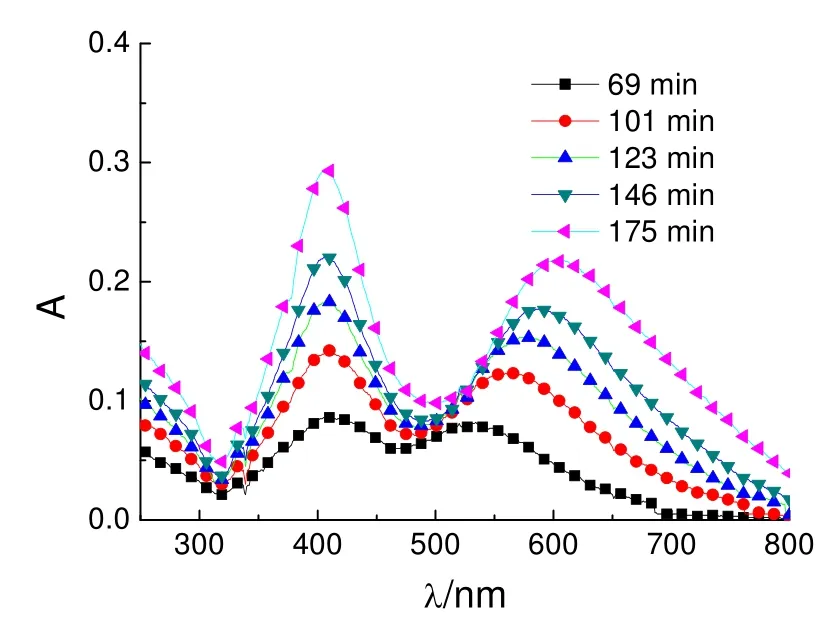
图1 蓝色银溶胶制备过程中的UV-Vis光谱
由图1中可见,在3 h内,随着光照时间的延长,出现两个SPR峰,且对应的峰强度逐渐增大。410 nm处的吸收峰的峰位无明显变化;而600 nm左右的吸收峰的峰位发生了明显的红移。由 UV-Vis光谱的变化,可以初步推测所制备的蓝色纳米银溶胶中至少存在球形和三角形两种形貌的纳米银粒子,并且反应过程中纳米银粒子的数量逐渐增多。
将反应175 min制备得到的蓝色纳米银溶胶置于4 ℃冰箱中保存,通过检测其 UV-Vis光谱可知,蓝色纳米银溶胶在4 ℃避光保存的条件下可以至少稳定两个月。
2.1.2 红色纳米银溶胶
按照1.2实验方法,在光照强度较强时制得了红色纳米银溶胶。表2给出了在光照过程中反应液经历的颜色变化及对应的UV-Vis光谱数据。

表2 红色纳米银溶胶制备过程中的颜色变化和对应的UV-Vis吸收光谱变化(光强较强)
从表2可知,在32 min内,随着光照时间的延长,反应液的颜色依次由无色→黄色→橙黄色→橙红色→酒红色。实验发现,当溶液颜色变为酒红色且吸光度为0.3左右时,如果继续光照,溶液就会变成浊色,不再清澈透明,所以当吸光度为0.3左右时停止光照。图2是对应的UV-Vis吸收光谱。
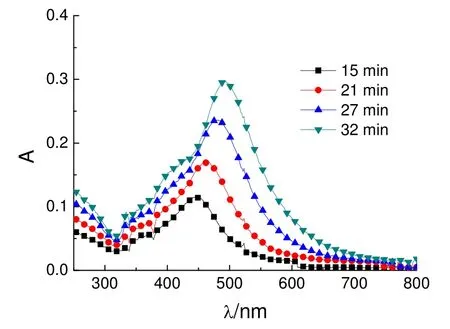
图2 红色纳米银溶胶制备过程中的UV-Vis光谱
由图2可知,在32 min内,随着光照时间的延长,430-500 nm范围内出现了一个明显的吸收峰,吸收峰位置发生红移,其对应的峰强度逐渐增大,表明得到纳米银的数量在增加。
当溶液的颜色变成红色,且吸光度较大时,于4 ℃冰箱中保存。通过检测纳米银溶胶的 UV-Vis光谱可知,纳米银溶胶在4 ℃避光保存至少可以稳定15天。
通过比较可知,上述两种不同光照强度时制得纳米银的颜色和光谱有很大差异,说明光照强度对纳米银的形貌有明显影响。
2.2 光度法研究纳米银溶胶与FL的相互作用
2.2.1 蓝色纳米银溶胶与FL的相互作用
2.2.1.1 UV-Vis分光光度法
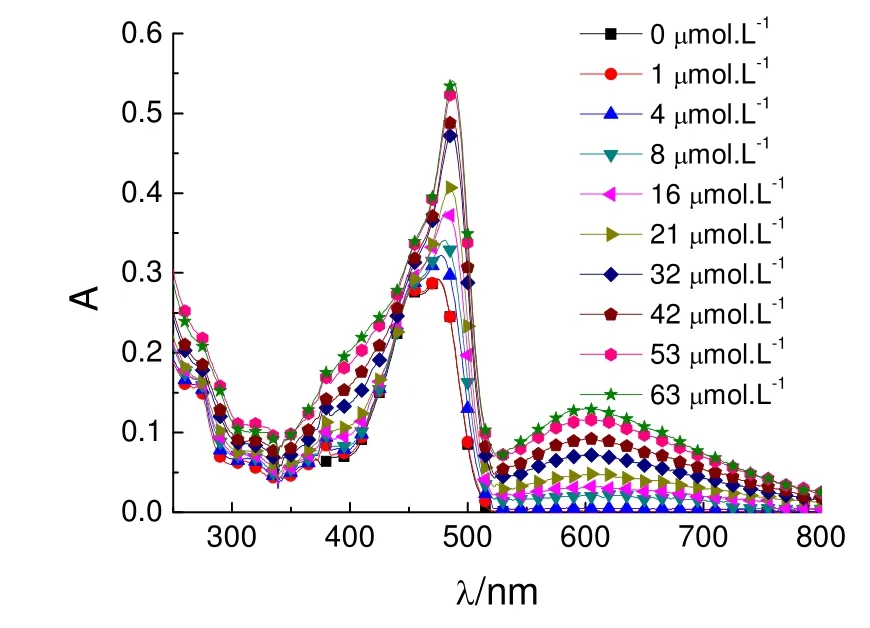
图3 FL与蓝色纳米银溶胶混合后的UV-Vis光谱

图4 蓝色纳米银(32 μmol·L-1)、FL(1.00×10-5 mol·L-1)及二者混合溶液的UV-Vis光谱
图3 为FL与不同浓度的蓝色纳米银溶胶混合溶液的UV-Vis吸收光谱。加入蓝色纳米银溶胶后,FL的特征吸收峰(474 nm)发生红移,当蓝色纳米银溶胶的浓度为32 μmol·L-1时,峰位红移13 nm。此后,随着银溶胶浓度的继续增加,峰位保持不变,但峰强度依然增大。图4为蓝色银溶胶、FL、FL-蓝色银溶胶混合液的吸收光谱,以及纳米银胶和 FL的加和光谱。混合溶液的吸收光谱与其加和光谱有较大的差别,表明 FL与蓝色纳米银溶胶混合溶液的吸收光谱不是二者的简单加和,混合体系中出现了不同于FL分子和纳米银溶胶的新复合物。FL分子在水溶液中以阴离子形式存在,其-COO-与蓝色纳米纳米银溶胶之间存在较强的相互作用,在纳米银表面形成了 FLn-Ag复合物。同时,蓝色纳米银表面等离子体在外场的激发下产生的强局域场也会对其表面及附近的 FL分子产生作用。表面局域场的物理作用及表面分子间的化学作用是 FL的吸收峰产生红移的主要原因[2]。
2.2.1.2 荧光法研究
图5为FL与蓝色银溶胶混合溶液的荧光发射光谱。
由图5可知,加入蓝色纳米银溶胶后,FL的荧光强度随着银溶胶加入量的增加而逐渐增强;当银溶胶浓度增加至32 μmol·L-1时,荧光强度达到最大;此后荧光强度随银溶胶浓度的增加不再变化。此外,从图5可以看出,与FL本身的荧光发射光谱相比,混合体系的荧光发射光谱没有本质的改变,说明FLn-Ag复合物的形成并没有破坏FL分子内的荧光团。

图5 FL与蓝色银溶胶混合溶液的荧光发射光谱
据文献报道[2],具有金属性的纳米结构(如金属纳米微粒、纳米线等)可通过表面等离子激元与光子间强烈的共振耦合,极大地增强纳米结构周围的电磁场,进而提高纳米结构附近发光体的激发强度,将能量传至系统的发光中心,使发光中心的辐射跃迁几率大幅度提高,荧光增强。在本文的实验条件下,纳米银胶的引入使 FL荧光增强,分析认为主要与下列三个因素有关:
(1)FL包覆在纳米银粒子表面,使 FL中的荧光团与纳米银表面的距离缩短至有效能量传输距离;
(2)FL分子在水溶液中以阴离子形式存在,其羧基(-COO-)与纳米银之间存在较强的相互作用,纳米银表面形成了FLn-Ag复合物,从而使光吸收增强;
(3)纳米银粒子通过FL相互桥连使其产生的局域场相互叠加,局域场增强。
在上述因素的共同作用下纳米银粒子将所收集的激发光能量通过强局域场传输给FL分子,使其荧光增强[2]。当纳米银溶胶的浓度达到32 μmol·L-1时,大量纳米银粒子的存在使纳米粒子表面等离子激元共振受到抑制,局域场强下降。另外,大量的 FL分子吸附在纳米银粒子表面,使FL分子与纳米银粒子间有效传输距离减小,使得荧光强度增加的幅度降低,直至接近不变。
2.2.2 红色纳米银溶胶与FL的相互作用
2.2.2.1 UV-Vis分光光度法
图6为FL与红色纳米银溶胶混合溶液的UV-Vis吸收光谱。
加入红色纳米银溶胶后,FL特征吸收峰(474 nm)发生红移,当银溶胶的浓度为32 μmol·L-1时,峰位红移13 nm。此后,随着银溶胶浓度的继续增加,峰位保持不变,但强度依然增大。然而当加入1 μmol·L-1红色银溶胶后,其吸收峰强度低于FL本身的,且峰位稍有蓝移。

图6 FL与红色纳米银溶胶混合溶液的UV-Vis光谱

图7 红色纳米银(32 μmol·L-1)、FL(1.00×10-5 mol·L-1)及二者混合溶液的UV-Vis吸收光谱
图7为蓝色银溶胶、FL、FL-红色银溶胶混合液的吸收光谱,以及纳米银胶和 FL的加和光谱。混合溶液的吸收光谱与其加和光谱有较大的差别,与蓝色纳米银相似,表明在红色纳米银表面形成了FLn-Ag复合物。
2.2.2.2 荧光法研究相互作用
图8为FL和红色纳米银溶胶混合后体系的荧光发射光谱。
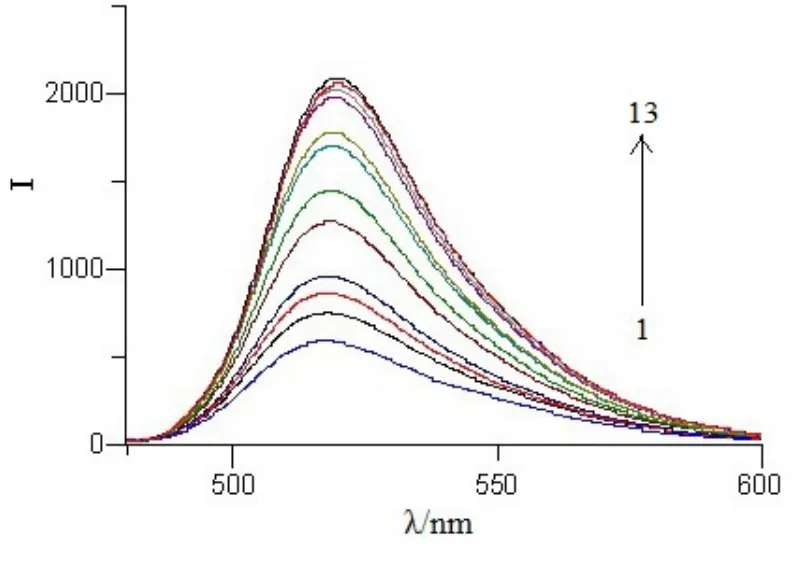
图8 FL与红色银溶胶混合溶液的荧光发射光谱
从图8中可以看到,当FL中加入红色纳米银溶胶,FL的荧光强度随着红色纳米银溶胶加入量的增加而增大,当银溶胶浓度为21 μmol·L-1时,荧光强度达到最大。此后荧光强度随着银溶胶浓度的增大保持不变。与蓝色银胶的情况相似,加入红色纳米银胶后,与 FL比较,体系的荧光发射光谱形貌无明显改变,说明 FLn-Ag复合物的形成并没有破坏 FL分子内的荧光团。然而当红色纳米银溶胶的浓度为1 μmol·L-1时,混合液的荧光强度低于FL自身溶液的,且峰位稍有蓝移。另外,红色纳米银溶胶与荧光素作用后荧光强度的增加量小于蓝色纳米银溶胶的。红色和蓝色纳米银与 FL作用情况有所差异,推测是由于两种纳米银的形貌不同所致。
3 结论
利用柠檬酸三钠光化学还原硝酸银,通过控制太阳光照强度和光照时间制备了稳定的蓝色和红色纳米银溶胶。FL分子包覆在纳米银溶胶表面形成FLn-Ag复合物,使纳米银溶胶相互桥连形成类似网络的结构,纳米银通过产生的强局域场将能量传输给FL发光中心,实现了FL的荧光增强。
[1] 何晓燕,俞梅.纳米银粒子的化学法制备及其表征[J].兰州交通大学学报(自然科学版),2005,24(3):154-158.
[2] 王悦辉,周济,石士考.纳米银对表面吸附荧光素的荧光增强和荧光猝灭效应及 KCl的荧光猝灭释放效应[J].无机化学学报,2006,22(9):1579-1584.
[3] 段春英,周静芳.银纳米颗粒的制备及表征[J].化学研究,2003,14(3):18-20.
[4] 樊新,黄可龙,刘素琴,等.化学还原法制备纳米银粒子及其表征[J].功能材料,2007,38(6):996-1002.
[5] 钟福新,蒋治良,李芳,等.纳米银的光化学制备及其共振散射光谱研究[J].光谱学与光谱分析,2000,20(5):724-726.
[6] 钟福新,蒋治良,李廷盛,等.绿色和黄色银胶的光化学制备及其共振散射光谱研究[J].感光科学与光化学,2001,19(1):13-17.
[7] 姚素薇,曹艳蕊,张卫国.光还原法制备不同形貌银纳米粒子及其形成机理[J].应用化学,2006,23(4):438-440.
[8] 刘征原,张铁莉,廉志红,等.光化学还原法制备绿色纳米银溶胶[J].唐山师范学院学报,2012,34(5):1-4.
[9] 王悦辉,周济,王婷.纳米银与表面吸附荧光素的荧光性能影响[J].光谱学与光谱分析,2007,27(8):1556-1559.
[10] Lukomska J, Malika J, Gryczynski I, et al.Increasing the sensitivity of DNA microarrays by metal-enhanced fluorescence using surface-bound silver nanoparticles[J].Biopolymers, 2005, 77(31): 7969-7975.
[11] Zhang J, Malika J, Gryczynski I, et al.Preparation and Characterization of Surface Reactable Modified Silver Nanoparticles[J].Phys Chem.B, 2006, 5(109): 7642-7643.
[12] Lakowicz J R.Anal.Biochem.Metal-Enhanced Fluorescence from CdTe Nanocrystals A Single- Molecule Fluorescence Study[J].J Am Chem Soc, 2006, 128(28):8998-8999.
[13] Noginov M A, Williams S N, Gavrienko V I, et al.Spectroscopic studies of liquid solutions of R6G laser dye and Ag nanoparticle aggregates[J].Opt A: Pure Appl.Opt., 2005, 7: S219-S229.
[14] Jian Ling, You Sang, Chengzhi Huang.Visual colorimetric detection of berberine hydrochlochride with silver nanoparticles[J].Journal of Pharmacetical and Biomedical Analysis, 2008, 47: 860-864.
[15] 和俊,司民真.纳米银的制备及其应用[J].光散射学报,2008,20(1):42-46.

