维生素对大肠杆菌Escherichia coli.JN8产L-色氨酸的影响
娄秀平, 沈健增, 蔡宇杰*, 廖祥儒, 张大兵
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江苏汉邦科技有限公司,江苏 淮安223001)
色氨酸是一种重要的氨基酸,对于人类和动物的生长发育、新陈代谢有着重要的生理作用,参与多种生物物质合成并广泛应用于食品、动物饲料、医药工业[1]。
长久以来,色氨酸都是在氨基酸生产中产业化难度较大的一种氨基酸。色氨酸的生产方法主要有:化学合成法、蛋白水解法、微生物法。微生物法大体上又可以分为直接发酵法、微生物转化法和酶法。直接发酵法是以葡萄糖、甘蔗糖蜜等廉价原料为碳源,利用优良的色氨酸产生菌来生产色氨酸[2-4]。在色氨酸的生物发酵中,大肠杆菌和谷氨酸棒状杆菌是主要的生产菌。近几年来,由于在生产中有缩短生产周期、减少设备投资、降低成本、提高生产效率等优点,大肠杆菌高密度发酵生产色氨酸得到国内外的广泛关注。目前大肠杆菌生产色氨酸最大可达到54.6 g/L[5]。
维生素是细胞生长和代谢所必需的物质,在L-色氨酸的合成及降解途径中,很多维生素作为辅因子直接参与调控L-色氨酸的代谢过程。因此,研究维生素对色氨酸生产的影响有着重要的意义。作者选择在全合成培养基中,考察可能与L-色氨酸代谢密切相关的9种维生素对大肠杆菌合成L-色氨酸的影响,通过比较不同维生素对菌体细胞生长、L-色氨酸的积累的影响,确定了这9种维生素的最优用量[6]。
1 材料与方法
1.1 菌种
大肠杆菌Escherichia coli.JN8由作者所在实验室保存。
1.2 培养基
保藏培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠 10,琼脂 20,四环素 0.01;pH 7.0~7.2,于 121 ℃湿热灭菌30 min。
种子培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠 10,四环素 0.01;pH 7.0 ~7.2,于 121 ℃湿热灭菌30 min。
发酵培养基(g/L):葡萄糖 20,(NH4)2SO411.5,KH2PO46,MgSO4·7H2O 2,FeSO4·7H2O 0.25;于 115 ℃湿热灭菌20 min。
各种维生素配制成浓缩液,用0.22 μm的无菌滤膜过滤除菌,在-20℃下保存,临用前置于室温使其融化,于接种的同时添加到摇瓶培养基中。添加生物素使其在培养基中终质量浓度分别为0.03,0.06,0.09,0.12,0.15 mg/L;叶酸在培养基的终质量浓度分别为 0.000 2,0.000 4,0.000 6,0.000 8,0.001 0 mg/L;VB2(核黄素)在培养基的终质量浓度为 0.02,0.04,0.06,0.08,0.1 mg/L; 肌醇、VB1(硫胺素)、 VB3(烟酸)、VB5(泛酸)、VB6(吡哆醇)、VC(抗坏血酸)在培养基中的终质量浓度均分别为0.2,0.4,0.6,0.8,1.0 mg/L; 对照则不添加任何维生素。
1.3 方法
1.3.1 种子制备 从甘油管中取菌,在种子培养基斜面或平板划线,33℃培养12~15 h。种子培养基30 mL置于250 mL的三角瓶中,接入新鲜斜面菌种一环,33 ℃、250~300 r/min培养 9 h。
1.3.2 摇瓶培养 种子液以10%体积分数的接种量接入发酵培养基中,摇瓶发酵装液量为30 mL(250 mL的三角瓶),33℃、250 r/min培养 24 h。
1.3.3 菌悬液OD值的测定 发酵液用蒸馏水稀释50倍数,于紫外可见光分光光度计上测600 nm处的吸光光度。
1.3.4 色氨酸总量的测定 发酵液中色氨酸总量按照文献[7]所述方法测定。
2 结果与讨论
2.1 肌醇和叶酸的添加浓度对大肠杆菌Escherichia coli.JN8生长和L-色氨酸产量的影响
如图1所示,当肌醇质量浓度为0.2 mg/L时菌体浓度和L-色氨酸含量均达到最大值,与对照相比分别提高了16.8%和14%。随着肌醇质量浓度的增加,L-色氨酸含量减少,但是与对照相比菌体浓度仍有所提高。这说明低质量浓度的肌醇促进L-色氨酸合成,而添加不同质量浓度的肌醇均有利于菌体的生长。当叶酸为0.000 2 mg/L时菌体浓度和L-色氨酸含量达到最大值,与对照相比分别提高了16.8%和26.4%。叶酸的活性辅酶形式四氢叶酸(THF)是一碳循环中的辅酶与底物,并随碳循环参与核酸代谢、氨基酸的合成[3-4],是影响微生物生长代谢的重要物质。但是随着叶酸质量浓度的增加,菌体浓度和色氨酸含量均出现明显的降低趋势,L-色氨酸的含量低于对照,而菌体浓度较对照仍有所提高。这同样说明低质量浓度的叶酸促进色氨酸合成,而添加不同质量浓度的叶酸均有利于菌体的生长。
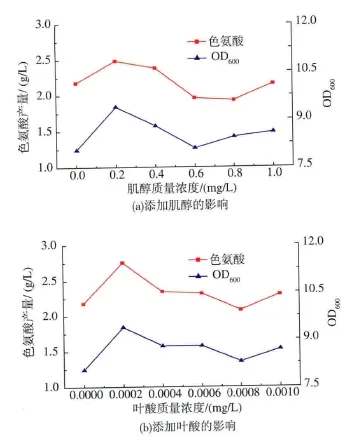
图1 肌醇和叶酸质量浓度对大肠杆菌Escherichia coli.JN8生长和L-色氨酸产量的影响Fig.1 Effect of concentration of Inositol and Folic acid on thegrowth ofEscherichia coli.JN8 and L-tryptophan production
2.2 生物素的添加浓度对大肠杆菌Escherichia coli.JN8生长和L-色氨酸产量的影响
如图2所示,当生物素的质量浓度小于0.12 mg/L时,随着生物素的质量浓度升高,菌体浓度及色氨酸的含量均有所升高。当生物素质量浓度为0.12 mg/L时,菌体浓度和色氨酸的产量达到最大,分别比对照提高了24.2%和30.4%。可能是生物素改变了细胞膜的成分及通透性[4,8],让更多色氨酸分泌到胞外,减少了反馈抑制,从而提高了发酵液中的色氨酸含量。尽管当质量浓度为0.15 mg/L时,色氨酸的产量低于对照水平,但是菌体浓度较对照仍有9.3%的提高。这与吴琳[9]等研究增加生物素浓度,菌体生长得到改善的实验结果相同。所以,适量添加生物素对菌体生长和色氨酸的合成均有明显的促进作用。

图2 生物素质量浓度对Escherichia coli.JN8生长和L-色氨酸产量的影响Fig.2 Effect of the Biotin concentration on the growth of Escherichia coli.JN8 and L-tryptophan production
2.3 VB6的添加浓度对大肠杆菌Escherichia coli.JN8生长和L-色氨酸产量的影响
在VB6质量浓度较低时,L-色氨酸的合成受到明显的抑制,而菌体的生长几乎不受影响。如图3所示,当VB6质量浓度为0.8 mg/L时,菌体浓度和色氨酸的产量均较对照有着显著的提高,分别提高11.8%和27.2%。随着添加浓度进一步提高,色氨酸的产量再次受到抑制,而较高质量浓度VB6的添加促进菌体生长。这可能是添加VB6在促进L-色氨酸的合成同时也促进L-色氨酸的分解。VB6在细胞内主要以磷酸酯形式存在,磷酸吡哆醛(PLP)和磷酸吡哆胺是其活性形式,是氨基酸代谢中多种酶的辅酶[4]。其中PLP参加催化涉及氨基酸的各种反应。何俊峰[10]研究指出VB6参与胞内一些转氨、脱氨、转硫反应并参与氨基酸的脱羧基反应。
2.4 VB5的添加浓度对大肠杆菌Escherichia coli.JN8生长和L-色氨酸产量的影响
如图4所示,随着VB5质量浓度的升高,色氨酸的产量呈先升高后降低趋势,当质量浓度为0.4 mg/L时,色氨酸的产量达到最大值,较对照提高14.3%。当质量浓度为0.8 mg/L时,菌体浓度达到最大,较对照提高10.6%。可能是VB5(泛酸)的主要活性形式辅酶A(CoA)在细胞内主要起传递酰基的作用,是各种酰化反应中的辅酶,参与糖代谢及氨基酸代谢[4,11]。所以,VB5的添加可以明显地促进菌体的生长,并有利于L-色氨酸的合成。

图3 VB6质量浓度对Escherichia coli.JN8生长和L-色氨酸产量的影响Fig.3 Effect of VB6concentration on the growth of Escherichia coli.JN8 and L-tryptophan production
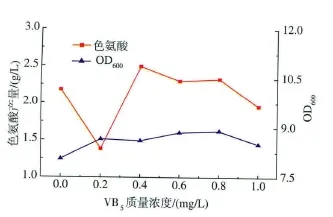
图4 VB5质量浓度对Escherichia coli.JN8生长和L-色氨酸产量的影响Fig.4 Effect of VB5concentration on the growth of Escherichia coli.JN8 and L-tryptophan production
2.5 VB1和VC对大肠杆菌Escherichia coli.JN8生长和L-色氨酸产量的影响
VB1(硫胺素)与糖代谢密切相关,VC(抗坏血酸)在胞内氧化还原反应中起递氢体的作用[10-12],这两种维生素含量的变化可能对L-色氨酸代谢起到微妙的作用。如图5所示,仅当VB1质量浓度为0.4 mg/L时,菌体浓度和L-色氨酸的产量较对照均有所提高。其余质量浓度下色氨酸的合成均受到明显抑制,VB1对菌体的生长作用不明显。VC质量浓度为0.2 mg/L时,L-色氨酸的产量为最大值,而在VC的各个添加浓度下,菌体浓度均明显高于对照水平。这说明VC的添加有利于菌体生长但却抑制色氨酸合成。

图5 VB1及VC对大肠杆菌Escherichia coli.JN8生长和L-色氨酸产量的影响Fig.5 Effect of VB1and VC on the growth of Escherichia coli.JN8 and L-tryptophan production
2.6 VB2和VB3对大肠杆菌Escherichia coli.JN8生长和L-色氨酸产量的影响
VB2(核黄素)是蛋白质、糖、脂肪酸代谢和能量利用与组成所必需的物质。VB3(烟酸)在胞内转变为烟酰胺,后者是辅酶Ⅰ和辅酶Ⅱ的组成部分,参与胞内的生物氧化过程[11]。这两种维生素的添加可能对氨基酸的合成有一定的影响。如图6所示,当VB2和VB3质量浓度均为0.4 mg/L时,L-色氨酸的产量达到最大,但是都略微低于对照水平。随着添加浓度的增加,两种维生素均抑制L-色氨酸的合成。当VB2和 VB3质量浓度分别为 0.6 mg/L和0.8mg/L时,菌体浓度最大。但是VB2在各个添加浓度下,菌体浓度均明显高于对照水平。这说明VB2和VB3的添加抑制大肠杆菌色氨酸的合成。

图6 VB2和VB3对大肠杆菌 Escherichia coli.JN8生长和L-色氨酸产量的影响Fig.6 Effect of VB2and VB3on the growth of Escherichia coli.JN8and L-tryptophan production
3 结语
采用单因素法研究了肌醇、叶酸、生物素、VB1、VB2、VB3、VB5、VB6和 VC 对 大 肠 杆 菌 Escherichia coli.JN8生长和L-色氨酸产量的影响。研究结果显示,低质量浓度的肌醇(0.2 mg/L)和叶酸(0.000 2 mg/L)可显著促进菌体生长及L-色氨酸的合成,随着两种维生素质量浓度的增加L-色氨酸的合成受到不同程度的抑制作用,而菌体的浓度虽然呈下降趋势但菌体的生长仍然受到促进作用;添加较高质量浓度(0.09~0.12 mg/L)的生物素可以明显促进菌体生长及L-色氨酸的合成;仅在质量浓度为0.8 mg/L时,VB6对菌体生长及L-色氨酸的合成有显著的促进作用,其余质量浓度下L-色氨酸的合成均受到严重的抑制作用;尽管不同质量浓度的 VB1、VB2、VB3和VC的添加对菌体的生长均有较强的促进作用,但对于L-色氨酸合成却有不同程度的抑制作用。可能这些维生素作为辅因子不仅参与了L-色氨酸的合成过程,还参与了L-色氨酸的降解过程。同样不同质量浓度的VB5对菌体的生长有明显促进作用,而仅在0.4~0.8 mg/L质量浓度下对色氨酸的合成有较微弱的促进作用。
近年来,随着对L-色氨酸研究的不断深入,L-色氨酸不仅得到广泛的应用并且对其需求越来越大,目前的产量远不足以满足需求。所以如何提高L-色氨酸的产量将成为后续研究的重点。
[1]陈宁,孙涛,张克旭.L一色氨酸高产菌的选育及其发酵条件的研究[J].食品与发酵工业,1997,23(5):10-15.CHEN Ning,SUN Tao,ZHANG Ke-xu.The breeding of L-Tryptophan highly producing strains and studies on its fermentation conditions[J].Food and Fermentation Industries,1997,23(5):10-15.(in Chinese)
[2]赵志军,陈晟,吴丹,等.微生物发酵法生产L-色氨酸的代谢工程研究[J].中国生物工程杂志,2011,31(6):135-141.ZHAO Zhi-jun,CHEN Sheng,WU Dan,et al.Metabolic engineering of L-tryptophan via microbiological fermentation[J].China Biotechnology,2011,31(6):135-141.(in Chinese)
[3]张晓娟,窦文芳,许泓瑜,等.维生素对谷氨酸棒杆菌SYPS-062直接发酵合成L-丝氨酸的影响[J].中国生物工程杂志,2007,27(5):50-55.ZHANG Xiao-juan,DOU Wen-fang,Xu Hong-yu,et al.Effects of vitamins on the direct fermentative production of L-serine in Corynebacterium glutamicum SYPS-062[J].China Biotechnology,2007,27(5):50-55.(in Chinese)
[4]王镜岩,朱圣庚,徐长法.生物化学[M].第3版.北京:高等教育出版社,2002:440-464.
[5]ZHAO Zhi-jun,CHEN Sheng,WU Dan,et al.Effect of gene knockouts of l-tryptophan uptake system on the production of ltryptophan in Escherichia coli[J].Process Biochemistry,2012,47:340-344.
[6]刘文波,柴同杰.大肠杆菌高密度发酵研究[J].动物科学与动物医学,2001,18(1):27-29.LIU Wen-bo,CHAI Tong-jie.High cell density fermentation of Escherichia coli[J].Animal Science&Veterinary Medicine,2001,18(1):27-29.(in Chinese)
[7]王建,陈宁,徐咏全,等.发酵液中色氨酸含量的快速测定[J].食品与发酵工业,2004,30(2):123-125.WANG Jian,CHEN Ning,XU Yong-quan,et al.Quick determination of L-Tryptophan in fermented broth[J].Food and Fermentation Industries,2004,30(2):123-125.(in Chinese)
[8]杨毅,章志兰,姜绪林,等.生物素和VB1在谷氨酸棒杆菌过量合成缬氨酸中的作用[J].食品与生物技术学报,2005,24(7):57-60.YANG Yi,ZHANG Zhi-lan,JIANG Xu-lin,et al.Effects of D-Biotin and VB1factors on the biosynthesis of valine in a valine producer Corynebacterium glutamicum AATV341[J].Journal of Food Science and Biotechnology,2005,24 (7):57-60.(in Chinese)
[9]吴琳,李志敏,叶勤.基本培养基中芳香族氨基酸和维生素对D-核糖生产的影响[J].华东理工大学学报,2009,35(5):707-712.WU Lin,LI Zhi-min,YE Qin.Effect of aromatic amino acids and vitamins on D-Ribose production and optimization of minimal medium[J].Journal of East China University of Science and Technology,2009,35(5):707-712.(in Chinese)
[10]何俊峰.L-组氨酸产生菌的选育及其发酵条件优化[D].无锡:江南大学,2006.
[11]王宝贝,凌雪萍,郑宗宇,等.维生素对红法夫酵母产虾青素的影响[J].厦门大学学报,2011,50(1):111-116.WANG Bao-bei,LING Xue-ping,ZHENG Zong-yu,et al.Effect of vitamins on astaxanthin production of Phaffia rhodozyma[J].Journal of Xiamen University,2011,50(1):111-116.(in Chinese)
[12]杨海军.L-色氨酸发酵条件的优化及其发酵动力学分析[D].天津:天津科技大学,2004.

