高富硒酵母菌诱变选育研究
曾礼华, 马平美, 李 维*, 黄崇波, 张 纯,陈贵英, 葛方兰, 唐 凌, 邝声耀
(1.四川师范大学 生命科学学院,四川 成都610061;2.四川省畜科饲料有限公司,四川 成都610066)
世界卫生组织于1973年将硒确定为人和动物必需的微量元素,同年美国FDA批准亚硒酸钠和硒酸钠可作为饲料添加剂应用于动物养殖业。近年来,越来越多的研究揭示和验证了硒的多种生理功能,主要包括:抗氧化作用[1-2],增强免疫作用与抗病作用[3-5],调节机体代谢[2],另外,硒还能增强人和动物的生殖机能[6-7],具有抗自由基,延缓衰老,拮抗有毒元素等作用[7]。
由于硒元素具有上述重要的生理功能,其作为机体必需的营养元素早就引起人们的高度重视[8-9]。目前,硒营养强化剂主要有3种即无机态亚硒酸钠、有机态硒及富硒酵母,无机硒和有机硒化合物都能被动物机体吸收,但是,由于畜禽对无机硒吸收利用过程中,无机硒须先进入肝脏,转化成生物硒后才可被吸收,因而毒性很大,而富硒酵母具有吸收性好、安全无毒等优点,是一种比较理想的硒营养剂[9],已被用作营养强化剂应用到各种食品中,在预防和治疗疾病以及养殖业等方面也有广泛的应用[8-9]。我国20个省市中,缺硒、贫硒县高达72%,全国近7亿人口处于缺硒状态,因此开发高富硒酵母具有重要的意义。
酵母硒是通过酵母自身的代谢活动,将无机硒在体内转化为与蛋白质和多糖相结合的有机硒,提高了硒的利用率和安全性[10]。已有的研究结果表明,在酵母体内硒主要以硒代半胱氨酸和硒代蛋氨酸形式存在[9-10]。硒是硫的类似物,硒被生物同化吸收是利用S的代谢酶作用进入细胞,取代S整合到游离氨基酸和蛋白质中[9-10],因而,无机硒盐离子和无机硫酸酸根离子在吸收同化过程中竞争同一转运系统。
国内已有多篇有关富硒酵母菌选育的报道[11-13],但多采用单一诱变剂处理的方法,难以获得理想的富硒酵母突变菌株。作者利用多种来源的酵母菌,先通过亚硒酸抗性筛选,选出硒耐受性和富硒能力强的酵母菌株,并以此为出发菌株,经亚硝基胍(NTG)、紫外线复合诱变,再分别结合亚硒酸抗性、乙硫氨酸抗性筛选,选育出高产富硒酵母菌株,旨在为酵母硒的产业化生产提供菌种资源。
1 材料与方法
1.1 菌种来源
由市农产品市场购买到的8种食用酵母粉和3种酒曲,作为菌株分离的样品来源。另外,从中国工业微生物菌种保藏管理中心购买到10株食品安全级的酵母菌直接作为供试菌株,包括:2株热带假丝酵 母 (Candida tropicalis),2 株 酿 酒 酵 母(Saccharomyces cerevisiae),2 株 产 朊 假 丝 酵 母(Candida utilis), 其余葡萄汁酵母(Saccharomyces uvarum)、异常汉逊酵母(Hansenula anomala)、白球拟 酵 母 (Torulopsis candida)、 粟 酒 裂 殖 酵 母(Schizosaccharomyces pombe)各 1 株。
1.2 培养基
1.2.1 YEPD和YNB培养基 培养基的配制参照文献[14-15]的方法,加1.8%的琼脂即成固体培养基;
1.2.2 酵母菌分离培养基 (孟加拉红培养基)配方 (g/L):蛋白胨5 g,葡萄糖10 g,磷酸二氢钾(K2HPO4·3H2O)1 g,硫酸镁(MgSO4·7H2O)0.5 g,琼脂 15~20 g,蒸馏水 1 000 mL,氯霉素 0.1 g;上述各成分加入蒸馏水中溶解后,再加孟加拉红溶液(1%水溶液)3.3 mL。另用少量乙醇溶解氯霉素,加入培养基中,分装后,121℃灭菌20 min;
1.2.3 亚硒酸钠抗性筛选培养基 在YEPD培养基中加入一定浓度过滤灭菌的亚硒酸钠溶液;
1.2.4 乙硫氨酸抗性培养基 在YNB培养集中加入一定量过滤灭菌的乙硫氨酸溶液。
1.3 试剂
3,3′-二氨基联苯胺(DAB):Fluka 公司产品;亚硝基胍、DL-乙硫氨酸、硒代蛋氨酸标准品:Sigma公司产品。
1.4 菌种初筛
分别称取食用酵母粉和酒曲样品各2 g,加入到YEPD液体培养基中,30℃,静置活化2 h,梯度稀释,取0.2 mL稀释涂布于酵母菌分离培养基上,30℃,培养24 h,挑取单菌落于斜面保存。
1.5 亚硒酸钠抗性复筛
亚硒酸钠溶液过滤除菌后,加入到灭菌的培养基中, 制备 Se4+含量分别为 0、10、20、40、60、80、100、120 μg/mL的亚硒酸钠抗性培养基。将分离获得的酵母菌株及购买的10株菌活化后,制作菌悬液,分别取0.2 mL菌悬液,涂布于上述固体亚硒酸钠抗性培养基上,30℃倒置培养,48 h后观察。选出菌落较大,颜色较浅的酵母菌于斜面培养基进行纯培养。从新鲜斜面上转接于一环菌体于装有100 mL发酵培养基的500 mL三角瓶中,30℃,200 r/min振荡培养,测其生物量和硒含量,筛选出生物量和硒含量较高的酵母菌株。
1.6 酵母中硒含量的测定
参照文献[14-16],采用 3,3’-二氨基联苯胺比色法测定酵母细胞的总硒含量及无机硒含量,两者之差即为酵母细胞内有机硒的含量。
1.7 菌体生物量的测定
取发酵菌液于4 000 r/min离心10 min,收集菌体,无菌水洗涤3次,65℃烘干至恒重后,称量即得菌体生物量(g/L)。
1.8 氨基酸成分分析
样品的氨基酸成分委托中国测试技术研究院测定。
1.9 菌种的诱变与筛选
1.9.1 亚硝基胍诱变及亚硒酸钠抗性筛选 取生长至对数期的酵母菌悬液,4 000 r/min离心,用生理盐水洗涤数次,悬浮于柠檬酸缓冲液,细胞浓度调至107个/mL,加入0.5 mL亚硝基胍溶液,35℃振荡处理1 h,其致死率为80%。加入生理盐水稀释终止反应,再用生理盐水洗涤数次,悬浮于生理盐水中。取适量上述菌液涂布于Se4+含量为80 μg/mL的亚硒酸钠抗性平板中,避光培养48 h。
1.9.2 紫外线诱变及乙硫氨酸抗性筛选 取生长至对数期的酵母菌悬液稀释,涂布于乙硫氨酸质量浓度分别为 0.5、1、1.5、2、2.5、3 g/L 的 YNB 培养基上(每一个浓度梯度设2个平行实验组),经48~72 h培养后,确定菌株的乙硫氨酸敏感性。
将前述诱变获得的高产菌株培养至对数期,收集细胞,用无菌水稀释成107个/mL。吸取6 mL菌悬液于直径为9 cm的无菌平板中,将平皿置于紫外诱变箱中,使无菌平板距离紫外灯管25 cm左右,经紫外灯照射60 s,致死率为80%。将经上述紫外线诱变处理后的菌液适当稀释,涂布于乙硫氨酸抗性平板上,避光培养48 h。
2 结果与讨论
2.1 亚硒酸钠抗性菌株筛选
从8种食用酵母粉和3种酒曲中分离获得26株菌株,加上作者所在实验室购买并保存的10株酵母菌,共计36株。对该36株酵母菌进行亚硒酸钠抗性筛选,获得3株能在Se4+质量浓度为80 μg/mL的平板上生长的菌株。研究表明,在Se4+质量浓度低于20 μg/mL的平板上,各个菌株与对照组相比,生长状况无明显差异。Se4+质量浓度大于20 μg/mL时,有的菌株生长开始受阻;当Se4+质量浓度达到40 μg/mL时,有14株能正常生长;当Se4+质量浓度达到80 μg/mL时,不同酵母菌株生长差异十分明显,36株供试菌中仅有3株能正常生长,它们分别是酿酒酵母A1-2,热带假丝酵母1254,产朊假丝酵母Y-3,当 Se4+质量浓度高达 100 μg/mL时,所有菌株均不能正常生长。对该3株菌株分别进行复筛,测定其生物量、总硒质量分数、无机硒质量分数,计算有机硒质量分数及转化率,结果见表1。
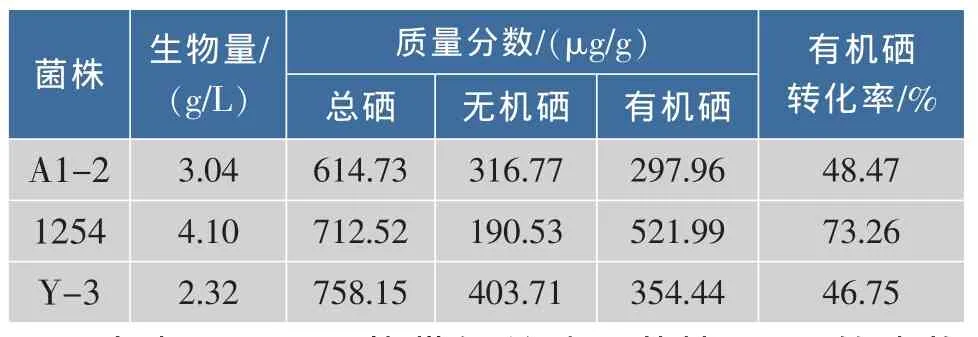
表1 亚硒酸钠抗性菌株的筛选Table 1 Screening of sodium selenite-resistant strains
由表 可见,热带假丝酵母菌株 的生物量、有机硒含量及有机硒转化率均最高,分别为4.1 g/L、521.99 μg/g、73.26%。故选择热带假丝酵母菌株1254作为诱变育种的出发菌株。
2.2 亚硝基胍诱变及亚硒酸钠抗性株的筛选
出发菌株热带假丝酵母菌1254经亚硝基胍诱变后,涂布亚硒酸钠抗性平板筛选,以菌落大小和颜色特征为指标,挑出菌落较大颜色较浅的株菌,依次编号。将各菌株接种在 Se4+质量浓度为80 μg/mL的液体培养基中进行发酵培养,测定菌株的生物量、总硒量、无机硒质量分数,计算有机硒的质量分数及转化率。共计挑出12株菌落较大、颜色较浅的菌株,进行发酵培养,获得总硒质量分数、有机硒质量分数及有机硒转化率均最高的菌株1254-6,与出发菌株对比如表2。

表2 出发菌株1254和化学诱变株1254-6的生物量及硒质量分数Table 2 Biomass and selenium content of the parental strain 1254 and mutant 1254-6
由表2可见,与出发菌株1254相比,诱变菌株1254-6的生物量降低了13.17%,但诱变菌株1254-6的总硒质量分数、有机硒质量分数及有机硒转化率分别是出发菌株1254的6.59倍、7.72倍、1.17倍,故选取菌株1254-6作为下一轮诱变育种的材料。
2.3 紫外线诱变及乙硫氨酸抗性菌株筛选结果
2.3.1 乙硫氨酸抗性分析 将菌株1254-6活化后稀释,涂布于一定乙硫氨酸浓度梯度的YNB培养基上,经48~72 h培养后,观察其生长情况。结果显示,与大多数酵母菌相似,该菌株在乙硫氨酸质量浓度为1.0 g/L的平板上,不能正常生长。因此选择乙硫氨酸质量浓度为1.0 g/L作为诱变抗性的筛选质量浓度。
2.3.2 乙硫氨酸抗性株的筛选 1254-6菌株经紫外诱变处理,菌悬液稀释涂布于含1.0 g/L乙硫氨酸的YNB平板上,避光培养72 h。挑选生长快,菌落较大,颜色较浅的抗性菌株共37株,编号为1254-6-1到1254-6-37。将其点样于含乙硫氨酸的平板上,培养48~72 h,每组设3个平行实验组。根据菌落大小及生长情况选取16株菌株,在发酵培养集中进行富硒培养,测定菌株的生物量、总硒量、无机硒质量分数,计算有机硒质量分数及转化率。其中菌株1254-6-1含硒量最高的,结果如表3所示。
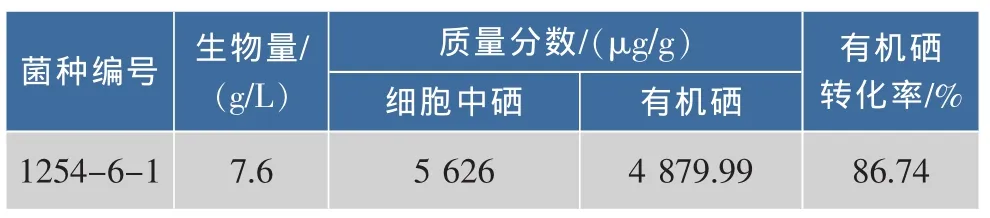
表3 菌株1254-6-1生物量及硒质量分数Table 3 Biomass and selenium content of mutant 1254-6-1
由表3可见,与菌株1254-6相比,菌株1254-6-1的生物量、总硒质量分数、有机硒质量分数及有机硒转化率分别提高了2.13倍、1.20倍、1.21倍、1.01倍。与原始出发菌株1254相比,双抗菌株1254-6-1的生物量、总硒质量分数、有机硒质量分数及转化率分别提高1.85倍、7.90倍、9.35倍、1.18倍,分别达到 7.60 g/L、5 626.00 μg/g、4 879.99 μg/g、86.74%。
出发菌株1254经亚硝基胍诱变处理,显著提高了菌株总硒质量分数、有机硒质量分数及有机硒转化率,但降低了菌株生物量。出发菌株1254经亚硝基胍诱变处理后,再采用紫外线诱变处理,结果获得的菌株生物量得以明显提高,总硒质量分数、有机硒质量分数及有机硒转化率也得以改善。由此可见,采用不同诱变剂处理,可以减少单一诱变剂的负突变,实现正突变的累加,从而提高育种效率。
2.4 突变菌株氨基酸含量分析
利用氨基酸自动分析仪对双抗性株1254-6-1与出发株1254氨基酸的质量分数进行测定,结果见表4。

表4 诱变株1254-6-1与出发株1254氨基酸质量分数Table 4 Content of amino acids of mutant 1254-6-1 and the parental strain 1254
由表4可知,经过连续诱变及两种抗性平板的反复筛选得到的菌株1254-6-1,各种氨基酸的相对质量分数均高于出发菌株,其中蛋氨酸是出发株的135%,胱氨酸是194.1%,从代谢途径来可知,胱氨酸为蛋氨酸的合成提供巯基,说明合成前体物含量的增加可造成蛋氨酸的增加。有前人研究结果可知,在酵母体内硒主要以硒代半胱氨酸和硒代蛋氨酸形式存在[8-9],因此由此推测,半胱氨酸和蛋氨酸含量的变化与酵母体内硒含量是呈正相关性的。此外,与出发菌株相比,诱变后菌株中酪氨酸的含量也有较大提高,是出发菌株的140%。酪氨酸用途很广泛,在医药上用作甲状腺功能亢进,也可作为食品添加剂。另外酪氨酸还是一种重要的生化试剂,是合成多肽类激素、抗生素、L-多巴等药物的主要原料。广泛用于农业科学研究,也作饲料添加剂和配制人工昆虫饲料。
3 结语
从8种食用酵母粉和3种酒曲中分离得到26株酵母菌菌株,连同由中国微生物菌种保藏中心提供的10株酵母菌,共36株菌。通过对该36株酵母菌进行硒耐受性初筛和摇瓶发酵富硒复筛,获得1株硒耐受性高且富硒能力较强的热带假丝酵母菌株1254。对菌株1254进行了多轮诱变选育。通过亚硝基胍诱变,亚硒酸钠抗性筛选后,获得了12株抗性菌,其中突变菌株1254-6的总硒质量分数、有机硒质量分数及有机硒转化率分别是出发菌株1254的6.59倍、7.72倍、1.17倍。突变菌株1254-6经紫外诱变和乙硫氨酸抗性筛选后,获得了乙硫氨酸抗性菌株37株,其中突变菌株1254-6-1的生物量、总硒质量分数、有机硒质量分数及转化率分别达到7.60 g/L、5 626.00 μg/g、4 879.99 μg/g、86.74%。 对双抗性株1254-6-1与出发株1254氨基酸的相对质量分数分别进行测定,结果显示,双抗性株1254-6-1的各种氨基酸含量均高于出发菌株1254,其中蛋氨酸是出发株的135%,胱氨酸是194.1%。
[1]WANG Z G,PAN X J,ZHANG W Q,et al.Methionine and selenium yeast supplementation of the maternal diets affects antioxidant activity of breeding eggs[J].Poultry Science,2010,89(5):931-937.
[2]Margaret P R.The importance of selenium to human health[J].The Lancet,2000,356:233-241.
[3]QIN Shun-yi,HUANG Ke-he,GAO Jian-zhong,et al.Comparison of glutathione peroxidase and iodothyronine deiodinase mRNA expression in murine fiver after feeding selenite or selenized yeast[J].Journal of Trace Elements in Medicine and Biology,2009,23(1):29-35.
[4]张国蓉,王燕,刘安军.富硒酵母对CCl4肝损伤小鼠免疫功能的影响[J].食品科技,2009,34(3):118-125.ZHANG Guo-Rong,WANG Yan,LIU An-Jun.Effect of selenium-enriched yeast on the antioxidant function in liver injury mice[J].Food Science and Technology,2009,25(2):118-120.(in Chinese)
[5]胡滨,陈一资,辜雪冬.硒强化剂的急性和蓄积毒性试验研究[J].食品与生物技术学报,2010,29(4):553-557.HU Bin,CHEN Yi-zi,GU Xue-dong.Experiment on acute and accumulative toxicity test of Selenium reinforcement[J].Journal of Food Science and Biotechnology,2010,29(4):553-557.(in Chinese)
[6]王珏,黄亚军,梁林,等.中药富硒酵母对动物中枢免疫器官发育的影响[J].微量元素与健康研究,2009,26(2):8-11.WANG Jue,HUANG Ya-jun,LIANG Lin,et al.Effect of Se-enriched yeast cultured in Chinese medicine on development of central immune organ in animal[J].Studies of Trace Elements and Health,2009,26(2):8-11.(in Chinese)
[7]Fortier ME,Audet I,Giguère A,et al.Effect of dietary organic and inorganic selenium on antioxidant status,embryo development,and reproductive performance in hyperovulatory first-parity gilts[J].Journal of Animal Science,2012,90(1):231-40.
[8]Rotruck J T,Pope A L,Ganther H E,et al.Selenium:Biochemical role as a component of glutathione peroxidase[J].Science,1973,179(74):588-590.
[9]李淑敏.酵母作为微量元素载体的研究及应用前景[J].微生物学通报,1999,26(3):220-223.LI Shu-ming.The research progress and application prospect of yeast enriching trace elements[J].Microbiology,1999,26(3):220-223.(in Chinese)
[10]Poncede Leon C A,Bayón M M,Paquin C,et al.Selenium incorporation into Saccharomyces cerevisiae cells:a study of different incorporation methods[J].Journal of Applied Microbiology,2002,92:602-610.(in Chinese)
[11]王小波,柳乐,李学如.高富硒酵母菌种选育研究[J].食品与发酵科技,47(5):6-9.WANG Xiao-bo,LIU Le,LI Xue-ru.Breeding of a high selenium-enriched yeast strain[J].Food and Fermentation Technology,47(5):6-9.(in Chinese)
[12]范秀英,郭雪娜,傅秀辉,等.高生物量富硒酵母的选育及培养条件初步优化[J].生物工程学报,2003,19(6):720-724.FAN Xiu-ying,GUO Xue-na,FU Xiu-hui,et al.The breeding and culture condition optimization of a high-biomass,seleniumenriched yeast strain[J].Chinese Journal of Biotechnology,2003,19(6):720-724.(in Chinese)
[13]张顺涛,李肖,左涛,等.高生物量富硒酵母菌的选育[J].中国酿造,2008,21:37-40.ZHANG Shun-tao,LI Xiao,ZUO Tao,et al.Breeding of a high-biomass and selenium-enriched yeast strain[J].China Brewing,2008,21:37-40.(in Chinese)
[14]贺立东.分光光度法测定富硒酵母中有机硒的含量[J].食品工业科技,2000,21(5):67-68.HE Li-dong.Spectrometry for determination of organo-Selenium in Selenium-enriched yeast[J].Science and Technology of Food Industry,2000,21(5):67-68.(in Chinese)
[15]刘曲滨,刘康,包惠燕,等.富硒酵母中硒含量的测定[J].广州食品工业科技,1999,63(16):33-35.LIU Qu-bin,LIU Kang,BAO Hui-yan,et al.Determination of selenium in selenium enriched yeast[J].Guangzhou Food Science and Technology,1999,63(16):33-35.(in Chinese)
[16]王黎,周之荣,罗明标.溴酸钾氧化二甲基黄动力学光度法测定食品中的痕量硒(Ⅳ)[J].食品与生物技术学报,2006,25(1):31-34.WANG Li,ZHOU Zhi-rong,LUO Ming-biao.Kinetic spectrophotometric determination of trace selenium ( Ⅳ )based on discoloring of dimethyl yellow oxidized by potassium bromate[J].Journal of Food Science and Biotechnology,2006,25(1):31-34.(in Chinese)

