高效液相色谱测定不同采收期罗布麻中黄酮含量
石雪萍, 吴亮亮
(1.江苏经贸职业技术学院 工程技术学院/江苏省食品安全工程技术研究开发中心,江苏 南京 210007;2.南京野生植物综合利用研究院,江苏 南京 210042)
罗布麻 (Apocynum venetum)分为红麻和白麻两种,为夹竹桃科多年生直立半灌木草本植物,是一种具有多种经济用途和生态用途的资源植物。罗布麻具有耐盐碱、耐严寒和酷暑的特性,广泛生长在盐碱、沙荒地带,集中在新疆、内蒙、甘肃、青海等省区,因最早发现于新疆罗布泊,故命名为罗布麻[1]。用罗布麻叶作饮茶及药用有悠久的历史,《中国药植图鉴》记载罗布麻:“嫩叶,蒸炒揉制后代茶,有清凉去火,防止头晕和强心的功用。”《陕西中草药》记载其具有“清凉泻火,强心利尿,降血压。治心脏病,高血压,神经衰弱,肾炎浮肿”的功效。现代研究表明,罗布麻中的有效成分主要有黄酮类、鞣质类、有机酸类、醇类、氨基酸类等[2-3],具有降压、降脂、抗感冒、镇静安神、抗抑郁等功效[4-10]。罗布麻最主要成分为黄酮类成分。近年来国内外关于罗布麻中黄酮的研究甚多,主要有总黄酮的测定:范维刚等人研究了罗布麻叶中黄酮类化合物含量的测定[11],刘东平研究了罗布麻黄酮测定方法[12];黄酮的分离:耿岩玲等利用高速逆流色谱从罗布麻中分离得到了异槲皮素甙[13];张云峰等人从罗布麻中分离得到了8种化合物,3种为黄酮类成分,其中有槲皮素和异槲皮素甙[14]。程秀丽将罗布麻的乙醇提取物经聚酰胺柱、Sephadex LH-20,反复分离纯化得到几种黄酮类化合物三叶豆苷、金丝桃苷、槲皮素、乙酰异槲皮苷与异槲皮苷[15]。作者以新疆阿拉泰地区的罗布红麻为原料,利用高效液相色谱法测定不同采收期罗布麻茶中的几种黄酮含量,旨在寻找最佳的采收期,并可根据需要选择不同的采收期,从而更加合理地利用这种戈壁珍品。
1 材料与方法
1.1 材料与试剂
罗布麻样品采自新疆阿拉泰。按照采收期分别标记为 1#,6 月份采摘;2#,7 月份采收;3# 样品,8月份采收;4#样品,9月份采收;5#样品,8月份采收热水浸泡。
芦丁、金丝桃苷、异槲皮素甙、槲皮素对照品(纯度≥98%),南京泽朗医药科技有限公司产品;甲醇、磷酸为HPLC级,水为纯净水。其它试剂均为分析纯试剂。
1.2 仪器与设备
Agilent 1200高效液相色谱仪、二极管阵列检测器 (DAD)、安捷伦化学工作站、Zorbax保护住(H4033A):安捷伦科技有限公司产品;JA3103N分析天平:上海明桥精密科学仪器有限公司产品;T6新世纪紫外-可见分光光度计:北京普析通用仪器有限公司产品。
1.3 实验方法
1.3.1 对照品溶液制备 精密称取4.8 mg异槲皮苷,5.5 mg金丝桃苷,5.4 mg芦丁和5.8 mg槲皮素,甲醇定容至10 mL,样品浓度分别为 0.48、0.55、0.54、0.58 mg/mL,并将母液稀释成5个浓度梯度的对照品溶液,待进样。
1.3.2 供试样品溶液的制备 将不同时期采摘的罗布麻叶干燥,粉碎过40目筛。分别称取1#、2#、3#、4#样品2 g,加入体积分数60%乙醇溶液100 mL,超声提取60 min,过滤取滤液;称取5#样品2 g,100 mL沸水泡制3次,合并,过滤取滤液。滤液上样前经0.45 μm膜过滤,进样。
1.3.3 色谱条件 Zorbax Eclipse C18色谱柱 (150 mm×4.6 mm,5 μm);流动相:v(甲醇)∶v(体积分数0.4%磷酸)=50∶50; 流量:1 mL/min; 检测波长:360 nm;柱温 35 ℃;进样量 5 μL。
2 结果分析
2.1 线性关系考察
将对照品溶液从低浓度到高浓度,依次进样,每个浓度进样3次,每次5 μL,按1.3.3的色谱条件进行HPLC分析,以色谱峰面积(Y)对进样量(X)进行回归,计算回归方程。结果见表1。
由表1看出,各对照品在一定的浓度范围内具有良好的线性关系。
2.2 精密度实验
精密吸取芦丁、金丝桃苷、异槲皮素甙、槲皮素对照品质量浓度分别为 0.48、0.55、0.54、0.58 mg/mL的对照品混合液5 μL,按照1.3.3的色谱条件进行HPLC分析。重复进样6次,测定各个对照品的峰面积,结果芦丁峰面积RSD为1.86%,金丝桃苷峰面积RSD为2.02%,异槲皮素甙峰面积RSD为2.35%,槲 皮素峰面积RSD为2.26%。表明仪器精密度良好。
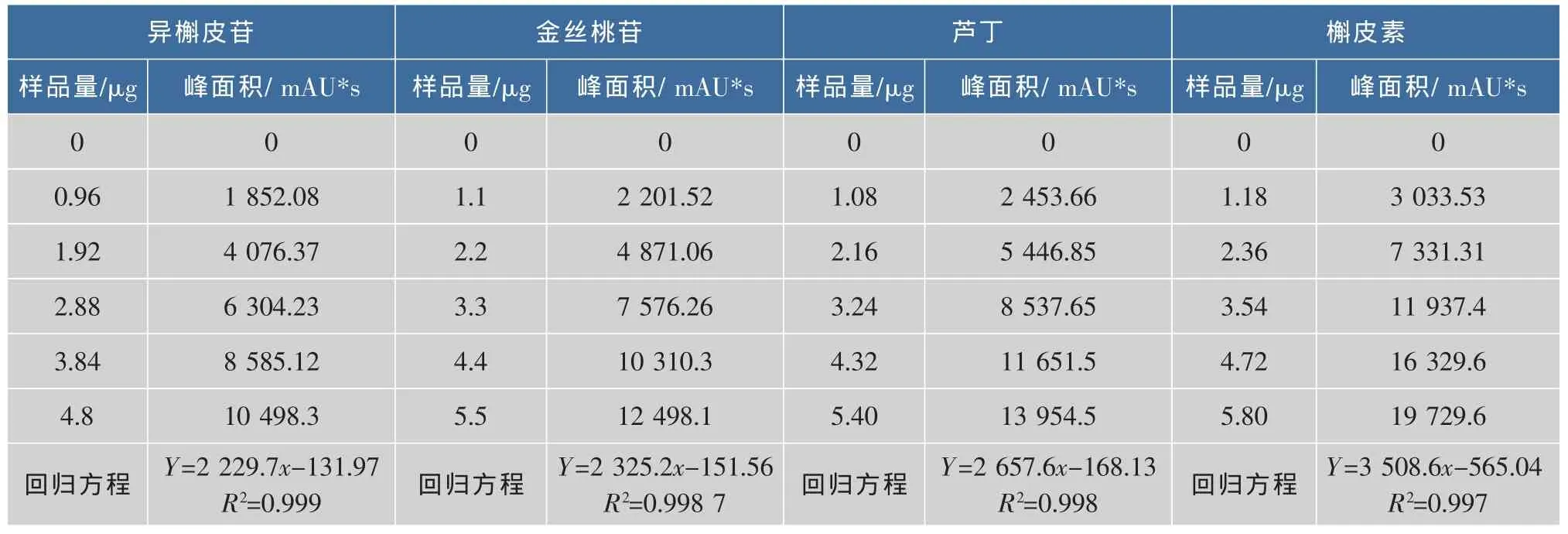
表1 各对照品的线性回归方程和相关系数Table 1 Regression equation and correlation coefficient of four standard samples
2.3 稳定性实验
精密吸取 1.3.2 的供试品溶液 5 μL,于 0、4、8、12、16、20、24、48 h 分别进样, 测定芦丁的峰面积RSD为1.91%,金丝桃苷峰面积RSD为2.18%,异槲皮素甙峰面积的RSD为2.81%,槲皮素峰面积RSD为2.32%。表明该方法稳定性良好。
2.4 重复性实验
精密称取同一批罗布麻样品6份,按照1.3.2的方法制备,1.3.3的色谱条件测定。结果显示,芦丁峰面积RSD为3.20%,金丝桃苷峰面积RSD为4.82%,异槲皮素甙峰面积RSD为 3.21%,槲皮素峰面积RSD为4.35%。表明该方法的重复性良好。
2.5 回收率实验
精密吸取已知含量的罗布麻提取液,分成3组,每组按照低、中、高3个标准准确加入对照品混合液,按1.3.3的色谱条件测定。结果显示芦丁平均回收率99.1%,RSD为4.3%;金丝桃苷的回收率为91.7%,RSD为5.1%;异槲皮素甙的平均回收率为96.3%,RSD为 3.8%;槲皮素的平均回收率为115.2%,RSD为4.9%。
2.6 不同采收期罗布麻中黄酮含量测定
不同采收期的罗布麻样品按1.3.2供试品溶液制备处理,在上述色谱条件下进行分析,HPLC图谱见图1和图2。
由图1和图2可以看出,4种黄酮在所选择的HPLC条件下能够很好分开。罗布麻叶提取物中的芦丁、金丝桃苷、异槲皮素甙和槲皮素的出峰时间分别为 5.790、6.275、6.640、18.382 min。
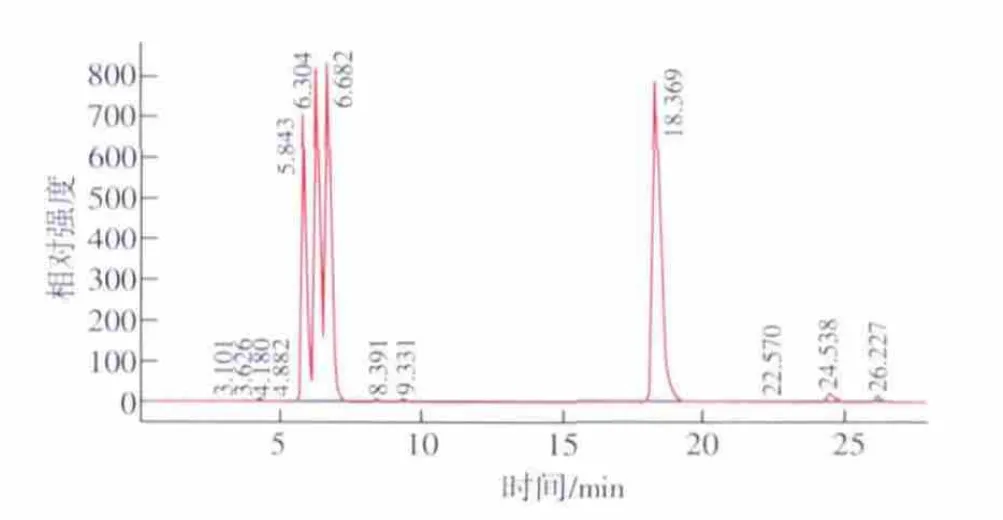
图1 对照品的HPLC色谱Fig.1 HPLC Chromatogram of standard samples

图2 样品(3#)中的HPLC色谱Fig.2 HPLC Chromatogram of flavonoids from sample(3#)
2.7 不同采收期罗布麻中黄酮含量比较分析
参照各对照品的标准曲线,求得不同采收期的罗布麻叶样品中黄酮质量分数,并进行柱状图分析。结果见表2和图3。

图3 不同采收期罗布麻中黄酮含量柱状分析图Fig.3 Columnar graph of flavonoids content of the Apocynum venetum samples gathered in different seasons

表2 不同采收期样品中黄酮成分质量分数Table 2 Flavonoids content of the Apocynum venetum samples gathered in different seasons
由图3和表2可以看出,随着月份增加,罗布麻中黄酮含量整体呈增加趋势。这4种黄酮中,异槲皮素甙含量最高,其次是芦丁。6月份采收的罗布麻叶中没有检测出金丝桃苷,8月份采收的罗布麻茶沸水泡制液中未见槲皮素,其他3种黄酮含量比较高,说明沸水泡制能很好地溶出黄酮类物质。
3 讨论
3.1 色谱条件选择
按照甲醇磷酸不同比例作为流动相进行了比较,结果发现,当流动相为v(甲醇)∶v(体积分数0.4%磷酸)=50∶50时,各组分峰分离较好,且峰形对称性良好。在色谱柱允许的范围内,考察了温度的影响,发现随着温度升高分离效果越好。综合考虑,选择了50℃作为最佳柱温。
3.2 提取条件的选择
芦丁和金丝桃苷、异槲皮素甙极性较大,槲皮素极性较小,溶于甲醇、乙醇、微溶于水。考察了不同提取溶剂,试验结果表明体积分数60%乙醇溶液能够兼顾这四种黄酮的极性特点,再加上乙醇作为溶剂的安全性,因此用体积分数60%乙醇溶液为提取溶剂。实验同时也研究了沸水泡制罗布麻茶,对其黄酮的影响,结果发现,沸水泡制能溶出大部分黄酮类成分。因此,罗布麻叶作为茶叶用沸水泡制是合理的,且冲泡3遍,基本能溶出大部分黄酮类成分。
3.3 采收季节确定
黄酮类是一种重要的植物次生代谢产物,随着植物的生长而呈动态变化[16]。植物生长环境中的温度、水分、光照、大气、盐分、养分等都会对植物的生长产生各种各样的影响甚至胁迫,致使次生代谢产物发生变化[17]。从以上结果看出,8月份采收的罗布麻叶(叶片乌绿)含有的黄酮总量最多,但槲皮素含量甚微,可以用作加工成罗布麻茶。9月份采收的罗布麻叶(叶片呈金黄)金丝桃苷、槲皮素含量较高,可以作为罗布麻发酵茶或者罗布麻提取物的最佳原料。由此看出,研究不同采收季节罗布麻中黄酮含量,有利于更合理地利用罗布麻资源,创造更高的附加值。
[1]中国科学院植物志编委会.中国植物志(第63卷)[M].北京:北京科学出版社,1977:87.
[2]吕建荣.罗布麻花叶精油化学成分分析与活性研究[D].扬凌:西北农林科技大学,2007.
[3]江佩芬,余亚纲,吉卯祉,等.罗布麻叶脂溶性化学成分的研究[J].中药通报,1985,12(5):30-31.JIANG Pei-fen,YU Ya-gang,JI Mao-zhi,et al.Study on liposoluble chemical constitutes in leaves of Apocynum ventum[J].Bulletin of Chinese materia medica,1985,12(5):30-31.(in Chinese)
[4]Kim D,Yokozawa T,Hattori M,et al.Effects of aqueous extracts of Apocynum venetum leaves on spontaneously hypertensive,renal hypertensive and NaCl-fed-hypertensive rats[J].J Ethnopharmacol, 2000(72):53-59.
[5]Grundmann O,Nakajima J,Seo S,et al.Anti-anxiety effects of Apocynum venetum L.in the elevated plus maze test[J].J Ethnopharmacol,2007,110(3):406-411.
[6]Butterweck V,Nishibe S,Sasaki T,et al.Antidepressant effects of Apocynum venetum leaves in a forced swimming test[J].Biol Pharm Bull,2001,4(7):848-851.
[7]Taraami K,Yoshihisa N,Eijiro T,et al.Studies on antihypertensive effect of luobuma (Apocynum venetum L.)leaf extract[J].Natural Medicines,2004,58(3):109-112.
[8]Chie T,Tamami K,Yoshihisa N,et al.Studies on antihypertensive effect of luobuma (Apocynum venetum L.)leaf extract[J].Yakugaku Zasshi,2004,124(11):851-856.
[9]Tarnami K,Yoshihisa N,Yutaka T,et al.On chemical identification of luobuma and analysis of flavonoids in luobuma[J].Natural Medicines,2004,58(6):295-298.
[10]燕福生,邹静恂,李素菊.罗布麻药理活性研究[J].首都医学院学报,1989,10(1):28-30.YAN Fu-sheng,ZOU Jing-xun,LI Su-ju.On the pharmacologic activity of bluish dogbane determination of the trace elements in the extract[J].Journal of Capital Medical University,1989,10(1):28-30.(in Chinese)
[11]范维刚,解成喜,李锋,等.罗布麻叶中黄酮类化合物含量的测定[J].新疆大学学报,2005,22(3):464-466.FAN Wei-gang,XIE Cheng-xi,LI Feng.Study of content of flavonoid of Apocynum venetum leaf[J].Journal of Xinjiang University,2005,22(3):464-466.(in Chinese)
[12]刘东平,周亚球,王先荣.罗布麻叶总黄酮的测定方法探讨[J].时珍国医国药,2007,18(3):614-616.LIU Dong-ping,ZHOU Ya-qiu,WANG Xian-rong.Determination of the content of total flavonoids in Apocynum Venetum leaf[J].Lishizhen Medicine and Materia Medica Research,2007,18(3):614-616.(in Chinese)
[13]耿岩玲,李福伟,王晓,等.罗布麻中黄酮的超声波强化提取及高速逆流色谱分离纯化[J].食品科学,2007,28(12):47-49.GENG Yan-ling,LI Fu-wei,WANG Xiao,et al.Flavonoids extraction from Apocynum venetum by ultrasonic-assisted and purification by high-speed counter-current chromatography[J].Food Science,2007,28(12):47-49.(in Chinese)
[14]张云峰,魏东,郭祀远,等.大花罗布麻的化学成分研究[J].天然产物研究与开发,2006,18:954-957.ZHANG Yun-feng,WEI Dong,QUO Qi-yuan,et al.Studies on chemical constituents of poacynum hendersonii[J].Natural Product Research and Development,2006,18:954-957.(in Chinese)
[15]程秀丽.中药罗布麻叶中黄酮类化合物提取分离研究[D].太原:山西医科大学,2005.CHENG Xiu-li.A study on the protective effects of theanine on the induced brain damnification by ischemia-reperfusion in rabbit[D].Shanxi Medical University,2005.(in Chinese)
[16]张梅.杜鹃黄酮类化合物活性成分的动态变化及诱导子对其含量和相关酶活性影响的研究[D].福州:福建农林大学,2012.ZHANG Mei.Study on the dynamic variation of the flavonoids contents and the inlfuences of the elicitor on the flavonoids contents and related enzyme activities in rhododendron L[D].Fujian Agriculture and Forestry University,2012.(in Chinese)
[17]杨燕.五种药用植物生长过程中化学成分变化及天麻素苷元衍生物的合成研究[D].西安:西北大学,2008.

