促红细胞生成素对大鼠肾间质纤维化发动蛋白-1表达影响
刘艳红 韩子明
肾间质纤维化是多种肾脏疾病发展至终末期肾功能衰竭的共同途径[1]。而肾脏疾病导致肾小管与间质细胞的凋亡,影响肾脏重塑与修复,加重肾间质纤维化[2]。有研究证实,在凋亡因素刺激下,发动蛋白-1(Drp-1)表达增加,线粒体持续分裂,引起相关凋亡因子表达水平改变及转位,诱导细胞凋亡[3]。研究表明促红细胞生成素(EPO)对多种器官都有保护作用,然而EPO对肾间质纤维化Drp-1有无影响报道不多。本研究通过EPO干预肾间质纤维化大鼠,观察肾组织Drp-1的变化,探讨EPO对肾间质纤维化的保护机制。
1 方法
1.1 实验动物和试剂81只健康13周龄雄性SD大鼠,体重180~230 g,由新乡医学院实验动物中心提供。EPO购自上海克隆生物高技术有限公司,人抗大鼠Drp-1多克隆抗体购自圣克鲁斯生物技术公司、SABC免疫组化染色试剂盒购自武汉博士德生物工程有限公司。
1.2 分组、干预和取材 将大鼠均分为假手术组、对照组和EPO组,每组27只。对照组和EPO组采取左侧输尿管结扎并剪断建立单侧输尿管梗阻(UUO)模型[4],假手术组仅游离输尿管而不结扎和剪断。EPO组于术后给予3 000 U·kg-1EPO皮下注射[5];假手术组和对照组给予等量生理盐水皮下注射。3组均于术后7、14、21d处死9只大鼠,心脏采血检测SCr和BUN水平。并留取梗阻侧肾脏标本,置于10%甲醛溶液固定,石蜡切片3μm厚,用于苏木精-伊红、Masson和免疫组化染色。
1.3 肾脏组织病理 苏木精-伊红和Masson染色后在IDA-2000高清晰度数码图像分析系统下分析。每张切片选取10个不重叠视野。Masson染色后测定肾间质纤维化面积与同视野肾间质总面积的百分比,取平均值作为每张切片的肾间质纤维化相对面积。苏木精-伊红染色后对肾间质损伤进行半定量评分,取其平均积分为每张切片评分,评分标准:无病变为0分,<25%为1分,~50%为2分,>50%为3 分[6]。
1.4 免疫组化染色 用SABC法检测肾组织中的Drp-1表达,操作步骤按试剂盒说明书进行。光镜下组织切片呈棕黄色颗粒沉积区域为阳性染色部位,高倍镜(×400)下在每张不包含肾小球和血管的肾间质区域选取10个不重叠的视野,应用IDA-2000高清晰度数码图像分析系统进行图像采集,经灰度变换为阳性染色区域面积与该视野总面积百分比,计算平均值[7]。
表1 3组大鼠不同时点血肌酐和尿素氮水平比较±s)Tab 1 SCr and BUN levels atdifferent time points in three groups of rats( ± s)

表1 3组大鼠不同时点血肌酐和尿素氮水平比较±s)Tab 1 SCr and BUN levels atdifferent time points in three groups of rats( ± s)
Notes 1)vs sham group,(P<0.05);2)vs control group,(P<0.05)
Groups day 7 day 14day 21 SCr/μmol·L -1 Sham(n=9) 38±4 43±5 44±5 Control(n=9) 84±41) 108±61) 157±61)EPO(n=9) 60 ± 2.781,2) 74 ± 71,2) 113 ± 61,2)F 146.293 214.086 207.425 (P<0.001) <0.001 <0.001 BUN/mmol·L-1 Sham(n=9) 5.7±0.1 6.0±0.4 6.3±0.1 Control(n=9) 8.6±0.31) 17.6±0.21) 24.6±1.41)EPO(n=9) 6.5 ± 1.31,2)12.0 ± 0.61,2)16.8 ± 0.51,2)F 79.264 113.489 161.731 (P<0.001) <0.001<0.001
2 结果
2.1 肾功能检测结果 表1显示,各时点对照组和EPO组SCr、BUN水平较假手术组显著增高(P均<0.01),EPO组SCr和BUN水平显著低于对照组,差异有统计学意义((P<0.05))。
2.2 肾脏组织学改变 苏木精-伊红染色结果显示,假手术组大鼠术后各时点肾组织可见少量炎症细胞浸润,肾小球、近端小管、远端小管的大小和形态正常,未见小管扩张及纤维增生等改变(图1A~C)。对照组大鼠术后第7天可见肾小管上皮细胞胞浆疏松、肿胀空泡变性、间质水肿,部分细胞嗜酸性变,并可见肾小管灶性萎缩、管腔轻度扩张,部分小管管腔内见蛋白管型及上皮细胞管型,小管间质稍增宽,其间可见成纤维细胞轻度增生及少量淋巴细胞为主的炎细胞局灶性浸润(图1D);术后第14天,肾小管上皮细胞肿胀空泡变性明显,部分肾小管遭到严重破坏而消失,肾小管和集合管扩张成囊状,小管间质明显增宽,间质内可见弥漫性巨噬细胞和淋巴细胞浸润,伴有较多成纤维细胞增生(图1E);术后第21天,肾间质炎细胞浸润稍减少,皮髓质变薄,肾小管上皮细胞空泡变性严重,大部分肾小管上皮细胞脱落坏死、萎缩和消失,残余肾小管显著扩张,间质面积进一步增宽(图1F)。EPO组各观察时点病理改变较对照组明显减轻(图1G~I)。
表2显示,EPO组各时点肾小管间质损伤评分均低于对照组(P均<0.05),但高于假手术组((P<0.05))。
Masson染色结果显示,假手术组各时点肾脏病理无明显变化(图2A~C)。对照组术后第7天可见肾间质增宽,间质细胞及细胞外基质成分增多,皮质区和皮髓交界区出现纤维化(图2D);术后第14天,皮质区和皮髓交界区纤维化明显(图2E);术后第21天,肾间质进一步增宽,间质细胞及细胞外基质成分明显增多,肾间质纤维化程度较前明显加重(图2F);EPO组各时点肾组织病理改变较对照组减轻(图2G~I)。
表2显示,与对照组比较,EPO组各时点肾间质纤维化相对面积明显减小((P<0.05)),但高于假手术组((P<0.05))。
2.3 免疫组织化学结果 假手术组各时点Drp-1微量表达于肾间质和肾小管上皮细胞(图3A~C),对照组Drp-1表达位于肾小管上皮细胞胞浆及肾间质,表达量随梗阻时间延长逐渐升高(图3D~F)。EPO组与对照组相比,表达部位基本一致,但范围缩小,强度减弱(图3G~H)。表2显示,对照组和EPO组各时点Drp-1相对表达面积较假手术组显著增加(P均<0.05),EPO组与对照组相比,表达显著下降((P<0.05))。

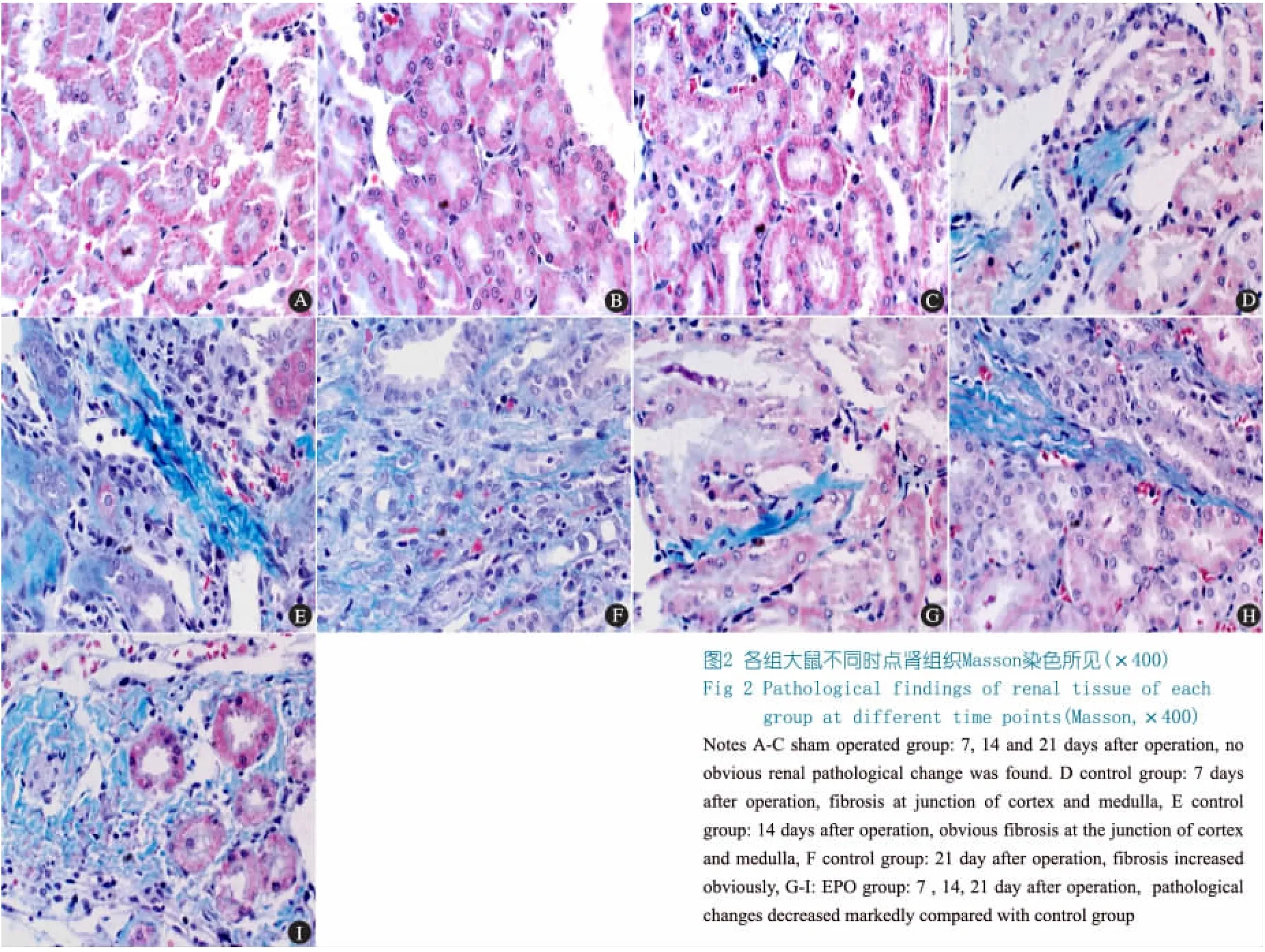
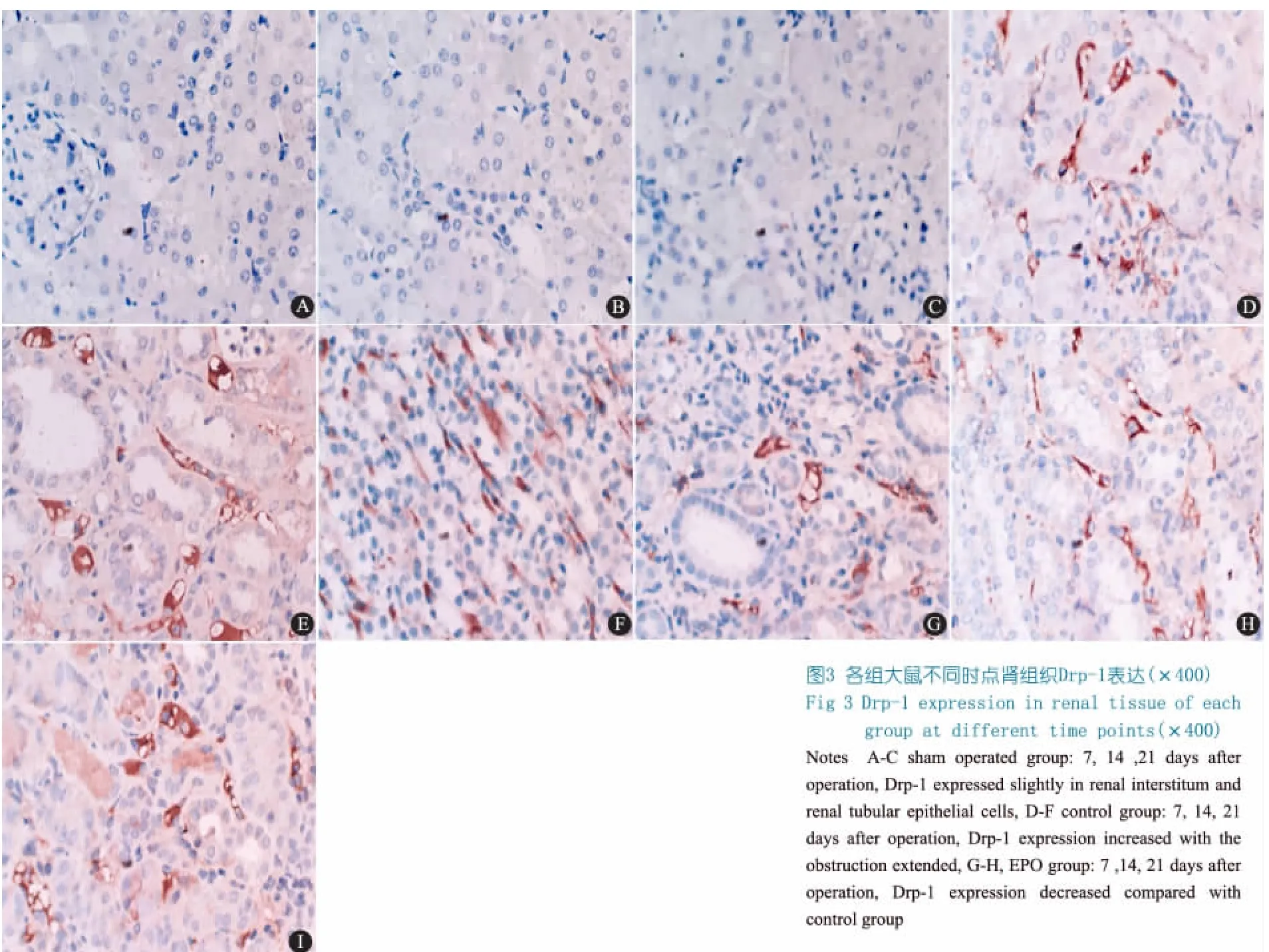
表2 3组大鼠不同时点肾小管间质损伤评分、肾间质纤维化相对面积和Drp-1相对表达面积比较(%±s)Tab 2 Renal interstitial injury score,renal interstitial fibrosis relative area and expression of Drp-1 relative area atdifferent time points of three groups of rats(% ±s)

表2 3组大鼠不同时点肾小管间质损伤评分、肾间质纤维化相对面积和Drp-1相对表达面积比较(%±s)Tab 2 Renal interstitial injury score,renal interstitial fibrosis relative area and expression of Drp-1 relative area atdifferent time points of three groups of rats(% ±s)
Notes 1)vs sham group,(P<0.05);2)vs control group,(P<0.05)
Groupsday 7day 14day 21 Renal interstitial injury score Sham(n=9) 0.49±0.03 0.51±0.07 0.52±0.04 Control(n=9) 3.4±0.21) 5.1±0.31) 6.4±0.31)EPO(n=9) 2.3 ± 0.21,2) 3.9 ± 0.21,2) 5.0 ± 0.31,2)F 46.274 103.655 116.937 (P<0.001) <0.001 <0.001 Renal interstitial fibrosis relative area Sham(n=9) 1.6±0.09 1.7±0.1 1.9±0.2 Control(n=9) 14.4±0.61) 27.9±1.41) 53.2±2.41)EPO(n=9) 9.8 ± 0.61,2)17.4 ± 0.81,2)31.3 ± 1.91,2)F 85.033 126.572 187.836 (P<0.001) <0.001 <0.001 Expression of Drp-1 relative area Sham(n=9) 0.9±0.09 1.0±0.1 1.1±0.2 Control(n=9) 9.9±0.41) 16.4±0.61) 25.7±0.21)EPO(n=9) 6.0 ± 0.21,2)11.3 ± 0.11,2)18.6 ± 0.21,2)F 153.628 428.371 507.845 (P<0.001) <0.001<0.001
2.4 Drp-1与肾间质损伤的相关性 对照组和EPO组Drp-1相对表达面积与肾小管间质损伤、肾间质纤维化相对面积呈正相关(r分别为0.923和0.895,P均<0.05)。
3 讨论
肾间质纤维化是各种不同病因的慢性肾脏疾病发展至终末期肾功能衰竭的共同途径和最终结果,以肾间质成纤维细胞增生及细胞外基质的过度积聚为病理特征[8]。有研究显示,在肾间质纤维化的发病中,肾小管上皮细胞的凋亡与肾小管的萎缩关系密切,成纤维细胞的增殖凋亡指数的增高是细胞外基质形成的一个原因[9]。间质纤维化程度与细胞凋亡数量呈正相关[10]。细胞凋亡的主要过程是线粒体断裂。哺乳动物细胞中Drp-1是线粒体分裂的重要执行分子。Drp-1主要位于细胞浆,并以多聚体的形式存在,当受到线粒体外膜分子的招募可以转位至线粒体外膜,并且集中于线粒体潜在的分裂位点。多个Drp-1分子包围线粒体最终致线粒体断裂,诱导细胞凋亡[11,12]。本研究结果显示,随着梗阻时间的延长,对照组Drp-1表达量逐渐增加,Drp-1的表达量与肾间质损伤评分、肾间质纤维化相对面积呈正相关。提示Drp-1参与了肾间质纤维化的发生发展过程。
EPO是骨髓动员刺激因子,由肾脏和肝脏合成,是多功能细胞因子超家族成员。研究发现,EPO除能改善贫血的作用外,还有抑制炎症反应、促进血管生长、抑制细胞凋亡、减少细胞因子及炎症因子的表达,保护受损器官的作用。近年来动物实验表明,EPO可延缓慢性肾病的进展,改善肾间质纤维化的程度,有一定的肾保护作用[13]。有研究[14]发现,EPO能通过抗氧自由基,提高机体内源性抗氧化能力,对急性肾小管坏死大鼠肾脏起到保护作用。研究还发现EPO可以抑制线粒体膜电位下降、线粒体敏感钾通道开放及膜间隙促凋亡蛋白释放等一系列凋亡事件[15]。Nakazawa等[16]研究表明,EPO可抑制肾小管细胞凋亡,从而减轻肾间质纤维化的程度。本研究结果亦说明EPO可减少肾间质炎症细胞浸润,以及下调Drp-1的表达,肾间质纤维化的程度明显减轻,BUN及SCr水平较对照组有所下降,但上述观察指标EPO组仍与假手术组有显著差异,提示EPO对肾间质纤维化有一定程度的延缓作用,但似乎不能逆转肾纤维化和肾功能损害的进程。EPO的作用机制可能是通过减少炎症细胞浸润,抑制Drp-1在肾组织的表达,减轻细胞凋亡,而发挥其减少肾间质纤维化的作用。
本研究通过建立肾间质纤维化大鼠模型,同时予EPO干预治疗,结果表明了Drp-1的过度表达可能是导致肾间质纤维化的机制之一,而EPO可能通过抑制UUO大鼠肾组织中Drp-1的表达,延缓肾间质纤维化的进程,对肾脏发挥保护作用,但EPO通过何种机制抑制UUO大鼠肾组织Drp-1的表达,尚待进一步研究。
[1] Nangaku M.Mechanisms of tubulointerstitial injury in the kidney:final common pathways to end-stage renal failure.Intern Med,2004,43(1):9-17
[2] Strutz F.Pathogenesis of tubulointerstitial fibrosis in chronic allograft dysfunction.Clin Transplant, 2009, 23(21):26-32
[3]Hidenori O,Katsuyoshi M.Molecular mechanisms and physiofogie functions of rnitochondrial dynamics.J Biochem,2011,149(3):241-251
[4] Chevalier RL,Forbes MS,Thornhill BA.Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy.Kidney Int,2009,75(11):1145-1152
[5]Solling C,Christensen AT,Kraq S, et al.Erythropoietin administration is associated with short-term improvement in glomerular filtration rate after ischemia-reperfusion injury.Acta Anaesthesiol Scand,2011,55:185-195
[6]Pang M, Kothapally J, Mao H, et al.Inhibition of histone deacetylase activity attenuates renal fibroblast activation and interstitial fibrosis in obstructive nephropathy.Am J Physiol Renal Physiol, 2009, 297(4):996-1005
[7]Cregger M, Berger AJ, Rimm DL.Immunohistochemistry and quantitative analysis of protein expression.Arch Pathol Lab Med, 2006,130(7):1026-1030
[8]Hewitson TD, Ho WY, Samuel CS.Antifibrotic properties of relaxin:in vivo mechanism of action in experimental renal tubulointerstitial fibrosis.Endocrinology, 2010,151(10):4938-4948
[9]Yang T,Vesey DA,Johnson DW, et al.Apoptosis of tubulointerstitial chronic inflammatory cells in progressive renal fibrosis after cancer therapies.Transl Res, 2007,150(1):40-50
[10]Izquierdo MC, Sanz AB, Mezzano S,et al.TWEAK(tumor necrosis factor-like weak inducer of apoptosis)activates CXCL16 expression during renal tubulointerstitial inflammation.Kidney Int,2012 81(11):1098-1107
[11]Claudia FR,Jorge AL,Julia S,et al.SUMOylation of the mitochondrial fission protein Dtpl occurs at multiple nonconsensus sites within the B domain and is linked to its activity cycle.FASEB J,2009,23(11):3917-3927
[12]Craig B,Sung GC,Wang CY,et al.Fragmented mitochondfia are sensitized to Bax insertion and activation during apoptosis.Am JPhysiol Cell Physiol,2011,300(3):447-455
[13]Kitamura H,Isaka Y,Takabatake Y, et al.Imai E.Nonethropoietic derivative of erythropoietin protect against tubulointerstitial injury in a unilateral ureteral obstruction model.Nephrol Dial Transplant, 2008, 23(5):1521-1528
[14]Yu TH(余堂宏),Hu H,Liang W,et al.Experimental study on the therapy of acute renal necrosis using erythropoietin.The Journal of Practical Medicine(实用医学杂志),2009,25(23):3939-3940
[15]Zhao J,Dong WB,Li QP,et al.Mechanism of intraeellular signal transduction during injury of renal tubular cells induced by postasphyxil serum in neonates with asphyxia.Neonatology,2009,96(1):33-42
[16]Nakazawa Y,Nishino T,Obata K, et al.Recombinant human erythropoietin attenuates fenal tubulointerstitial injury in murine adriamycin-induced nephropathy.Nephrol, 2012, 8(10):5301-5303

