鸭肠炎病毒VP5蛋白单克隆抗体的制备及鉴定
李慧昕,刘胜旺,韩宗玺,邵昱昊,刘晓丽,华育平,刘 娣,孔宪刚
(1.东北林业大学博士后流动站 黑龙江省农业科学院博士后工作站,黑龙江 哈尔滨150086;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室 禽传染病研究室,黑龙江 哈尔滨150001)
鸭病毒性肠炎(Duck viral enteritis,DVE),是由鸭肠炎病毒(Duck enteritis virus,DEV)引起的鸭、鹅及多种雁形目禽类的一种急性、热性、败血性传染病[1]。其特征是流行广泛,传播迅速,发病率和死亡率高[2]。1923年该病由Baudet 首次在荷兰报道,我国于1957年首次暴发鸭病毒性肠炎[3],随后该病在华南、华中和华东等养鸭较发达的地区发生流行,给养鸭业造成巨大的经济损失[4]。水禽和候鸟是本病病原的储存宿主,且带毒长达4年之久[5],为本病的有效防控带来困难。
第9次国际病毒分类报告将DEV归类为疱疹病毒科、α-疱疹病毒亚科、马立克病毒属成员。DEV具有疱疹病毒典型结构特征,病毒DNA核心外依次包被着衣壳、皮层和囊膜[6-7]。病毒衣壳至少由7个蛋白组成,包括 VP5(UL19)、VP19C(UL38)、P21前体(UL26)、p22a(UL26.5)、VP23(UL18)、VP24(UL26)和VP26(UL35),其中 VP5为病毒的主要衣壳蛋白,占病毒衣壳总成分的60%~70%[8]。在单纯疱疹病毒(HSV-1)和水痘带状疱疹病毒(VZV)感染宿主后,VP5是引起机体产生体液免疫的主要抗原之一[9-11]。在疱疹病毒中VP5同源蛋白较为保守且功能相近[12-13],因此推测,DEV VP5在病毒感染过程中发挥相似的作用。
DEV基因组解析相较其他疱疹病毒滞后,DEV VP5在病毒复制过程中的功能尚未见报道。本研究制备DEV VP5蛋白的单克隆抗体,为VP5蛋白的抗原表位研究及其在病毒复制过程中的功能研究提供了有效工具,同时为建立鸭病毒性肠炎检测方法奠定基础。
1 材料与方法
1.1 病毒与细胞 鸭肠炎病毒DEV Clone-03株由中国农业科学院哈尔滨兽医研究所禽传染病研究室保存,SP2/0细胞由中国农业科学院哈尔滨兽医研究所禽传染病研究室保存。
1.2 实验动物及主要试剂 6~8周龄雌性BABL/c小鼠由哈尔滨兽医研究所实验动物中心提供。HAT、HT、聚乙二醇(PEG1500),购自 Gibco公司;羊抗鼠HRP-IgG,购自Sigma公司;IgG抗体亚类试剂盒为Southern Biotech公司产品;免疫用抗原VP5-C蛋白由本研究室表达及纯化。
1.3 动物免疫 以本研究室制备的DEV Clone-03 VP5-C蛋白作为抗原,免疫8周龄雌性BABL/c小鼠。首次免疫,抗原与等体积SEPPIC IMS1312佐剂乳化,腹部皮下及背部皮下多点注射,50μg/只鼠。每隔两周进行加强免疫,共计免疫3次,剂量及免疫途径同首免。三免后2周,进行加强免疫,采取腹腔及尾静脉注射50μg VP5-C抗原,于末次免疫后3d无菌取出脾细胞与SP2/0进行融合。
1.4 细胞融合 按常规方法进行细胞融合,取免疫鼠脾细胞与骨髓瘤细胞SP2/0按细胞数量4∶1混合,以50%PEG为融合剂,将融合的细胞铺到已加有饲养细胞的96孔培养板中,100μL/孔,置37℃,5%CO2培养箱中培养。融合后的细胞每3天更换培养基1次,使用含有HAT或HT培养基作为筛选培养液。待杂交瘤细胞长至孔底部的1/3~1/2时,于换液后3~4d取细胞培养上清100μL,用建立的ELISA检测方法进行检测,以免疫小鼠血清为阳性对照、未免疫小鼠血清及SP2/0上清为阴性对照。将ELISA检测阳性孔的细胞进行亚克隆,采用有限稀释法进行。亚克隆3~4次,直至所有克隆化细胞孔检测阳性率为100%。
1.5 单克隆抗体腹水的制备 给经产BALB/c小鼠腹腔注射液体石蜡,0.5mL/只。1周后,腹腔注射杂交瘤细胞悬液(1~2×106个/mL),0.5mL/小鼠。待小鼠腹部明显膨大,行动不便时,无菌取腹水,三氯甲烷处理去脂,分装,-70℃保存。
1.6 单克隆抗体特性的鉴定
1.6.1 染色体计数 按常规方法进行,选取SP2/0细胞及杂交瘤细胞,在细胞处于对数生长期时,向细胞培养瓶内加入秋水仙素,使其终浓度为0.1μg/mL,37℃,5%CO2继续培养5h,1 000r/min离心5 min,收集细胞,加入5mL 0.075mol/L KCl进行低渗处理,37℃温育30min。向细胞悬液中加入固定液(甲醇∶冰醋酸=3∶1)1mL,混匀,1 000r/min离心5min。弃上清,加入固定液5mL,将细胞悬浮,室温静置30min,1 000r/min离心5min;重复操作1次。加入固定液5mL,悬浮细胞,将细胞悬液滴在预先冰冻的载玻片上,自然扩散,自然干燥。姬姆萨染色液染色,室温30min,洗掉染色液,自然干燥,显微镜下选择10个细胞形态完整、单在、染色体分散良好、无重叠、无散失的细胞进行观察及染色体计数分析,求出平均染色体数目。
1.6.2 抗体亚类的测定 采用SBAClonotypingTMSystem/HRP抗体亚类试剂盒测定,按说明书进行操作。
1.6.3 抗体特异性鉴定 将超速离心的DEV clone-03全病毒行SDS-PAGE,将蛋白转印至 NC膜,Western blot检测分泌抗体阳性的细胞株培养上清。用杂交瘤细胞株培养上清作一抗,羊抗鼠HRP-IgG作为二抗,DAB显色液显色。
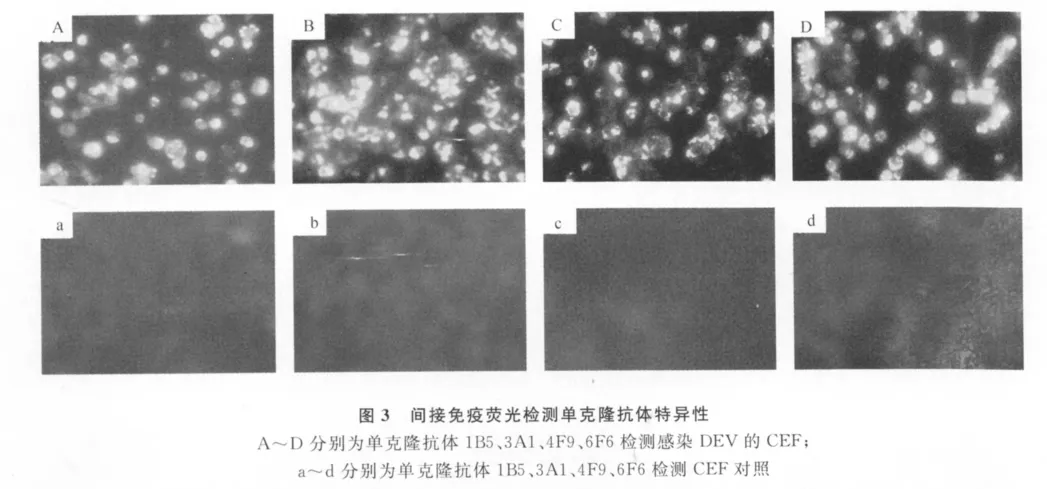
同时采用间接免疫荧光方法检测杂交瘤细胞分泌上清与病毒感染细胞的特异性反应。将DEV clone-03接种生长良好的CEF单层,当细胞病变达到60%~70%时,弃掉上清,细胞用PBS轻洗3次,加入少量胰酶消化细胞,用PBS将细胞吹下,1 000 r/min离心10min,PBS洗涤1次,制片,自然干燥,冷丙酮4℃固定15min,自然干燥后用PBST洗涤3次,自然干燥。以杂交瘤细胞分泌的上清为一抗,以抗鼠FITC-IgG为二抗(1∶100稀释),荧光显微镜观察。同时设未感染CEF为对照。
1.6.4 腹水效价的测定 抗DEV VP5单克隆抗体腹水效价用ELISA方法测定。将所获得的腹水作1∶1×103、1∶2×103、1∶4×103、倍比稀释至1∶4 096×103,共计12个稀释倍数。用已经建立的最佳蛋白(VP5-C)包被浓度包被ELISA板,检测腹水效价。以阳性血清、腹水稀释液、阴性血清和SP2/0细胞的腹水作对照。具体判定标准为:阴性血清OD值<0.2,阳性血清OD值>1.0,检测样品OD值>0.2,P/N>2.1时腹水的最大稀释倍数为腹水的ELISA效价。
2 结果
2.1 杂交瘤细胞株的建立 融合细胞经HAT筛选,于融合后3~5d显微镜观察,计数出现明显细胞克隆的培养孔,其融合率为84.35%。应用VP5-C蛋白包被ELISA板,用已建立的间接ELISA方法检测上清,共计获得4株单克隆抗体。将ELISA和Western blot检测阳性细胞进行克隆,经过3次克隆,所有细胞集落克隆孔检测为均为阳性,表明获得了稳定分泌的单克隆抗体,将获得的4株单克隆抗体命名为1B5、3A1、4F9、6F6。
2.2 单克隆抗体特性鉴定
2.2.1 腹水效价的测定 将杂交瘤细胞株注射BALB/c小鼠,制备腹水,用已建立的检测方法测定腹水的ELISA效价。单克隆抗体1B5、3A1、4F9、6F6腹水ELISA效价分别为1∶2 048×103、1∶512×103、1∶1 024×103、1∶512×103。
2.2.2 杂交瘤细胞染色体分析 随机选择细胞形态完整、染色体分散均匀的10个视野的染色体进行计数,计算平均数,得到各杂交瘤细胞染色体平均数。本研究获得的杂交瘤细胞株染色体数目为95~102,均高于小鼠脾细胞染色体数目(2n=40)和SP2/0细胞染色体数目(2n=62~68),融合后的杂交瘤细胞染色体数目接近两种亲本之和,表明获得的分泌抗体的细胞株为小鼠脾细胞和骨髓瘤细胞融合后的杂交瘤细胞(图1)。

图1 杂交瘤细胞株的染色体分析A~D分别为杂交瘤细胞株1B5、3A1、4F9、6F6;E为骨髓瘤细胞SP2/0
2.2.3 单克隆抗体亚类鉴定 采用SBAClonotypingTMSystem/HRP抗体亚类试剂盒检测,应用分泌抗体阳性杂交瘤细胞上清检测单克隆抗体亚类。结果表明,获得的4株单克隆抗体均为IgG、k链抗体。
2.2.4 单克隆抗体特异性鉴定 为了检测所获得的单克隆抗体是否特异地针对DEV clone-03VP5蛋白,我们采用Western blot方法检测杂交瘤细胞分泌上清对全病毒的反应原性,结果表明,获得的单克隆抗体能够特异识别DEV clone-03VP5蛋白,大小约为150kDa(图2)。

应用间接免疫荧光方法,应用杂交瘤细胞分泌上清检测DEV clone-03,结果表明,单克隆抗体能够与DEV clone-03发生抗原抗体反应,能够识别天然构象的 DEV clone-03VP5蛋白(图3)。
3 讨论
鸭病毒性肠炎传播迅速,死亡率较高,尽管现有疫苗保护效果较好,但是水禽和候鸟带毒为本病的清除带来困难。因此,建立有效的鸭病毒性肠炎检测方法将对该病的防控提供有效手段。免疫学诊断方法以其特有的优势成为实践中检测病原体的常用方法,特异性和准确性直接取决于诊断试剂。而单抗隆抗体纯度高、专一性强、重复性好且能在动物体外或体内产生同质性抗体,以它作为诊断抗体能克服多克隆抗血清诊断时稳定性差及特异性低等缺点。
疱疹病毒VP5是较大的病毒衣壳蛋白,其内含有多处保守结构域[14]。DEV VP5基因由4 143核苷酸组成,编码约150kDa蛋白,与HSV-1VP5蛋白大小相似。由于VP5较大,原核表达全长较为困难,因此本研究组对VP5蛋白进行截短表达,并以纯化的DEV VP5-C蛋白作为免疫原,制备单克隆抗体,共获得了4株能够稳定分泌抗DEV VP5特异性抗体的杂交瘤细胞株。在筛选抗体分泌阳性杂交瘤细胞时,应用纯化的VP5-C蛋白包被ELISA板,进行ELISA筛选,同时为了排除非特异性杂交瘤细胞的干扰,将ELISA筛选阳性细胞株分泌上清用Western blot方法进行检测,以DEV全病毒作为抗原,检测抗体的特异性。本研究对单克隆抗体进行了3次克隆筛选,每次筛选都采用ELISA和Western blot两种方法进行检测,确保单克隆抗体的特异性。
本研究对获得的4株单克隆抗体进行中和活性检测,结果表明,4株单克隆抗体均不具有中和活性,这可能与衣壳蛋白外包被有囊膜有关,同时也与单克隆抗体所针对的抗原表位在衣壳蛋白中所处位置有关[15]。HSV-1VP5蛋白具有3个功能域,分别为底部、中部和上部功能域[16],通过比对DEV VP5与HSV-1VP5蛋白,发现DEV VP5也具有这3个功能域,但是获得的4株单克隆抗体识别功能域的位置还需要进一步研究证实。单克隆抗体的获得为进一步研究VP5功能,并确定VP5的B细胞抗原表位提供有效的工具,同时也为下一步探索开发有效的诊断方法提供基础。
[1] Davison S,Converse K A,Hamir A N,etal.Duck viral enteritis in Muscovy ducks in Pennsylvania[J].Avi Dis,1993,37(4):1142-1146.
[2] Sandhu T S,Shawky S A.Duck virus enteritis(duck plagure)[M]//Saif Y M,Varnes H J,Glisson J R,etal.11th Eds Disease of Poultry Ames:Iowa State University Press,2003:354-363.
[3] 黄引贤.拟鸭瘟的研究[J].华南农学院学报,1959(1):1-12.
[4] 甘孟侯.中国禽病学[M].北京:中国农业出版社,1999.
[5] Shawky S,Schat K.Latency sites and reactivation of duck enteritis virus[J].Avi Dis,2002,46(2):308-313.
[6] Breese S S,Dardiri A H.Electron and microscopic character-ization of duck plague virus[J].Virology,1968,34(1):160-169.
[7] Yuan G,Cheng A,Wang M,etal.Electron microscopic studies of the morphogenesis of duck enteritis virus[J].Avi Dis,2005,49(1):50-55.
[8] Newcomb W W,Brown J C,Booy F P,etal.Nucleocapsid mass and capsomer protein stoichiometry in equine herpesvirus 1:scanning transmission electron microscopic study[J].J Virol,1989,63(9):3777-3783.
[9] Eberle R,Mous S W.Relative titers of antibodies to individual polypeptide antigens of herpes simplex virus type 1in human sera[J].J Infect Dis,1983,148(3):436-444.
[10]Scherba G,Truek J J,Gustafson D P.Pseudorabies nucleocapsid antigen for skin testing in swine[J].J Clin Micorbiol,1983,17(3):539-544.
[11]Vafai A,Wroblewska A,Graf L.Antigenic cross-reaction between a varicella-zoster virus nucleocapsid protein encoded by gene 40and a herpes simplex virus nucleocapsid protein[J].Virus Res,1990,15(2):163-174.
[12]Davison A J,Wilkie N M.Location and orientation of homologous sequences in the genome of five herpesviruses[J].J Gen Virol,1983,64(Pt9):927-1942.
[13]Mukai T,Isegawa Y,Yamanishi K.Idenfication of the major capsid protein gene of human herpesvirus 7[J].Virus Res,1995,37(1):55-62.
[14]Kopácek J,Kl′ucár L,KoptidesováD,etal.Nucleotide sequence of the gene encoding the major capsid protein of herpesvirus of turkeys[J].Virus Genes,2000,20(2):107-115.
[15]Tran R K,Lieu P T,Aguilar S,etal.Altering the expression kinetics of VP5results in altered virulence and pathogenesis of herpes simplex virus type 1in mice[J].J Virol,2002,76(5):2199-2205.
[16]Zhou Z H,Chen D H,Jakana J,etal.Visualization of tegument-capsid interactions and DNA in intact herpes simplex virus type 1virions[J].J Virol,1999,73(4):3210-3218.

