人脐血间充质干细胞移植对创伤性脑损伤大鼠VEGF分泌及血管新生的影响
赵俊暕 陈乃耀 石峻 王沂 孟爱国 韩晓燕 赵辉
创伤性脑损伤(traumatic brain injury,TBI)是威胁公众健康的普遍问题。Marshall[1]等发现死于TBI的患者90%有缺血性改变,缺血是继发性损害的主要机制。脑损伤灶周围组织的新生血管形成是改善血循环的物质前提,也是神经细胞间突触联系、功能重建的基础[2]。近年来人脐血间充质干细胞(mesenchymal stem cell,MSCs)的深入研究,为脑损伤的治疗及修复提供了新的思路[3]。本研究拟利用大鼠TBI模型,观察人脐血MSCs在大鼠脑内的迁移、分布,大鼠脑组织病理变化及干细胞移植后大鼠神经功能恢复情况,以及人脐血MSCs对损伤脑组织血管内皮细胞生长因子(vascular epidemal growth factor receptor,VEGF)、VEGF受体2(VEGF-R2)分泌与血管新生的影响,探讨人脐血MSCs移植的脑保护作用机制,期望为脑损伤的干细胞治疗提供相关理论依据。
1 材料和方法
1.1 材料
1.1.1 实验动物:清洁级健康雄性SD大鼠90只,购自北京维通利华实验动物技术有限公司,体质量250~350g,采取自然光照,自由进食喂养。
1.1.2 主要试剂和仪器:人脐血MSCs(中国医学科学院血液学研究所馈赠);鼠抗人Brdu单克隆抗体、SP-9002免疫组化试剂盒(北京博奥森生物技术公司);VEGF原位杂交检测试剂盒(天津灏洋生物制品公司);兔抗鼠 CD34、VEGF、VEGF-R2多克隆抗体、SABC即用型免疫组化试剂盒(武汉博士德生物工程有限公司);Image-Pro Plus 6.0数码医学图像分析系统(麦克奥迪仪器仪表有限公司)。
1.2 方法
1.2.1 MSCs标记:将人脐血 MSCs用完全DF-12培养液〔含10%(体积分数)FBS、100U/mL青霉素、100μg/mL链霉素、0.2mmol/L谷氨酰胺,均为培养液的终浓度〕常规细胞培养并换液至第4代,移植前72h于细胞培养基中加入Brdu(200 μmol/L)10μL。72h后,行Brdu细胞免疫组化链霉亲和素-生物素法(streptavidin-peroxidase,SP法)检测其标记率。细胞核内出现棕黄色颗粒为阳性,未着色为阴性。MSCs细胞的形态、生长及分化不受影响,标记率达到80~90%,可满足移植细胞的标记需要,即可用于下一步实验。
1.2.2 动物分组和TBI模型制作:将大鼠随机分为假手术组、损伤对照组(对照组)和实验组,每组均30只。对对照组和实验组采用改良Feeney自由落体方法[4]制作大鼠TBI模型。以10%(质量浓度)水合氯醛按体质量3mL/kg剂量腹腔注射麻醉大鼠后,固定于立体定向仪上,于矢状正中线切开头皮约2.0cm,分离皮下组织及骨膜。暴露前囟、冠状缝、矢状缝和双侧顶骨,于右侧冠状缝后4mm,中线旁开2mm,以磨钻磨除颅骨骨质,做一直径约5mm的骨窗,保持硬脑膜的完整。实验组和对照组均使用自由落体仪以20 g击锤从30cm高处自由坠落,撞击该处硬脑膜,缝合头皮。撞击致伤力为0.048N·s,造成中度脑挫裂伤。致伤后实验组和对照组所有大鼠均出现四肢抽搐,呼吸暂停数秒,术后昏迷2~10h,说明致伤成功,即TBI造模成功。假手术组只开骨窗,不撞击硬脑膜。在造模操作后24h,实验组所有大鼠均经鼠尾静脉缓慢注入3×106个/mL MSCs(以1mL PBS液溶解)1mL,留针5min后缓慢拔针;对照组和假手术组所有大鼠经鼠尾静脉注入等体积的PBS液(含NaCl 8g,KCl 0.2g,Na2HPO43.63g,KH2PO40.24g),注射后分笼喂养观察大鼠,注射后所余MSCs行台盼蓝染色检测细胞活性。注射后剩余细胞行台盼蓝染色,结果显示90%以上细胞存活,说明MSCs细胞经标记后生长存活基本不受影响,可满足移植细胞标记需要,可用于下一步实验。3组大鼠均未使用免疫抑制剂,所用试剂也无免疫抑制的作用。
1.2.3 神经功能评价:分别于注射后第3、7、14、21和28天处死大鼠之前,由不了解实验动物分组者参照Mahmood等[5]的方法,对对照组和实验组分别采用神经系统疾病严重程度评分(neurological severity score points,NSS)评价大鼠神经功能,包括运动、感觉、反射和平衡实验4部分,总分18分,13~18分表示严重损伤,7~12分表示中度损伤,1~6分表示轻度损伤。
1.2.4 脑组织标本制备和组织学评价:各组分别于注射后第3、7、14、21和28天,随机选取6只大鼠,经深度麻醉后处死,完整取出脑组织,切下损伤灶及其周边3mm区域的脑组织,固定24h,经脱水、透明、浸蜡、包埋、切片,厚度约5μm,每只鼠脑组织做6张切片。
(1)HE染色:取每组大鼠脑组织切片各6张,200倍光镜下分别观察三组大鼠脑组织细胞结构、胞质、胞核,脑组织坏死细胞存在及多少。
(2)脑组织中Brdu免疫组化表达:取上述损伤周边区脑组织切片每组大鼠各6张,进行Brdu免疫组织化学染色,按产品说明书进行。在400倍光镜下观察Brdu阳性细胞及其分布情况。随机观察损伤周边皮质区10个不重叠的视野(约0.25 mm2),计数Brdu阳性细胞平均数。细胞核内出现棕黄色颗粒为Brdu阳性,未着色为阴性。
(3)血管新生及血管相关细胞因子检测:取上述损伤周边区脑组织切片每组每个时间点各6张,应用抗CD34抗体免疫组化标记大鼠脑损伤周边区脑组织血管内皮细胞,CD34免疫组化(SABC链霉亲和素-生物素-复合物法)检测按产品说明书进行,以细胞质内出现棕黄色颗粒为阳性。微血管密度(microvessell density,MVD)计数按 Weidner等[6]的方法进行,在400倍镜下,每张切片在同一损伤周边皮质区选择10个视野(约0.25mm2)进行微血管计数,并计算MVD,记取均值。微血管的判定:任何染成棕黄色的内皮细胞或血管内皮细胞簇,只要它们和邻近的微血管、肿瘤细胞及其他结缔组织不相连,即作为可计数的微血管,血管腔及腔内的红细胞均不作为计数微血管的条件。
取上述损伤周边区脑组织切片每组每个时间点大鼠各6张,应用抗VEGF、VEGF-R2抗体标记大鼠脑损伤周边区脑组织VEGF和VEGF-R2,VEGF、VEGF-R2免疫组化(SABC 链霉亲和素-生物素-复合物法)检测均按产品说明书进行。以细胞质内出现棕黄色颗粒为阳性,未着色者为阴性。用原位杂交法检测VEGF mRNA,采用地高辛标记的VEGF mRNA寡核苷酸探针标记大鼠脑损伤周边区脑组织血管内皮生长因子mRNA,检测按试剂盒说明,其阳性细胞为胞质内出现棕黄色颗粒者,未着色为阴性。通过Image-pro plus 6.0医学图像分析系统测定吸光度〔D(λ)〕值,并根据所得 D(λ)值推导 VEGF、VEGF-R2及 VEGF mRNA阳性细胞的数量。D(λ)值越大,表示细胞数量越多。
1.3 统计学处理 采用SPSS 16.0软件进行分析。数据以均数±标准差表示。同一时间点三组中组间两两比较采用卡方检验,同一组中不同时间点比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠NSS评分 实验组大鼠均未发现免疫排斥反应。假手术组NSS评分均为0。注射后第7、14、21、28天,实验组NSS评分均低于对照组(P<0.05)(表1)。
2.2 MSCs移植后脑组织形态学表现 光镜下假手术组大鼠脑组织细胞结构基本正常,未见明显病理改变。胞质被染成淡红色,胞核呈蓝色,部分细胞可见核仁(图1A)。对照组大鼠脑组织受损皮层组织结构破坏,损伤中心区可见大量的坏死细胞,胞核皱缩,细胞结构消失(图1B)。实验组脑组织坏死范围缩小,细胞结构较对照组完整,细胞核固缩较对照组明显减轻(图1C)。
表1 注射后两组大鼠NSS评分比较 (,n=6)

表1 注射后两组大鼠NSS评分比较 (,n=6)
注:与对照组同一时点比较,*P<0.05,**P<0.01
组别3d 7d 14d 21d 28d实验组 10.20±0.51 5.82±0.65* 4.18±0.68** 4.02±0.54** 3.46±0.47**对照组 10.32±0.61 7.31±0.67 6.68±0.83 6.02±0.73 5.36±0.48
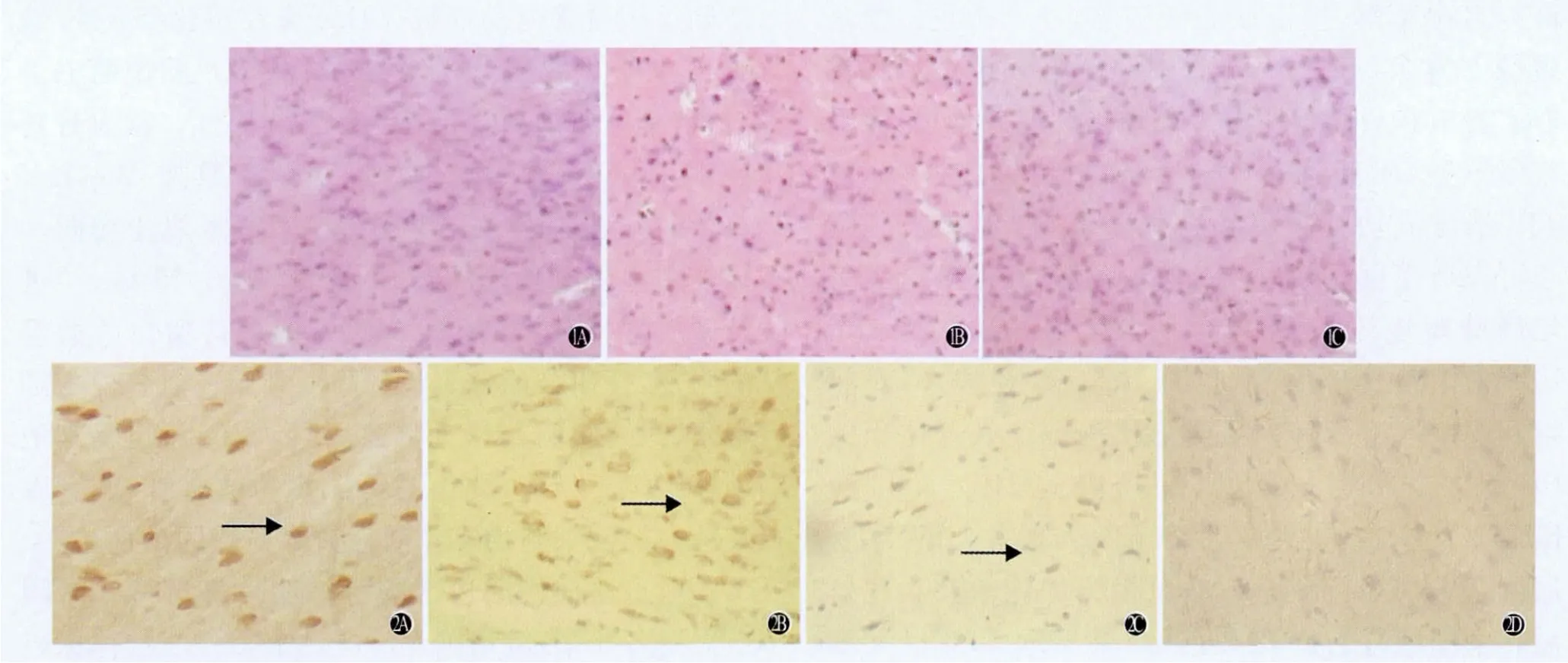
图1 各组大鼠经注射后3天脑损伤周边区组织形态学表现(HE×200)A:假手术组;B:对照组;C:实验组图2 各组脑组织Brdu阳性的MSCs细胞比较(免疫组化染色SABC法×200)A:实验组注射后第3天脑损伤灶周边区(箭头所示为Brdu标记的MSCs);B:实验组注射4周后脑损伤灶周边区;C:实验组注射后第3天脑损伤对侧脑组织;D:对照组注射后第3天
2.3 MSCs移植后在脑内的存活、分布 实验组注射后第3天可见Brdu标记阳性的MSCs聚集在损伤部位,分布均匀(图2A),4周后仍可见(图2B)。损伤对侧半球注射后第3天只见极少数的Brdu标记MSCs(图2C)。假手术组和对照组注射后第3天均未见Brdu标记的MSCs(图2D)。
2.4 脑组织损伤周围皮质区血管新生和细胞因子表达
2.4.1 大鼠脑损伤周边区MVD检测:造模操作后假手术组血管内皮细胞极少;对照组脑损伤周围皮质区有较多散在分布的单个血管内皮细胞;实验组脑损伤周围皮质区有较多单个血管内皮细胞和连成条索状的血管样结构。假手术组MVD值极低。对照组和实验组MVD值均于创伤后第14天达高峰,随后对照组MVD下降,实验组在创伤后第21、28天仍维持较高水平(对照组F=7.32,P<0.05;实验组F=4.06,P<0.05),各时间点实验组MVD值均高于对照组(P<0.01)(表2,图3)。
2.4.2 损伤周围皮质区脑组织VEGF蛋白表达:假手术组VEGF蛋白数量极少。注射后各时间点实验组在损伤周边区VEGF蛋白计数较对照组明显增多(P<0.05)。对照组和实验组VEGF蛋白计数在注射后第7天达高峰,随后对照组表达逐渐减弱,第21、28天实验组表达仍维持较高水平(对照组F=3.58,P<0.05;实验组F=4.17,P<0.05;表3,图4)。
2.4.3 损伤周围皮质区脑组织VEGF-R2蛋白表达:假手术组VEGF-R2蛋白数量极少。注射后各时间点实验组损伤周边区VEGF-R2蛋白较对照组明显增多(P<0.05);两组 VEGF-R2蛋白计数均在注射后第3天达高峰,随后对照组表达逐渐减弱,实验组在第21天、28天表达仍可维持较高水平(对照组F=4.53,P<0.05;实验组F=4.10,P<0.05;表4,图5)。
表2 CD34标记的大鼠脑损伤后各组皮层脑组织MVD值 (血管数/mm2,,n=6)

表2 CD34标记的大鼠脑损伤后各组皮层脑组织MVD值 (血管数/mm2,,n=6)
注:与假手术组同一时间点比较,*P<0.01;与对照组同一时点比较,ΔP<0.01
组别3d 7d 14d 21d 28d实验组 23.22±2.87*Δ 27.12±1.89*Δ 32.33±2.88*Δ 30.90±2.78*Δ 30.32±1.90*Δ对照组 17.73±1.78* 19.50±2.06* 22.05±2.31* 17.12±2.44* 13.20±1.98*假手术组2.3±0.3 2.2±0.3 2.3±0.2 2.3±0.3 2.2±0.2
表3 大鼠脑损伤后各组皮层区脑组织VEGF蛋白表达结果 〔D(λ)值,n=6〕
注:与假手术组同一时间点比较,*P<0.01;与对照组同一时点比较,ΔP<0.05,ΔΔP<0.01
组别3d 7d 14d 21d 28d实验组 0.52±0.05*Δ 0.62±0.08*Δ 0.56±0.08*ΔΔ 0.53±0.05*ΔΔ 0.51±0.05*ΔΔ对照组 0.41±0.05* 0.45±0.07* 0.38±0.04* 0.28±0.04* 0.19±0.03*假手术组 0.03±0.01 0.04±0.01 0.05±0.01 0.03±0.01 0.04±0.01

图3 各组大鼠经注射后14d脑损伤周边区MVD(图中箭头所示为CD34抗体标记的血管内皮细胞)(SABC法×400)图4 各组大鼠经注射后7d脑损伤周边区VEGF表达(箭头所示为抗VEGF抗体标记的VEGF阳性细胞)(SABC法×400)图5 各组大鼠经注射后3d脑损伤周边区VEGF-R2表达(箭头所示为抗VEGF-R2抗体标记的VEGF受体2阳性细胞)(SABC法×400)图6 各组大鼠经注射后3d脑损伤周边区VEGF mRNA表达(箭头所示为地高辛标记的VEGF mRNA阳性细胞)(原位杂交×400)
表4 大鼠脑损伤后各组皮层区脑组织VEGF-R2蛋白表达结果 〔D(λ)值,n=6〕
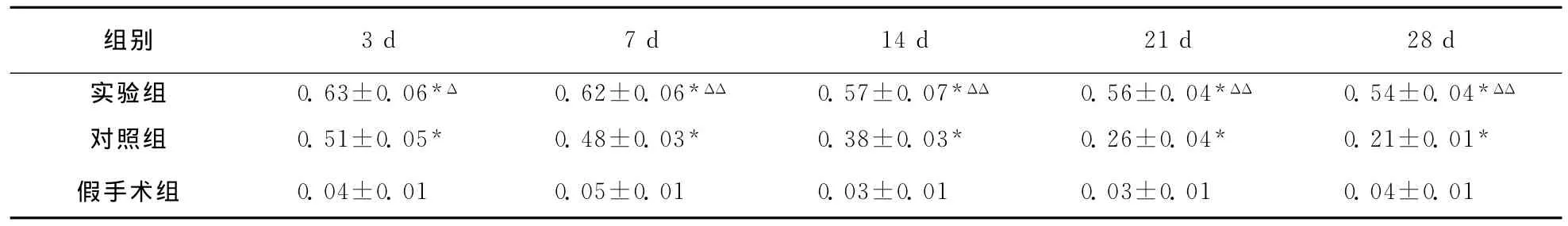
表4 大鼠脑损伤后各组皮层区脑组织VEGF-R2蛋白表达结果 〔D(λ)值,n=6〕
注:与假手术组同一时间点比较,*P<0.01;与对照组同一时点比较,ΔP<0.05,ΔΔP<0.01
组别3d 7d 14d 21d 28d实验组 0.63±0.06*Δ 0.62±0.06*ΔΔ 0.57±0.07*ΔΔ 0.56±0.04*ΔΔ 0.54±0.04*ΔΔ对照组 0.51±0.05* 0.48±0.03* 0.38±0.03* 0.26±0.04* 0.21±0.01*假手术组 0.04±0.01 0.05±0.01 0.03±0.01 0.03±0.01 0.04±0.01
表5 大鼠脑损伤后各组损伤周围区脑组织VEGF mRNA表达 〔D(λ)值,,n=6〕
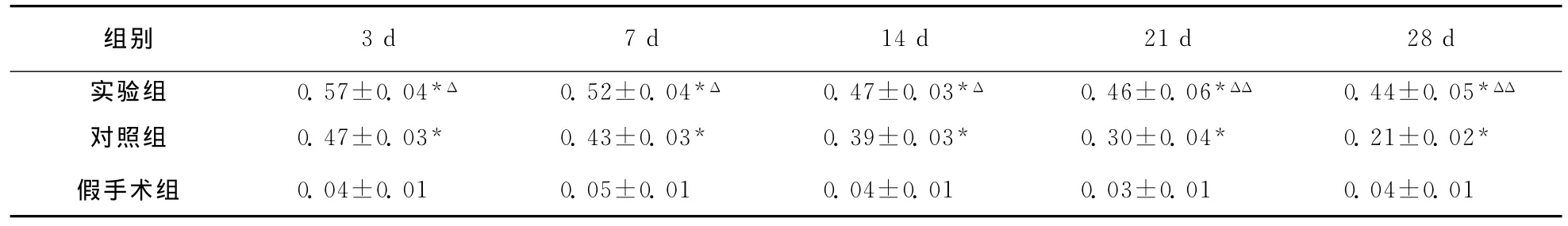
表5 大鼠脑损伤后各组损伤周围区脑组织VEGF mRNA表达 〔D(λ)值,,n=6〕
注:与假手术组同一时间点比较,*P<0.01;与对照组同一时点比较,ΔP<0.05,ΔΔP<0.01
组别3d 7d 14d 21d 28d实验组 0.57±0.04*Δ 0.52±0.04*Δ 0.47±0.03*Δ 0.46±0.06*ΔΔ 0.44±0.05*ΔΔ对照组 0.47±0.03* 0.43±0.03* 0.39±0.03* 0.30±0.04* 0.21±0.02*假手术组 0.04±0.01 0.05±0.01 0.04±0.01 0.03±0.01 0.04±0.01
2.4.4 损伤周围区脑组织VEGF mRNA表达 假手术组VEGF mRNA数量极少。相同时间点实验组VEGF mRNA较对照组明显增多(P<0.05);对照组和实验组VEGF mRNA均在3天达高峰,此后对照组表达逐渐减弱,实验组在21天、28天仍维持较高水平(对照组F=4.59,P<0.05;实验组F=5.00,P<0.05;表5,图6)。
3 讨论
MSCs的低免疫原性[7],使其很难被HLA不相容受体所识别,因而MSCs细胞可应用于异源性或异种的移植治疗中。大量研究报道骨髓MSCs移植用于治疗心肌缺血[8]、心肌梗死、急性肢体缺血[9]、脑出血、神经元变性疾病[10]均取得显著效果。但骨髓MSCs只能通过骨髓穿刺获取,可能对患者身心造成一定伤害,且这类细胞的增殖效率和分化潜能也会随着时间而减弱[11]。脐血源MSCs与骨髓源MSCs相比较,其来源广泛,取材方便,无伦理学争议,且干细胞量大、易于分离纯化;受病毒、细菌污染的机率很低[12-13],是一种可靠的细胞来源。
本实验中发现人脐血MSCs经静脉植入到大鼠TBI模型后,可在脑组织内环境中定居存活,并可短时间内趋向迁移到脑损伤周围皮质区,4周后仍可见存活MSCs,而对侧聚集较少,且均未发现免疫排斥反应,与Lu等[14]的研究较为一致,表明脐血MSCs免疫原性低,适合做供体细胞用于移植治疗。
研究发现人脐血MSCs和脂肪源成人MSCs在移植后没有高效分化出神经元的表型[15-16],而这些植入细胞能否与宿主脑组织建立起有功能的突触连接尚不能确定。因此TBI后神经功能的改善,还不能归功于移植细胞的转化替代。有研究表明神经营养因子对促进损伤神经元修复和再生具有很重要的作用[17]。本文作者前期的研究表明人脐血MSCs移植能显著上调脑组织损伤周边区因子BDNF和NGF的表达量和表达时间,显著降低细胞凋亡数量[18],可见 MSCs可由局部的因子分泌发挥作用。
有研究表明血管新生对于启动和促进损伤后的神经再生发挥着重要作用,尽快恢复内皮细胞的结构和功能、促进脑损伤缺血区新血管生成,可以改善脑组织代谢,促进半暗带区受损而未死亡的神经元的修复[19],诱导新的神经元发生;加速清除毒性产物;输送氧和营养成份,为植入的细胞成活、迁移和分化提供良好的微环境[20]。本研究中作者应用外源MSCs静脉植入TBI模型大鼠后,大鼠脑损伤周边区 VEGF mRNA、VEGF、VEGF-R2因子表达量显著上调、表达时间延长,放大了VEGF和VEGF-R 2蛋白参与脑损伤后血管新生和神经修复的反应过程,使损伤周边区新生血管数量明显增加,加速了神经功能恢复的速度。既往研究已明确VEGF具有促进血管生成的作用,其可能机制为移植的人脐血MSCs与脑组织微环境相互作用,促进血管新生因子的分泌,并且其本身也可能具有通过自分泌和旁分泌途径直接分泌VEGF等因子的潜在能力[21],增加缺血部位血管新生,进而使血供得到改善,有利于迁移至损伤缺血部位的人脐血MSCs和神经细胞的生存,进一步增加促血管新生因子的分泌。
综上可见,MSCs移植促进受损脑组织的神经功能修复的可能机制,除与增加神经营养因子表达有关外,尚可能通过促进损伤区VEGF、VEGF-R2表达和血管新生而实现,提示人脐血MSCs移植为TBI提供一种治疗新方法。
[1]Marshall LF.Head injury:Recentpast,present,and future[J].Neurosurgery,2000,47:546-561.
[2]Pandya NM,Dhalla NS,Santani DD.Angiogenesis—a new target for future therapy[J].Vascul PHarmacol,2006,44:265-274.
[3]Peter A Walker,Shinil K Shah.Progenitor cell therapies for traumatic brain injury:barriers and opportunities in translation[J].Dis Model Mech,2009,2:23-38.
[4]Feeney DM,Boyeson MG,Linn RT,et al.Responses to cortical injury:I.Methodology and local effects of contusions in the rat.Brain Res,1981,211:67-77.
[5]Mahmood A,Lu D,Wang L,et al.Treatment of traumatic brain injury in female rats with intravenous administration of bone marrow stromal cells [J].Neurosurgery,2001,49:1196-1203.
[6]Weidner N,Semple J P,Welch W R,et al.Tumor angiogenesis and metastasis correlation in invasive breast carcinoma[J].N Engle J Med,1991,324:1-8.
[7]Le Blanc K,Tammik C,Rosendahl K,et al.Hla expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells[J].Exp Hematol,2003,31:890-896.
[8]Tang J,Xie Q,Pan G,et al.Mesenchymal stem cells participate in angiogenesis and improve heart function in rat model of myocardial ischemia with reperfusion[J].Eur J Cardiothorac Surg,2006,30:353-361.
[9]Wu KH,Zhou B,Yu CT,et al.Therapeutic potential of human umbilical cord derived stem cells in a rat myocardial infarction model[J].Ann Thorac Surg,2007,83:1491-1498.
[10]Kassis I,Vaknin-Dembinsky A,Karussis D.Bone marrow mesenchymal stem cells:agents of immunomodulation and neuroprotection[J].Curr Stem Cell Res Ther,2011,6:63-68.
[11]Rao MS,Matton MP.Stem cells and aging:expanding the possibilities[J].Mech Ageing Dev,2001,122:713-734.
[12]Secco M,Zucconi E,Vieira NM,et al.Multipotent stem cells from umbilical cord:Cord is richer than blood[J].Stem Cells,2008,26:146-150.
[13]Baksh D,Yao R,Tuan RS.Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow[J].Stem Cells,2007,25:1384-1392.
[14]Lu D,Mahmood A,Wang L,et al.Adult bone marrow stromal cells administered intravenously to rats after traumatic brain injury migrate into brain and improve neurological outcome[J].Neuroreport,2001,12:559-563.
[15]Liao W,Xie J,Zhong J,et al.Therapeutic effect of human umbilical cord multipotent mesenchymal stromal cells in a rat model of stroke[J].J Transplantation,2009,87:350-359.
[16]Fatar M,Stroick M,Griebe M,et al.Lipoaspirate-derived adult mesenchymal stem cells improve functional outcome during intracerebral hemorrhage by proliferation of endogenous progenitor cells stem cells in intracerebral hemorrhages[J].J Neurosci Lett,2008,443:174-178.
[17]Qu R,Li Y,Gao Q,et al.Neutrophic and growth factor gene expression profiling of mouse bone marrow stromal cells induced by ischemic brain extracts[J].J Neuropathology,2007,27:355-363.
[18]安雅臣,王玉浔,陈乃耀,等.静脉注射人脐血间充质干细胞对脑损伤神经生长因子的影响[J].中华神经医学杂志,2010,9:1193-1196,1200.
[19]Hayashi T,Deguchi K,Nagotani S,et al.Cerebral ischemia and angiogenesis[J].Curr Neurovasc Res,2006,3:119-129.
[20]Zadeh G,Guha A.Angiogenesis in nervous system disorders[J].Neurosurgery,2003,53:1362-1374.
[21]Thomas Ziebart,Chang-Hwan Yoon.Sustained Persistence of Transplanted Proangiogenic Cells Contributes to Neovascularization and Cardiac Function After Ischemia[J].Circulation Research,2008,103:1327-1334.

