Th17细胞与重症肌无力发病及临床严重度相关性研究
王中魁 魏东宁 王卫 陈玉萍
重症肌无力(myasthenia gravis,MG)是一种T细胞辅助、抗体介导、补体参与的以神经肌肉接头传递障碍为特征的自身免疫性疾病,MG发病与乙酰胆碱受体自身抗体(anti-acetylcholine receptor autoantibodies,AChR-Ab)介导的体液免疫密切相关[1]。近年来研究发现免疫调节细胞参与MG发病。辅助性T细胞17(T helper type 17 cells,Th17细胞)是近年新发现的功能性CD4+T辅助细胞亚群,可特异性表达促炎因子IL-17[2],活化的 Th17细胞分泌IL-17A、IL-17F、IL-21、IL-22和TNF-α等细胞因子,通过诱发其他炎性因子、趋化中性粒细胞等炎性细胞促进炎性反应[3-4]。近年来研究证实Th17细胞参与多发性硬化、炎性肠病、类风湿性关节炎等多种自身免疫性疾病发病[5-6],而Th17细胞在 MG发病机制中的作用仍有争议。本研究根据胸腺病理进行分组,使用流式细胞术检测MG患者外周血Th17细胞比例,采用实时定量 RT-PCR(realtime reverse trancription polymerase chain reaction,Realtime RT-PCR)方法定量测定Th17细胞相关细胞因子IL-17、IL-1β、IL-6,IL-23、RORγ mRNA 转 录 水 平,采 用ELISA 检测IL-17、IL-1β、IL-6和IL-23表达,并分析患者外周血Th17细胞比例与MG病情严重程度评分间的关系,以探讨Th17细胞及其细胞因子在MG发病机制中的作用。
1 对象和方法
1.1 观察对象 选择2010-09-2011-12期间309医院重症肌无力中心治疗的确诊MG患者102例。MG根据典型的临床症状、新斯的明试验阳性或神经重复电刺激递减试验阳性确诊[7]。入组患者均行胸腺瘤/胸腺切除术+脂肪清扫术。根据胸腺病理结果分为MG伴胸腺瘤组(MG with thymoma,TM)、MG 伴胸腺增生(MG with thymic hyperplasia,TH)、MG 正常胸腺组 (MG with normal thymus,NT)3组。健康对照组(healthy controls,HC)选择309医院体检中心健康体检志愿者32例,均无近期感染或自身免疫病史。各组之间性别、年龄间无统计学差异。各组临床资料见表1。

表1 各组MG患者临床资料
1.2 主要试剂和仪器 淋巴细胞刺激剂佛波酯(PMA)、离子霉素(Ionomycin)购自Sigma公司,莫奈霉素购自Enzo公司;PC5标记抗人CD4单克隆抗体购自Beckman coulter公司,抗人CD4抗体购自BD Biosciences公司,抗人IL-17A抗体及ELISA试剂盒购自eBioscience公司;细胞膜破膜固定试剂购自BD公司;反转录试剂盒购自MBI公司;乙酰胆碱受体抗体试剂盒购自R&D公司。PCR引物(表2)由上海博亚生物技术公司合成;流式细胞仪购自Beckman Coulter FC500公司,Rotor gene 3000实时定量PCR仪来自Corbett公司。
1.3 方法
1.3.1 Th17细胞相关细胞因子mRNA转录水平及表达水平检测:在MG患者病情稳定期且未接受免疫抑制治疗及胸腺切除术前,抽取15mL静脉血。使用密度梯度离心法分离外周血单核细胞(PBMCs)制成悬液。使用RNA抽提试剂盒分离mRNA,获得的总RNA使用反转录试剂盒反转录为cDNA,-80℃保存。以实时定量RT-PCR检测 MG 患者 PBMCs IL-17、IL-1β、IL-6、IL-23和ROR-γmRNA转录水平,以β-actin为内参基因,以细胞因子的mRNA转录水平与内参基因表达量的比值作为其mRNA相对转录水平。使用ELISA 试剂盒检测 MG 患者血清IL-17、IL-1β、IL-6、IL-23和 TGF-β细胞因子表达水平。
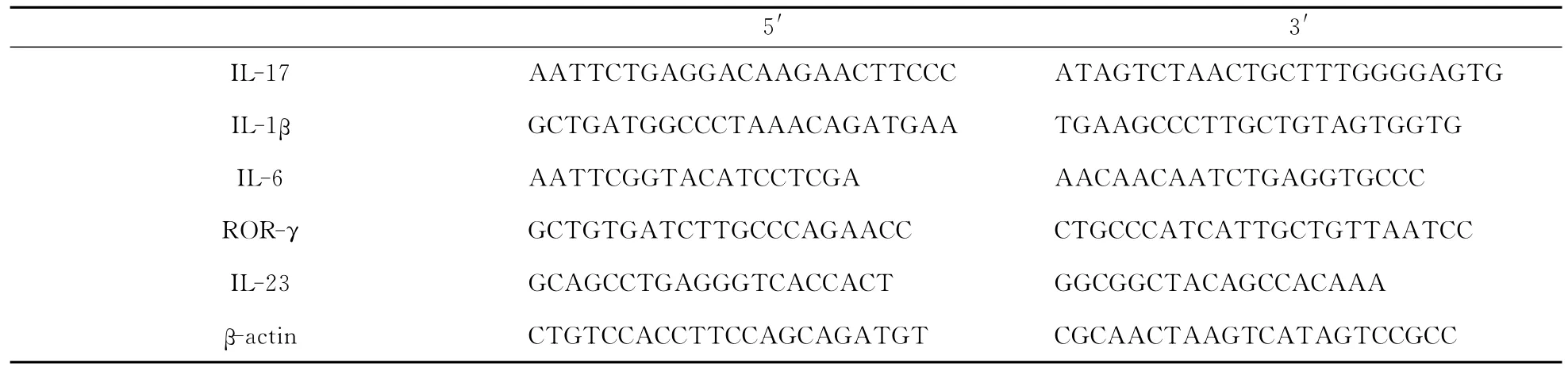
表2 Realtime RT PCR引物序列
1.3.2 流式细胞术检测PBMCs Th17细胞比例:将PBMCs密度调整至2×106/L。使用PMA 100 ng、离子霉素1μg和莫奈霉素2μmol/L共刺激5 h。以抗人CD4抗体染色15min,使用破膜试剂溶解细胞膜,使用抗人IL-17A抗体胞内染色20 min。使用流式细胞仪检测Th17/CD4+T细胞比例。
1.3.3 MG临床严重程度评估:在MG患者未接受免疫抑制治疗及胸腺切除术前,使用美国重症肌无力协会QMG评分评价患者病情,并分析血清Th17细胞比例与QMG评分之间的相关性。使用抗人AChR-Ab试剂盒(检测范围20~500pmol/L)测定MG患者血清AChR-Ab水平。分析MG患者血清Th17细胞比例与血清AChR-Ab水平间的相关性。
1.4 统计学处理 采用SSPS 19.0软件进行分析。数据以均数±标准差表示。采用ANOVA进行多组间比较及组间两两比较,使用Pearson回归分析进行两因素相关回归分析。
2 结果
2.1 外周血Th17细胞比例 MG伴胸腺瘤患者外周血Th17细胞比例升高。MG伴胸腺瘤组〔(1.57±0.56)%〕显 著 高 于 对 照 组 〔(0.94±0.32)%,P=0.031〕,对照组与 MG伴胸腺增生组〔(1.35±0.36)%〕及 MG 正常胸腺组〔(1.09±0.52)%〕之间差异无统计学意义(均P>0.05)。
2.2 Th17细胞相关细胞因子mRNA转录量MG伴胸腺瘤患者IL-17A、IL-1β、IL-6、RORγ及IL-23mRNA相对转录水平高于对照组(表3)。
2.3 MG伴胸腺瘤患者血清细胞因子表达 MG伴胸腺瘤患者血清细胞因子IL-17A、IL-1β及IL-23表达水平高于对照组(表3)。各组IL-6表达水平无统计学差异(P>0.05)。

表3 Th17细胞相关细胞因子表达及其mRNA相对表达量
2.4 MG伴胸腺瘤组外周血Th17细胞比例与QMG评分相关性 使用QMG评分评价MG患者临床严重程度,MG伴胸腺瘤组QMG评分与Th17细胞比例呈正相关(r=0.74,P=0.034),MG伴胸腺增生组(r=0.51,P=0.087)、MG正常胸腺组(r=0.14,P=0.41)Th17细胞比例与QMG评分不相关。
2.5 MG患者外周血Th17细胞比例与血清AChR-Ab水平相关性分析 102例MG患者中72例外周血AChR-Ab结果为阳性(>20pmol/L),32例对照组均为阴性。各组AChR-Ab水平无统计学差异(P>0.05)。MG患者血清AChRAb水平与Th17细胞比例(%)呈正相关(r=0.81,P=0.026)。
3 讨论
MG是一种以胸腺为靶器官的自身免疫性疾病[1],近期研究证实细胞免疫缺陷参与 MG发病[8]。Th17细胞是近年来新发现的功能性CD4+T辅助细胞亚群,特异性表达IL-17。人Th17细胞是在TGF-β和IL-1β共同诱导下由初始T细胞分化而来[9-11]。Th17细胞对于维持机体免疫耐受有重要调节作用,可参与多种自身免疫性疾病发病[5-6]。Th17 细 胞 及 其 相 关 细 胞因 子IL-17、IL-1β、IL-6和IL-23在 MG发病机制中的作用仍有争议。
IL-17是Th17细胞特征性标记因子,研究证实IL-17是一种促炎细胞因子,可上调趋化因子表达,趋化中性粒细胞等炎性细胞至炎性反应部位,增强组织炎性反应[12]。本研究发现,MG伴胸腺瘤患者IL17mRNA和血清IL-17水平均显著增高,而正常胸腺 MG患者未发现类似改变,提示Th17细胞可能与胸腺瘤引起的免疫功能损伤紧密相关。细胞因子IL-23可调控IL-17表达,促进Th17细胞存活[9,13]。IL-1β可诱导人 ROR 表达,后者对于Th17的分化和发育具有重要意义[14]。因此,IL-1β和IL-23对于 Th17细胞的成熟和自稳有重要意义。本研究结果显示,MG伴胸腺瘤组组 RORγ、IL-23和IL-1β表达上调,提示IL-23和IL-1β可能是参与人Th17细胞诱导和自稳的主要因素。
在实验性自身免疫性重症肌无力(experimen-tal autoimmune myasthenia gravis,EAMG)模型中,Th17细胞比例明显增高,IL-17表达亦明显增加[15],然而临床研究显示 MG患者外周血Th17细胞比例与健康对照无明显差异[16]。本研究结果显示伴胸腺瘤MG患者外周血Th17细胞比例显著升高,非胸腺瘤MG患者外周血Th17细胞比例与健康对照相比无明显差异,提示Th17细胞比例变化与胸腺瘤密切相关。最近一项研究证实,与眼肌型MG和健康对照相比,全身型MG患者外周血Th17细胞比例显著升高,且血清AChR-Ab水平与Th17细胞比例有相关性;不过入组该研究的25例MG患者,仅2例存在胸腺病变(2例IL-17水平均明显升高)[17],因此该研究尚需临床观察更多伴胸腺异常的MG患者进一步验证。以往曾有研究证实伴发胸腺瘤MG体内自身反应性T细胞增多,可辅助 B 细胞产生自身反应性抗体[18-19]。本研究中伴胸腺病变的MG样本量较大,结果显示血清AChR-Ab与外周血Th17细胞比例呈正相关(r=0.81,P=0.026),由此推测Th17细胞可能通过影响B细胞生成自身免疫性抗体在MG发病中发挥作用,与上述研究结果相似。进一步分析血清Th17细胞比例与MG患者临床表现严重程度评分——QMG评分之间的关系发现,胸腺瘤组中QMG评分与Th17细胞比例正相关,提示Th17细胞仅与MG伴胸腺瘤病情严重程度相关。
总之,本研究结果显示,MG患者外周血Th17细胞与AChR-Ab水平呈正相关,MG伴胸腺瘤患者外周血Th17细胞数目和IL-17表达上调且与疾病严重程度相关。因此Th17细胞数目上调可能导致免疫耐受失衡,引发MG等自身免疫性疾病发病。本研究胸腺瘤各亚组样本量小,各亚组间Th17细胞未发现明显差异,需要通过后期研究进一步探索不同病理类型胸腺瘤患者Th17细胞差异,并需要进一步研究Th17细胞在MG发病中的具体机制和信号通路,这对于MG的诊断和治疗可能会有重要意义。
[1]Meriggioli MN,Sanders DB.Autoimmune myasthenia gravis:emerging clinical and biological heterogeneity[J].Lancet Neurol,2009,8(5):475-490.
[2]Spolski R,Leonard WJ.Cytokine mediators of Th17function[J].Eur J Immunol,2009,39(3):658-661.
[3]Ouyang W,Kolls JK,Zheng Y.The biological functions of T helper 17cell effector cytokines in inflammation[J].Immuni-ty,2008,28(4):454-567.
[4]Dong C.Regulation and pro-inflammatory function of interleukin-17family cytokine[J].Immunol Rev,2008,226:80-86.
[5]Pène J,Chevalier S,Preisser L,et al.Chronically inflamed human tissues are infiltrated by highly differentiated Th17 lymphocytes[J].J Immunol,2008,180(11):7423-7430.
[6]Duerr RH,Taylor KD,Brant SR,et al.A genomewide association study identifies IL23Ras an inflammatory bowel disease gene[J].Science,2006,314(5804):1461-1463.
[7]Pal J,Rozsa C,Komoly S,et al.Clinical and biological heterogeneity of autoimmune myasthenia gravis[J].J Neuroimmunol,2011,231(1-2):43-54.
[8]Luther C,Poeschel S,Varga M,et al.Decreased frequency of intrathymic regulatory T cells in patients with myastheniaassociated thymoma[J].J Neuroimmunol,2005,164(1-2):124-128.
[9]Veldhoen M,Hocking RJ,Atkins CJ,et al.TGF beta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells[J].Immunity,2006,24(2):179-189.
[10]Mangan PR,Harrington LE,O′Quinn DB,et al.Transforming growth factor-beta induces development of the T(H)17 lineage[J].Nature,441(7090):231-234.
[11]Bettelli E,Carrier Y,Gao W,et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,441(7090):235-238.
[12]Weaver CT,Hatton RD,Mangan PR,et al.IL-17family cytokines and the expanding diversity of effector T cell lineages[J].Annu Rev Immunol,2007,25:821-852.
[13]Aggarwal S,Ghilardi N,Xie MH,et al.Interleukin-23promotes a distinct CD4Tcell activation state characterized by the production of interleukin-17[J].J Biol Chem,2003,278(3):1910-1914.
[14]Acosta-Rodriguez EV,Napolitani G,Lanzavecchia A,et al.Interleukins 1beta and 6but not transforming growth factorbeta are essential for the differentiation of interleukin 17-producing human T helper cells[J].Nat Immunol,2007,8(9):942-949.
[15]Mu L,Sun B,Kong Q,et al.Disequilibrium of T helper type 1,2and 17cells and regulatory T cells during the development of experimental autoimmune myasthenia gravis[J].Immunology,2009,128(1Suppl):e826-836.
[16]Masuda M,Matsumoto M,Tanaka S,et al.Clinical implication of peripheral CD4+CD25+regulatory T cells and Th17 cells in myasthenia gravis patients[J].J Neuroimmunol,2010,225(1-2):123-131.
[17]Roche JC,Capablo JL,Larrad L,et al.Increased serum interleukin-17levels in patients with myasthenia gravis[J].Muscle Nerve,2011,44(2):278-280.
[18]Ströbel P,Rosenwald A,Beyersdorf N,et al.Selective loss of regulatory T cells in thymomas[J].Ann Neurol,2004,56(6):901-904.
[19]Kadota Y,Okumura M,Miyoshi S,et al.Altered T cell development in human thymoma is related to impairment of MHC class II transactivator expression induced by interferongamma(IFN-gamma)[J].Clin Exp Immunol,2000,121(1):59-68.

