阿尔茨海默氏症患者大脑的结构偏侧性研究
隆晓菁 陈书中 徐礼胜 廖炜圻 姜春香 张丽娟*
1(中国科学院深圳先进技术研究院劳特伯生物医学成像研究中心 深圳 518055)
2(东北大学中荷生物医学与信息工程学院 沈阳 110819)
1 引 言
阿尔茨海默氏症 (Alzheimer’ s Disease,AD)是一种原发性、退行性的神经疾病。据中国阿尔茨海默氏症协会于 2011 年公布的调查结果显示,全球约有3650 万人患有阿尔茨海默氏症,每 7 秒就有一人患上此病,而患上此病后的平均生存期只有 5.9 年。中国大约有 600 万~800 万患者,约占世界患此病总人数的 17%~22%[1]。阿尔茨海默氏症主要病理变化为大脑皮质的弥漫性萎缩、沟回增宽、脑室扩大、神经元大量减少,老年斑明显和神经元纤维结等改变。早期临床表现为近期记忆力降低、嗅觉减退、情绪改变等,继而出现持续性智能衰退、失语、判断推理能力丧失以及运动障碍等,严重影响病患的生活自理能力,给患者家庭和社会带来了沉重的经济和精神负担。国际健康联合会组织提示,阿尔茨海默氏症或将与癌症、心脏病共同成为人类的首要健康威胁。当前对阿尔茨海默氏症的诊断主要是先根据临床表现做出痴呆的主观判断,然后结合病史、病程的特点、心理测查与辅助检查等资料进行综合分析,进而做出最终的诊断。随着神经影像技术的进步以及对该疾病的研究不断深入,高端影像技术如磁共振成像,在阿尔茨海默氏症的诊断、病程追踪、疗效评估等方面得到越来越多的应用。
结构磁共振成像(structural Magnetic Resonance Imaging,sMRI)是目前临床最常用的成像方式之一,它能提供关于人体器官解剖结构方面的信息,并能直观地排除由肿瘤或机械性创伤造成的认知伤害。利用sMRI 可检测全脑或特定感兴趣区域(ROI)的体积、面积以及皮层厚度等指标,提取局部脑区特征和结构成分的差异,进而可对 AD 患者和正常个体之间进行统计分析比较。Karas 等[2]发现 AD 患者的海马、颞极、脑岛、尾状核头部和丘脑内侧等区域的灰质发生了明显的萎缩,在感觉运动区、枕极和小脑等区域有分散性的萎缩。Thompson 等[3]考察了轻度和中度 AD 患者相对于正常老年人的皮层不对称性、灰质分布和平均灰质萎缩率的变化,结果显示 AD 患者颞顶叶皮层的灰质萎缩最显著,感觉运动皮层和枕叶的灰质萎缩率相对较小,左半球灰质萎缩程度大于右半球,且不同阶段脑回的变化具有区域性。以往基于 ROI 的分析主要集中在海马体,多组研究证实 AD 患者的海马体体积萎缩速度较正常人明显加快[4,5]。近年的研究显示内嗅皮层可能是 AD 最早受累的部位[6],其萎缩率较海马体更高[7]。
此外,近年来的弥散张量成像(DTI)技术揭示白质病变在 AD 的疾病过程中也有着重要影响[8,9]。该技术通过量化检测组织中水分子的弥散特性来解析大脑微观结构的特征,评估脑白质纤维束走行的方向性、连接及完整性。以往的研究发现,AD 患者大脑白质的平均扩散率(Mean Diffusivity,MD)在海马体、颞动脉干、扣带回、胼胝体、半卵圆中心等区域较正常个体高[10-15],而部分各向异性(Fractional Anisotropy,FA)在海马体、胼胝体、额叶、颞叶、顶叶等部位则较正常个体低[10,11,14-16],提示这些区域在 AD 早期存在白质纤维束退变或髓鞘损伤。
AD 早期单侧或双侧的病理改变将导致大脑结构和功能偏侧性异常。偏侧性是大脑实现高效、多任务功能活动的特性之一,如左侧半球在语言功能、逻辑思维、分析能力、运用技巧和计算方面起决定作用,右侧半球则在空间功能、形状识别、音乐、美术、综合能力和短暂视觉记忆等方面具有明显优势。正常衰老或神经、精神疾病(如阿尔茨海默氏症、精神分裂症等)会导致大脑偏侧性发生不同程度的改变[17-21],并与健忘、反应迟缓、认知能力下降等功能受损征象相关联。Thompson 等[22]提出 AD 患者的皮层萎缩更早发生在左半球,且较右半球退化更快。另有研究发现AD 患者双侧海马体的偏侧性较正常人减弱[23,24]。
本文基于高分辨率 T1 加权成像和弥散张量成像,将左右半球大脑皮层分别分割成 34 个感兴趣区(ROI),并计算每个 ROI 的平均皮层表面积、沟回指数、皮层厚度、皮层下白质体积和白质纤维束部分各向异性(FA)等形态学参数。其中,使用单变量和多变量模型对每个 ROI 的参数进行左右半球的差异性检验,以全面比较 AD 患者和正常老年人群在灰质、白质、纤维束微结构方面偏侧性的差异。
2 实验数据与方法
从阿尔茨海默氏症公共数据库(Alzheimer’ s Disease Neuroimaging Initiative,ADNI)中连续选取了 78 个个体的 T1 加权成像(T1WI)和 DTI 图像,其中 AD 患者和正常个体各 39 人。正常个体均经过严格的临床甄别,排除内分泌、神经、精神方面的疾病。采用临床痴呆评定量表(Clinical Dementia Rating,CDR)和简短精神状态量表(Mini Mental State Exam, MMSE)评定受试者的认知程度(结果见表 1)。其中,当 CDR=0,24≤MMSE≤30 时表示正常;CDR=0.5,20≤MMSE≤26 时表示轻度认知功能障碍;CDR=1,20≤MMSE≤26 表示轻度 AD;CDR=2,10≤MMSE≤22 表示中度 AD;CDR=3,MMSE≤12 表示重度 AD。

表1 两组个体的人口统计学信息
基于 T1WI 图像数据,计算大脑各功能区域的皮层表面积、沟回指数、皮层厚度、及皮层下白质体积。首先,使用 Freesurfer 软件对 T1WI 图像进行预处理,步骤包括:灰度标准化、去头骨、配准到标准空间、组织成分分割(灰质、白质和脑脊液)。分割后重建大脑皮层曲面和白质层曲面,并匹配到Freesurfer 定义的标准球坐标系统中。然后根据分割图谱将表面分割成 34 个 ROIs,分别计算左右半球各区域的形态学指标[25-32]。
基于 DTI 图像计算 FA 值。计算每个像素张量的特征向量(λ1, λ2, λ3),部分各向异性(FA)定义为:
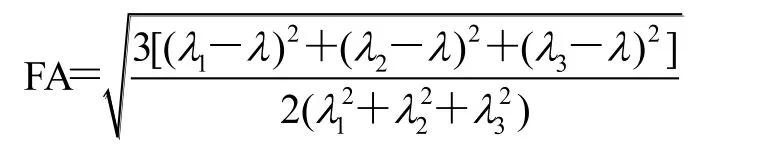
其中 λ=(λ1+λ2+λ3)/3。FA 值介于 0 到 1 之间,0 表示弥散各向同性,1 表示弥散各向异性。将已分割成 34 个功能区域的 T1WI 图像配准到 DTI 图像,提取左右半球相应 ROI 的 FA 平均值。
获取左右半球每一 ROI 的 5 个形态学指标后,对每个区域的左右半球参数进行统计检验。其中,皮层表面积、沟回指数、皮层厚度作为 T1WI 的联合灰质形态学指标,对其进行多变量方差分析(MANCOVA);而皮层下白质体积作为 T1WI 的白质形态学指标,FA 作为 DTI 的白质纤维束微结构指标,分别对以上两个指标进行单变量方差分析(ANOVA)。偏侧指数定义为 LI=Σi(Li-Ri)/(Li+Ri),其中 Li和 Ri分别表示左、右半球第 i 个参数的均值。若 LI>0,其对应区域为左偏侧;若 LI<0,则为右偏侧。统计结果 P<0.05 的区域即归类为具有显著偏侧性。最后,将统计参数图投映到解剖结构模板图上进行显示。
3 实验结果
AD 组和正常组个体的年龄分布无统计学差异。皮层灰质的偏侧性比白质的偏侧性略为显著。与 DTI参数 FA 相比,基于 T1WI 的皮层表面积、沟回指数、皮层厚度等形态学参数的 MANCOVA 分析检测到更多的局部结构偏侧性(表 2)。偏侧区域主要分布在外侧前额叶和颞叶,以及内侧顶叶和边缘系统(图1)。灰、白质均显示显著偏侧性区域的覆盖范围包括扣带回峡部、前扣带回喙部、额中回尾部、额下回眶部和后部、额极、旁中央小叶、角回、颞横回、颞上回、颞中回、及内嗅皮层。
基于 T1WI 的形态学指标和基于 DTI 的纤维束微结构指标均显示 AD 患者的偏侧性在数量上均明显少于正常老年人群。其中,AD 患者的大脑皮层灰质偏侧性在缘上回、内嗅皮层、距状旁回、额中回基部消失;白质偏侧性则在额下回后部、内嗅皮层、舌回消失;FA 的偏侧性在中央后回、额上回区域消失。在 AD 患者组,唯一一个在灰质、白质偏侧性中同时消失的区域为内嗅皮层。
4 讨 论
在本文研究的两组个体中,灰质偏侧性均略多于白质。大脑皮层灰质是中枢神经系统中神经元聚集的部位,也是中枢神经系统对信息进行深入处理的部位。白质由被髓鞘包裹着的神经轴突组成,其主要功能包括控制和协调不同灰质之间或者灰质与外周器官之间的信息传递。大脑半球同侧神经元和神经轴突是实现脑区功能的统一整体,因此无论是正常个体还是 AD 患者,灰、白质的数量和体积都具有较高关联性,因而两者的偏侧性模式也较为接近。
FA 值反映水分子在空间位移的各向异性程度,是水分子各向异性成分占整个弥散张量的比例,其中 0 代表弥散不受限制,1 代表弥散具有规则的方向性。水分子在髓鞘完整的大脑白质纤维束内的弥散具有高度的方向性,其 FA 值接近 1;反之,在微结构完整性受到破坏的脑组织中,水分子弥散的各向异性降低,其 FA 也随之降低。以往的研究发现,AD 患者白质纤维束的完整性较正常老年人明显下降,FA值显著减小[8,10,14,15,33]。本实验基于 FA 值的偏侧性分析结果显示,AD 患者的大脑偏侧区域明显少于正常老年人,而在二者均无半球优势的区域,AD 患者大脑的偏侧性指数在各脑区的分布和程度方面与健康老年人形似。以上结果提示,在 AD 疾病过程中双侧半球的白质微结构改变趋于均衡,无明显的半球倾向性。

表2 偏侧性统计检验 P 值表*

图1 AD 患者和正常老年人的大脑偏侧性结果图
偏侧性被认为是大脑适应性的一个特征,有利于大脑同时处理多个任务并提高处理事务的效率。目前研究认为左半球在语言文字方面具有优势[34,35],而对于空间感觉、美术、音乐等则是右半球为优势半球[36]。本文偏侧性实验结果显示,正常老年人和 AD患者的灰质、白质偏侧部位大多集中在大脑外侧前额叶、颞叶、内侧边缘系统等区域。以上区域被认为是最易受衰老和 AD 病变影响的部位[37-40],因此偏侧性的保留对大脑有效应对组织萎缩和机能衰退具有重要意义。
与正常老年人相比,AD 患者的大脑偏侧性在额下回后部、额中回基部、缘上回、舌回、距状旁回、内嗅皮层消失,以上区域与大脑的语言、视觉和记忆等认知功能有关。这些区域偏侧性的降低可能是 AD患者的视觉失认、面貌失认、语言功能受损、记忆障碍等功能失调症状的物质基础之一。尤其值得关注的是 AD 患者偏侧性在内嗅皮层的降低。内嗅皮层被认为是联系海马和新皮层的结构,其浅层的主要神经元——星形神经元和锥体神经元接受皮层的纤维投射并通过不同的路径向海马传递信息。内嗅皮层不仅在“新皮层—海马—新皮层”记忆环路中处于重要解剖位置,还与空间学习记忆的形成和巩固密切相关[37],因而在人类认知能力上起着十分重要的作用。而 AD患者的灰、白质偏侧性同时在内嗅皮层消失,提示了该区域对 AD 疾病的特殊敏感性,并进一步验证了内嗅皮层是 AD 疾病过程中受影响较大的关键部位。
5 总 结
本文利用结构磁共振和弥散张量图像对大脑 34个感兴趣区域的皮层表面积、沟回指数、皮层厚度、皮层下白质体积、白质纤维束部分各向异性 FA 值共5 个参数进行了计算与分析,探索了 AD 患者和健康老年人大脑偏侧性的差异。结果显示,大脑灰质、白质具有显著偏侧性的区域主要分布于大脑外侧的前额叶和颞叶,内侧的顶叶和边缘系统等最易受到衰老和AD 病变影响的部位,偏侧性的保留可能是大脑应对组织退化萎缩和机能衰退的再适应机制之一。与正常老年人相比,AD 患者的偏侧性在涉及语言、视觉、记忆等功能的脑区显著降低,尤其在内嗅皮层,其灰、白质的偏侧性同时消失,这一发现提示内嗅皮层的偏侧性改变可能是早期 AD 的特征性影像学标记之一。
[1]Wimo A, Prince M. World Alzheimer report 2010-The global economic impact of dementia [R]. London: Alzheimer's Disease International, 2010.
[2]Karas G B, Scheltens P, Rombouts S A, et al. Global and local gray matter loss in mild cognitive impairment and Alzheimer’s disease [J]. Neuroimage, 2004, 23(2): 708-716.
[3]Thompson P M, Mega M S, Woods R P, et al. Cortical change in Alzheimer’s disease detected with a disease-specif i c populationbased brain atlas [J]. Cerebral Cortex, 2001, 11(1): 1-16.
[4]Jack C R Jr, Petersen R C, Xu Y, et al. Rates of hippocampal atrophy correlate with change in clinical status in aging and AD [J]. Neurology, 2000, 55(4): 484-489.
[5]van de Pol L A, Hensel A, van der Filer W M, et al. Hippocampal atrophy on MRI in frontotemporal lobar degeneration and Alzheimer's disease [J]. Journal of Neurology, Neurosurgery and Psychiatry, 2006, 77(4): 439-442.
[6]Gómez-Isla T, Price J L, Mckeel D W Jr, et al. Profound loss of layer II entorhinal cortex neurons occurs in very mild Alzheimer's disease [J]. The Journal of Neuroscience, 1996,16(14): 4491-4500.
[7]Du A T, Schuff N, Kramer J H, et al. Higher atrophy rate of entorhinal cortex than hippocampus in AD [J]. Neurology, 2004,62(3): 422-427.
[8]Medina D, DeToledo-Morrell L, Urresta F, et al. White matter changes in mild cognitive impairment and AD: a diffusion tensor imaging study [J]. Neurobiology of Aging, 2006, 27(5):663-672.
[9]Rose S E, Chen J B, Chalk J B, et al. Loss of connectivity in Alzheimer's disease: an evaluation of white matter tract integrity with colour coded MR diffusion tensor imaging [J]. Journal of Neurology, Neurosurgery and Psychiatry, 2000, 69(4): 528-530.
[10]Bozzali M, Falini A, Franceschi M, et al. White matter damage in Alzheimer's disease assessed in vivo using diffusion tensor magnetic resonance imaging [J]. Journal of Neurology,Neurosurgery and Psychiatry, 2002, 72(6): 742-726.
[11]Fellgiebel A, Wille P, Müller M J, et al. Ultrastructural hippocampal and white matter alterations in mild cognitive impairment: a diffusion tensor imaging study [J]. Dementia and Geriatric Cognitive Disorders, 2004, 18(1): 101-108.
[12]Kantarci K, Jack C R Jr, Xu Y C, et al. Mild cognitive impairment and Alzheimer disease: regional diffusivity of water [J]. Radiology, 2001, 219(1): 101-107.
[13]Müller M J, Greverus D, Dellani P R, et al. Functional implications of hippocampal volume and diffusivity in mild cognitive impairment [J]. Neuroimage, 2005, 28(4): 1033-1042.
[14]Naggara O, Oppenheim C, Rieu D, et al. Diffusion tensor imaging in early Alzheimer's disease [J]. Psychiatry Research,2006, 146(3): 243-249.
[15]Xie S, Xiao J X, Gong G L, et al. Voxel-based detection of white matter abnormalities in mild Alzheimer disease [J]. Neurology,2006, 66(12): 1845-1849.
[16]Takahashi S, Yonezawa H, Takahashi J, et al. Selective reduction of diffusion anisotropy in white matter of Alzheimer disease brains measured by 3.0 tesla magnetic resonance imaging [J].Neuroscience Letters, 2002, 332(1): 45-48.
[17]Albert M, Moss M. Geriatric Neuropsychology [M]. New York:Guilford Press, 1988.
[18]Brown J W, Jaffe J. Hypothesis on cerebral dominance [J].Neuropsychologia, 1975, 13(1): 107-110.
[19]Cabeza R. Hemispheric asymmetry reduction in older adults: the HAROLD model [J]. Psychology and Aging, 2002, 17(1): 85-100.
[20]Cherbuin N, Réglade-Meslin C, Kumar R, et al. Mild cognitive disorders are associated with different patterns of brain asymmetry than normal aging: the PATH through life study [J].Frontiers in Psychiatry, 2010, 1: 11.
[21]Derflinger S, Sorg C, Gaser C, et al. Grey-matter atrophy in Alzheimer’s disease is asymmetric but not lateralized [J].Journal of Alzheimer’s Disease, 2011, 25(2): 347-357.
[22]Thompson P M, Hayashi K M, Dutton R A, et al. Tracking Alzheimer's disease [J]. Annals of New York of Academy Sciences, 2007, 1097: 183-214.
[23]Barnes J, Scahill R I, Schott J M, et al, Does Alzheimer's disease affect hippocampal asymmetry? Evidence from a cross-sectional and longitudinal volumetric MRI study [J]. Dementia and Geriatric Cognitive Disorders, 2005, 19(5-6): 338-344.
[24]Shi F, Liu B, Zhou Y, et al. Hippocampal volume and asymmetry in mild cognitive impairment and Alzheimer's disease: Metaanalyses of MRI studies [J]. Hippocampus, 2009, 19(11): 1055-1064.
[25]Dale A M, Fischl B, Sereno M I. Cortical surface-based analysis.I. Segmentation and surface reconstruction [J]. Neuroimage,1999, 9(2): 179-194.
[26]Desikan R S, Ségonne F, Fischl B, et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest [J]. Neuroimage, 2006,31(3): 968-980.
[27]Fischl B, Dale A M. Measuring the thickness of the human cerebral cortex from magnetic resonance images [J].Proceedings of the National Academy Sciences of United States of America, 2000, 97(20): 11050-11055.
[28]Fischl B, Sereno M I, Dale A M. Cortical surface-based analysis.II: Inf l ation, fl attening, and a surface-based coordinate system [J].Neuroimage, 1999, 9(2): 195-207.
[29]Fischl B, Destrieux C, Halgren E, et al. Automatically parcellating the human cerebral cortex [J]. Cerebral Cortex,2004, 14(1): 11-22.
[30]Han X, Jovicich J, Salat D, et al. Reliability of MRI-derived measurements of human cerebral cortical thickness: the effects of fi eld strength, scanner upgrade and manufacturer [J].Neuroimage, 2006, 32(1): 180-194.
[31]Schaer M, Cuadra M B, Tamatit L, et al. A surface-based approach to quantify local cortical gyrification [J]. IEEE Transactions on Medical Imaging, 2008, 27(2): 161-170.
[32]Dale A M, Sereno M I. Improved localization of cortical activity by combining EEG and MEG with MRI cortical surface reconstruction: a linear approach [J]. Journal of Cognitive Neuroscience, 1993, 5(2): 162-176.
[33]Stahl R, Dietrich O, Teipel S, et al. Assessment of axonal degeneration on Alzheimer’s disease with diffusion tensor MRI [J]. Der Radiologe, 2003, 43(7): 566-575.
[34]Bethmann A, Tempelmann G, Bleser R D, et al. Determining language laterality by fMRI and dichotic listening [J]. Brain Research, 2007, 1133(1): 145-157.
[35]Ocklenburg S, Gunturkun O, Beste C. Lateralized neural mechanisms underlying the modulation of response inhibition processes [J]. Neuroimage, 2011, 55(4): 1771-1778.
[36]Vogel J J, Bowers C A, Vogel D S. Cerebral lateralization of spatial abilities: a meta-analysis [J]. Brain and Cognition, 2003,52(2): 197-204.
[37]Jack Jr C R, Petersen R C, Xu Y, et al. Rate of medial temporal lobe atrophy in typical aging and Alzheimer’s disease [J].Neurology, 1998, 51(4): 993-999.
[38]Mann D M. The topographic distribution of brain atrophy in Alzheimer's disease [J]. Acta Neuropathologica, 1991, 83(1):81-86.
[39]Raz N. Aging of the Brain and Its Impact on Cognitive Performance: Integration of Structural and Functional Findings [M]. In: Craik F I M, Salthouse T A , Editors.Handbook of Aging and Cognition-II. Erlbaum: Mahwah N J,2000: 1-90.
[40]Raz N. The Aging Brain Observed in Vivo: Differential Changes and Their Modif i ers [M]. In: Cabeza ,R, Nyberg L,Park D C, Editors. Cognitive Neuroscience of Aging: Linking Cognitive and Cerebral Aging. New York: Oxford University Press, 2004: 17-55.

