拟南芥晚花突变co-2和ft-1延迟营养生长时相转变
冯延娇,龙 鸿,2
(1.华中农业大学生命科学技术学院,武汉430070;2.天津农学院园艺系,天津300384)
拟南芥(Arabidopsis thaliana)胚后发育主要分为营养生长阶段和生殖生长阶段。在营养生长阶段,茎顶端分生组织(shoot apical meristem,SAM)主要形成节间较短的莲座叶,这个阶段又可分为幼龄期(juvenile phase)和成熟期(adult phase),进入成熟期后才可过渡到后一个生长阶段[1]。在生殖生长阶段,它的起始主要表现在茎节间明显加长,同时出现可见花芽。
最早关于植物营养生长时相转变的研究是在木本植物苹果(Malus domestica)和梨(Pyrus communis)中进行的,实验表明接穗的老熟程度对嫁接的效果有影响,说明植物的营养特性与它将来的生殖能力相关[2]。大量研究表明植物营养生长时相转变具有特异性[3,4],如叶片细胞大小变化,叶片的长宽比值变化,成熟时期相邻叶片之间呈现出相对固定的角度,某些植物具有幼龄期和成熟期不同的异形叶[5],表皮毛(trichomes)的分布和密度等。尽管在营养生长阶段发生的特异性变化比较复杂,但是基于这些变化,可以区分出植物营养生长时相转变的节点[6-9]。然而对于植株营养发育过程中幼龄期和成熟期的形态结构、解剖结构的系统观测还不够全面[10]。
自然界中,遗传因素和环境条件共同影响着植物的生长发育。拟南芥有4种开花途径:光周期途径(photoperiod pathway)、春化途径(vernalization pathway)、自主开花途径(autonomous pathway)和赤霉素途径(GA pathway)[11]。光周期途径是这些途径中最为古老和保守的途径。不同种类的植物依赖一定的昼长或夜长而开花,据此可分为长日照植物,短日照植物和兼性长日照植物。拟南芥属于兼性长日照植物,在长日条件下提早开花,短日条件下推迟开花。光周期途径中有两个比较重要的基因CONSTANS(CO)和FLOWERING LOCUS T(FT)。CO基因在光周期途径的下游可将光信号转换为开花信号,是这条途径的关键基因[12]。在长日照条件下,CO基因因受到生物钟节律的调控,在叶片中表达,它的产物能够促进开花转变基因FT的表达。这样FT由CO诱导之后,它的产物mRNA或蛋白质会从叶脉转移到SAM处,诱导开花。这两个基因突变后,拟南芥表现为晚花。本文利用拟南芥这两个基因的突变体co-2和ft-1,研究了光周期途径晚花突变对营养生长时相转变(vegetative phase change,VPC)的影响,为开花与营养生长时相转变之间的关系提供实验依据。
1 材料与方法
1.1 实验材料
拟南芥Ler生态型的种子由作物遗传改良国家重点实验室须健老师课题组提供,co-2和ft-1晚花突变体的种子购自Arabidopsis Biological Resource Center at Ohio State University(Columbus,Ohio)。
1.2 实验方法
1.2.1 植物生长条件
种子播种前,先放入4℃冰箱中处理2 d。之后点种到小塑料盆中,做好标记,盖上薄膜以保湿,然后转移到培养室内培养。光照时间为16 h,黑暗时间为8 h,白天温度22℃,夜间18℃,湿度为60% ~80%。一个星期后,掀开薄膜。
1.2.2 植物生长观测
待种子萌发后,观察表型,记录植株的生长速率。统计至少50棵植株的萌发时间,观测真叶上开始出现远轴面表皮毛的叶片数,莲座叶总数,出现可见花芽的时间以及整个生活史过程等。计数近轴面表皮毛的数目,同时进行密度分析。测量叶的长宽比值,并制作曲线图。植株开出第一朵花时拍照,同时拍摄两片子叶、所有的莲座叶图片,进行叶形分析。
1.2.3 石蜡切片
根据出现的叶片总数进行取材,包括出现可见叶原基和已有真叶,分别取植株叶片总数为2,3,4……直至长出所有莲座叶的茎尖,FAA固定液固定24 h后,爱氏苏木精整染2 d,梯度乙醇脱水,氯仿透明,浸蜡包埋,Leica RM2235切片机切片,厚度7 μm,中性树胶封片,Olympus BX53显微镜观察,Spot Flex CCD相机拍照,测量茎端分生组织高与宽的比值。
2 结果与分析
2.1 叶片远轴面表皮毛出现延迟揭示co-2和ft-1的营养生长时相转变被延迟
为探讨植物生长发育过程中,营养生长时相转变和生殖生长时相转变的相关性,我们观测了晚花突变体co-2和ft-1的生长周期特征。结果表明,两种晚花突变体的开花时间与野生型相比,明显延迟。同时,我们从野生型和突变体中各选50株统计了莲座叶的叶片数目和出现远轴面表皮毛的叶片数目。统计结果显示,野生型Ler莲座叶叶片数目为6.1±0.5,co-2的为14.7±1.8,ft-1的为12.9±0.8,说明晚花突变体叶片增多,营养生长期增长;Ler第3.5±0.5片叶未出现远轴面表皮毛,co-2的是4.0±0.0片,ft-1的是4.0±0.2片,即野生型是从第4片真叶开始长出远轴面表皮毛,两种晚花突变体是从第4片真叶开始出现远轴面表皮毛的,说明晚花突变体的远轴面表皮毛出现晚于野生型,依据Telfer等观察结果,拟南芥中远轴面表皮毛的出现是营养生长幼龄期到成熟期时相转变的标志,所以co-2和ft-1的营养生长幼龄期得到增长,营养生长时相转变被延迟,突变体幼龄期持续的时间也比野生型多了数天(表1),说明晚花突变体co-2和ft-1开花转变与营养生长时相转变相关联。
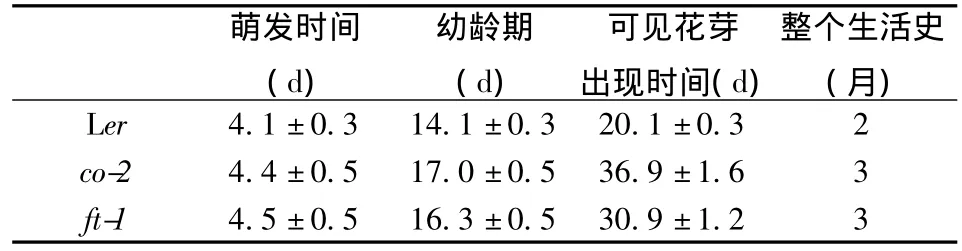
表1 拟南芥野生型和晚花突变体重要生长时间段的统计Table 1 Growth characteristics of Arabidopsis wild-type and late-flowering mutants
2.2 叶形和叶片长宽比变异显示co-2和ft-1的营养生长幼龄期延长
研究表明,叶形和叶片长宽比随着发育的进程而变化。我们比较了野生型和co-2、ft-1突变体的叶形变化。结果显示,野生型的子叶和生长早期的莲座叶(第1、2、3片)接近圆形,后期的叶片稍呈卵形,生长出远轴面表皮毛的第4片叶与之前的莲座叶相比变化明显;co-2和ft-1两种突变体的一对子叶和生长早期的莲座叶(第1、2、3、4片)也接近圆形,而后期的叶片呈匙形并急剧趋于披针形,co-2和 ft-1生长出远轴面表皮毛的第5片叶与之前的莲座叶相比变化明显,茎生叶叶形在野生型和突变体中一致(图1)。这些结果表明,随着植物生长的进程,叶形发生了由圆形至卵形至披针形的变化,由于生长周期增长,这一点在晚花突变体中表现更剧烈、明显,且这一连续变化性状在营养生长由以远轴面表皮毛出现为界定的幼龄期向成熟期转变过程中表现出由圆形到卵形或匙形变化的明显不同,从叶形特征来分析,co-2和ft-1突变体的营养生长幼龄期向成熟期转变过程也被延迟。此外,我们测定了叶片长宽比,结果显示,最初两片莲座叶的长宽比值几乎均为1,表明第一对真叶叶形接近于圆形;随后,野生型和突变体的叶片长宽比值都变大,说明莲座叶在不断变长。

图1 Ler和co-2,ft-1的叶形图Fig 1 Leaf morphology of Ler and co-2,ft-1
2.3 营养生长时相转变的茎端分生组织特征决定
为探讨植物营养生长时相转变的解剖结构特征,我们对不同生长时期茎端分生组织的特征决定进行了解剖观察。结果表明,SAM在营养生长发育的早期呈稍隆起状,随后中央凸起,呈锥体状,即将开花时又变得较为平坦,由最初的营养茎顶端分生组织转变成花序分生组织,然后产生花分生组织,最终形成花芽(图3)。我们还测定了SAM的高与宽的比值(图4)。结果显示,无论是野生型还是晚花突变体,它们的高度值都要比宽度值小,由于SAM刚开始呈锥体状,到后期变得较为平缓,因此高与宽的比值上升到一定阶段会下降。Ler在第4片真叶时,高宽比值明显上升,与出现远轴面表皮毛的叶片位置一致;同样,两种突变体在第5片真叶位置时高宽比值明显上升。这些结果表明,在幼龄期到成熟期时相转变过程中,茎端分生组织锥体增高明显,转变为生殖生长后趋于平缓,晚花突变体co-2和ft-1的营养生长时相转变晚于野生型Ler。

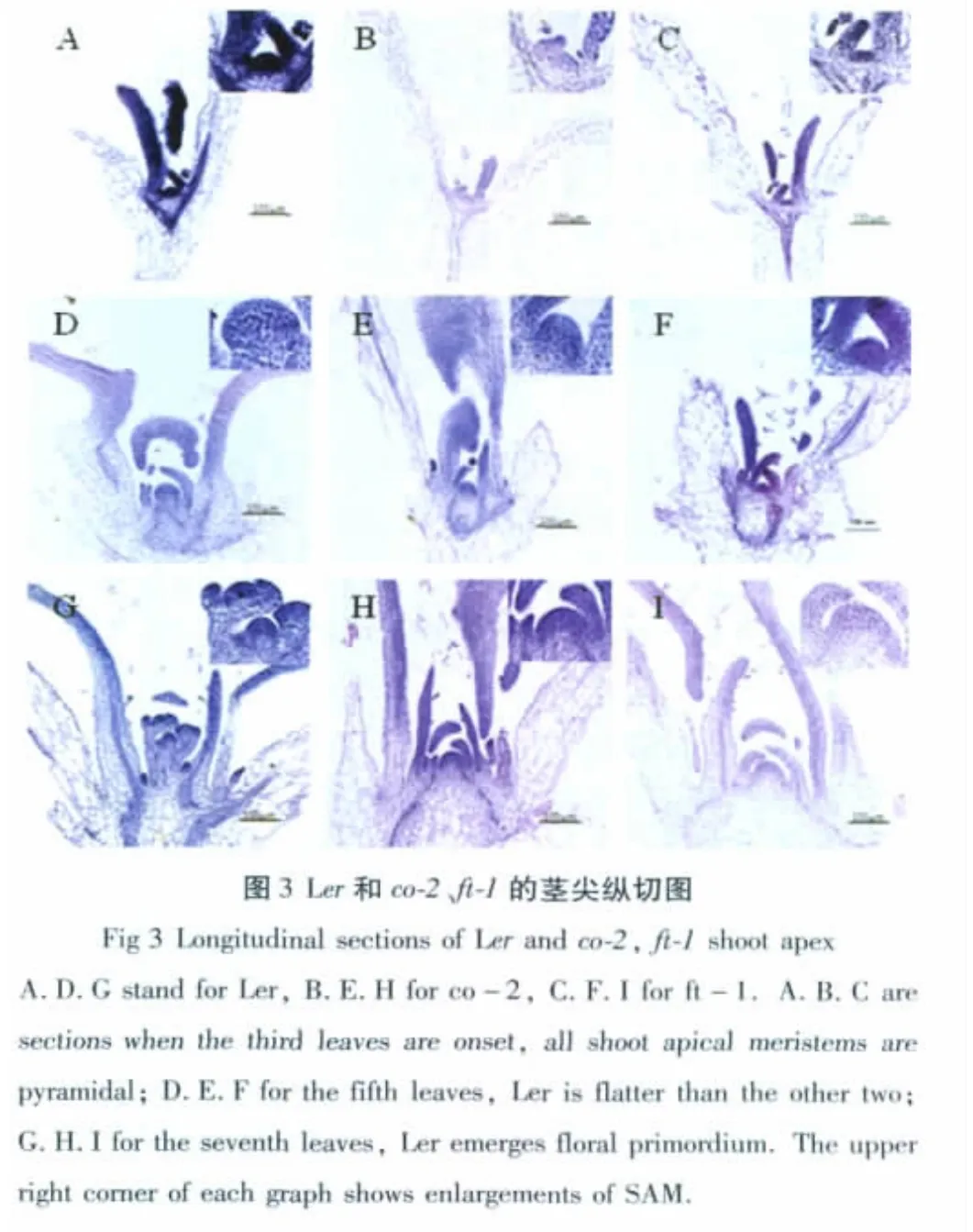
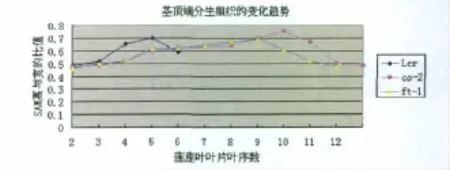
图4 SAM高与宽的比值测量结果图Fig 4 Height/width ratio of SAM
3 讨论
许多植物中形态发育的变化常预示着植株的成熟变化[13,14]。这种变化在某些木本植物和藤本植物中主要是出现异形叶性[5],而在草本植物中多是以远轴面表皮毛的密度和分布为标志[7]。为了确定拟南芥植株大小是否影响远轴面表皮毛的分布,Telfer等检测了与开花相关的突变体psd,amp1-1和amp1(cop2)的表型,发现它们与野生型比较,突变体上出现远轴面表皮毛的叶片数目不同,但出现的时间却差不多,说明这种变化可能主要影响叶的起始速率[7];其它晚花突变体的研究表明,叶片出现远轴面表皮毛与野生型比较明显推迟,预示着很多植物的营养生长时相转变是与植物获得生殖能力相关的[10,14]。研究表明,远轴面表皮毛的产生受到环境和与开花时间相关的突变体的影响[7]。然而,关于营养生长时相转变的相关研究尚缺乏形态学的系统观察,营养生长时相转变的茎端分生组织特征决定也不清楚。为此我们选择了与光周期途径相关的两种晚花突变体进行了研究,发现表皮毛的类型和分布会随茎发育时相的变化而变化,叶片除子叶之外,一开始就有近轴面表皮毛的出现,并且密度会随着叶片的生长而逐渐加大,但两种突变体远轴面表皮毛却在生出第5片真叶时才出现,且最先出现在主脉上,之后才分布到侧脉和叶片上,数目比近轴面表皮毛少很多;开花以后,靠近主花序的茎生叶近轴面表皮毛越来越少,直到光滑,而远轴面表皮毛却越来越多。实验中,无论是野生型还是晚花突变体,它们的时相转变相关特征如叶形,叶片长宽比值,茎顶端分生组织形态等表现出的时相特异性与远轴面表皮毛产生的时间较为吻和。另外,远轴面表皮毛的出现很明显,与木本植物常春藤、合欢等异形叶一样,是一种质量性状,可作为形态学上的量化指标,所以拟南芥中可将其作为营养生长时相转变的标志。与此同时,突变体较野生型在开花时间上晚了近一倍的时间,莲座叶的数目也比野生型多了一倍,而远轴面表皮毛的出现情况,野生型多在第4片真叶上,co-2和 ft-1多在第5片真叶上,说明拟南芥晚花突变体延迟了营养生长时相转变。
植物营养生长时相转变是生殖生长转变的序曲,幼龄期进入到成熟期后,植物才能感受内外界环境刺激,开花结实,所以营养生长时相转变对于植物生殖发育具有重要影响,其分子遗传调控的相关性也正在取得进展。
[1]Schultz E A,Haughn G W.Genetic analysis of the floral initiation process(FLIP)in Arabidopsis[J].Development,1993,119:745-765.
[2]Knight T A.Observations on the grafting of trees,In a letter from Thomas Andrew Knight,Esq.to Sir Joseph Banks,Bart.PRS[M].Philos Trans R Soc Lond,1795,85:290-295.
[3]Brink R A.Phase change in higher plants and somatic cell heredity[J].Q Rev Biol,1962,37:1-22.
[4]Kerstetter R A,Poethig R S.The specification of leaf identity during shoot development[J].Annu Rev Cell Devel Biol,1998,14:373-398.
[5]Goebel K.Organography of plants,especially of the Archegoniata and Spermaphyta,part I[M].General Organography(English translation by I.B.Balfour).London:Clarendon Press,1900.
[6]Bongard-Pierce D K,Evans M M S,Poethig R S.Heteroblastic features of leaf anatomy in maize and their genetic regulation[J].Int J Plant Sci,1996,157:331-340.
[7]Telfer A,Bollman K M,Poethig R S.Phase change and the regulation of trichome distribution in Arabidopsis thaliana[J].Development,1997,124:645-654.
[8]Boland D J,Brooker M I H,Chippendale G M,et al.Forest trees of Australia[M].Australia:CSIRO Publishing,2006.
[9]Poethig R S.The past,present,and future of vegetative phase change[J].Plant Physiol,2010,154:541-544.
[10]Zimmerman R H,Hackett W P,Pharis R P.Hormonal aspects of phase change and precocious flowering[J].Encycl Plant Physiol,1985,11:79-115.
[11]Amasino R M,Michaels S D.The timing of flowering[J].Plant Physiol,2010,154:516-520.
[12]Surez-Lpez P,Wheatley K,Robson F,et al.CONSTANS mediates between the circadian clock and the control of flowering in Arabidopsis[J].Nature,2001,410:1116-1120.
[13]Allsopp A.Heteroblastic development in vascular plants[J].Adv Morphol,1967,6:127-171.
[14]Hackett W P.Juvenility,maturation and rejuvenation in woody plants[J].Hort Rev,1985,7:109-155.

