金属离子和食品添加剂对紫甘薯花色苷稳定性的影响
付红岩,李自强,姚 晶,张 筠,姜瞻梅,*
(1.黑龙江东方学院,黑龙江哈尔滨150086;2.东北农业大学,黑龙江哈尔滨150001)
花色苷(Anthocyanin)是一种广泛分布于自然界的人们最为熟悉的水溶性天然色素,它们构成了植物王国中绝大多数品种的红色、紫色、蓝色和黄色等。花色苷的来源也十分丰富,广泛的存在于植物的果实、花、茎和叶中的液泡内,如紫葡萄、黑豆、紫玉米、黑加仑、草莓、黑树莓、苹果、樱桃、紫甘蓝、茄子皮等,使其呈现红、紫红到蓝等不同颜色[1]。已知存在的天然花色苷有250多种,但花色苷仍未能广泛的应用于食品染色,其原因主要有三:首先它们的化学性质不稳定,而且难于提纯,所以不易作为商品大量获得。其次,花色苷与合成色素相比,其色度在数量级上要低100倍。而且其颜色很容易受到食品中发生的大量化学反应的影响[2]。紫甘薯花色苷(PSPA)是从紫色甘薯的块根中浸提出的一种优质的天然食用色素,色泽鲜亮自然,无毒,无特殊气味。近年来的研究表明,紫甘薯色素具有清除自由基、抗氧化、抗突变、降血压,改善肝机能等多种生理功能,在食品、化妆品及医药等行业中有着广阔的应用前景[3]。花色苷在加工过程中容易被氧化和破坏而失去生物活性,因此保持紫甘薯花色苷的生物活性是紫甘薯花色苷应用的一大关键。本论文主要研究紫甘薯花色苷在加工保藏过程中影响其稳定性的因素,为设计紫甘薯花色苷的加工和保藏工艺提供参考依据。
1 材料与方法
1.1 材料与仪器
紫甘薯 市售;葡萄糖、蔗糖、抗坏血酸、山梨酸钾 食品级。
紫外分光光度计Spectrum723 上海光谱仪器有限公司;恒温水浴锅HH.S21-Ni4 北京长安科学仪器;高速冷冻离心机GL-25MS(H2500R)GL-25M 上海卢湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 紫甘薯花色苷提取液的制备 新鲜紫甘薯切成约5mm薄片,在50℃温度下烘干至恒重。经中药粉碎机粉碎后,过60目筛,于-10℃冷藏避光保存。
结合毛建霏、顾红梅[4-5]等人的方法,取紫甘薯粉4g于250mL锥形瓶,加入100mL 0.1mol/L柠檬酸溶液,在25℃下超声半个小时,超声后于4000r/min下旋转离心,将上层提取液合并得到紫甘薯花色苷提取液。
1.2.2 紫甘薯花色苷提取液吸光值的测定 参考毛建飞[4]等人的方法,取5mL提取液于10mL试管,用0.1mol/L柠檬酸水溶液稀释至10mL。空白待测试管取相同量样品液,在定容前加入0.5mL 10%Na2SO3溶液。混匀并静置5min后分别于1cm的比色皿中。以加入Na2SO3溶液的提取液为空白,用分光光度计在波长518nm处测定提取液得到吸光值。
1.2.3 金属离子对紫甘薯花色苷稳定性影响
1.2.3.1 Zn2+对紫甘薯花色苷稳定性的影响 锌在食品中的最大允许值为20mg/kg(以Zn2+浓度计),在食品卫生标准使用范围内,向花色苷溶液中添加硫酸锌,使花色苷溶液中Zn2+的浓度分别为0、5、10、15、20(mg/kg,以 Zn2+计),在 50℃ 分别保温 1 和 3h后,对处理前后的紫甘薯花色苷提取液吸光度进行检测。
1.2.3.2 Cu2+对紫甘薯花色苷稳定性的影响 铜在食品中的最大允许值为10mg/kg(以Cu2+浓度计),在食品卫生标准使用范围内,向紫甘薯花色苷提取液中添加硫酸铜,使紫甘薯花色苷提取液中Cu2+的浓度分别为 0、2.5、5、7.5、10(mg/kg,以 Cu2+计)。吸光值检测方法如1.2.3.1。
1.2.3.3 Mg2+对紫甘薯花色苷稳定性的影响 为考察镁离子对紫甘薯花色苷稳定性的影响,向紫甘薯花色苷提取液中添加硫酸镁,使花色苷提取液中Mg2+的浓度分别为 0、0.05、0.1、0.15、0.2(mol/L,以Mg2+计)。吸光值检测方法如1.2.3.1。
1.2.3.4 K+对紫甘薯花色苷稳定性的影响 为考察K+对紫甘薯花色苷稳定性的影响,向紫甘薯花色苷提取液中添加氯化钾,使紫甘薯花色苷提取液中K+的浓度分别为 0、0.05、0.1、0.15、0.2(mol/L,以 K+计)。吸光值检测方法如1.2.3.1。
1.2.4 添加剂对紫甘薯花色苷稳定性的影响
1.2.4.1 葡萄糖对紫甘薯花色苷稳定性的影响 为考察葡萄糖对紫甘薯花色苷稳定性的影响,向紫甘薯花色苷提取液中添加葡萄糖,使待测溶液中葡萄糖浓度分别为0%、2%、4%、6%、8%。吸光值检测方法如1.2.3.1。
1.2.4.2 蔗糖对紫甘薯花色苷稳定性的影响 为考察蔗糖对紫甘薯花色苷稳定性的影响,向紫甘薯花色苷提取液中添加蔗糖,使待测溶液中蔗糖浓度分别为0%、2%、4%、6%、8%。50℃分别保温1、2、3h后,对处理前后的花色苷提取液吸光度进行检测。
1.2.4.3 抗坏血酸对紫甘薯花色苷稳定性的影响为考察抗坏血酸对紫甘薯花色苷稳定性的影响,向紫甘薯花色苷提取液中添加抗坏血酸,使待测溶液中抗坏血酸浓度分别为 0、1、1.5、2、2.5mg/mL。50℃分别保温1h后,对处理前后的花色苷提取液吸光度进行检测。
1.2.4.4 山梨酸钾对紫甘薯花色苷稳定性的影响 为考察山梨酸钾对紫甘薯花色苷稳定性的影响,向紫甘薯花色苷提取液中添加山梨酸钾,使待测溶液中山梨酸钾浓度分别为0.05%、0.1%、0.15%、0.2%。50℃分别保温1、3h后,对处理前后的花色苷提取液吸光度进行检测。
2 结果与分析
2.1 Zn2+对紫甘薯花色苷稳定性的影响
在所研究的浓度范围内(0~20mg/kg),Zn2+对紫甘薯花色苷影响规律如图1。

图1 Zn2+对紫甘薯花色苷稳定性的影响Fig.1 Effect of Zn2+on stability of anthocyanins pigment from purple sweetpotato
由图1可知,从整体上看,在食品卫生标准使用范围内,Zn2+对紫甘薯花色苷起增色作用,能帮助稳定花色苷构型。50℃下保持1h,除浓度为10mg/kg Zn2+紫甘薯花色苷提取液外,其余三个浓度与未添加Zn2+离子提取液吸光值相近。50℃下保持3h,添加Zn2+样品均较未添加样品吸光值增加,但各浓度间差异不大。说明Zn2+对紫甘薯花色苷起增色作用,能稳定花色苷构型,但在5~20mg/kg Zn2+浓度范围内,其稳定性作用与浓度无明显关系。
花色苷因为具有邻位羟基结构,能和金属离子形成配合物,这种配合物的稳定性高于花色苷,一旦生成不易逆转,从而体现出对花色苷稳定性影响的作用。50℃保温1h,Zn2+浓度为10mg/kg样品组,其吸光值低于未添加对照组,保温3h则显现出对紫甘薯花色苷的增色作用,且与其他添加组吸光值相近,推测可能是锌离子与紫甘薯花色苷间的平衡作用有关。
2.2 Cu2+对紫甘薯花色苷稳定性的影响
在所研究浓度范围内(0~10mg/kg),Cu2+对紫甘薯花色苷影响规律如图2。
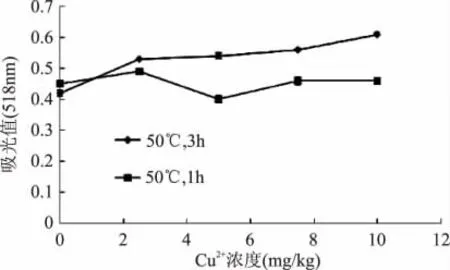
图2 Cu2+对紫甘薯花色苷稳定性的影响Fig.2 Effect of Cu2+on stability of anthocyanins pigment from purple sweetpotato
由图2可知,从整体上看,在食品卫生标准使用范围内,Cu2+对紫甘薯花色苷起增色作用,能帮助稳定花色苷构型。50℃下保持1h,除浓度为5mg/kg Cu2+的紫甘薯花色苷提取液外,其余三个浓度与未添加Cu2+离子提取液吸光值相近。50℃下保持3h,添加Cu2+样品均较未添加样品吸光值增加,10mg/kg添加组在50℃条件下保存3h,吸光值增加33.3%。
Cu2+对紫甘薯花色苷起增色作用,能稳定花色苷构型。其中Cu2+浓度为5mg/kg样品组其吸光值在保温1h下低于未添加对照组,保温3h下显现出对紫甘薯花色苷的增色作用,其可能原因同2.1。
2.3 Mg2+对紫甘薯花色苷稳定性的影响
在所研究浓度范围内(0~0.2mol/L),Mg2+对紫甘薯花色苷影响规律如图3。
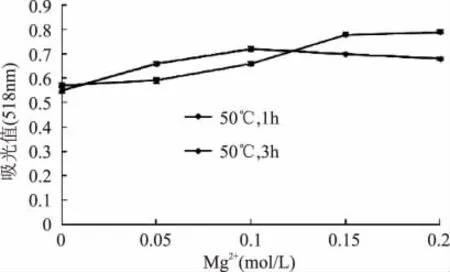
图3 Mg2+对紫甘薯花色苷稳定性的影响Fig.3 Effect of Mg2+on stability of anthocyanins pigment from purple sweetpotato
由图3可知,从整体上看,Mg2+对甘薯花色苷起稳定作用。50℃下保温3h,添加Mg2+样品吸光值均大于未添加组,且随浓度升高,吸光值递增。50℃下保温1h,添加Mg2+样品吸光值均大于较未添加对照组,Mg2+浓度超过0.15mol/L时,Mg2+对紫甘薯花色苷增色能力减弱,其吸光值下降。从整理来看Mg2+具有稳定紫甘薯花色苷的作用,能帮助稳定花色苷构型,但高浓度组(>0.15mol/L)随时间延长,增色作用减弱,这可能Mg2+与紫甘薯花色苷配合物稳定性有关。
2.4 K+对紫甘薯花色苷稳定性的影响
在所研究浓度范围内(0~0.2mol/L),K+对紫甘薯花色苷影响规律如图4。
由图4可知,从整体上看,K+对紫甘薯花色苷起增色作用。50℃下保持1h,各浓度K+添加组与未添加对照组吸光值相近。50℃下保持3h,添加K+样品均较未添加样品吸光值增加,浓度低于0.15mol/L时,随浓度升高,吸光值明显增加,经单因素方差分析,与未添加样品差异显著。说明K+对紫甘薯花色苷起增色作用,能稳定花色苷构型,但K+浓度超过0.15mol/L时,其对紫甘薯花色苷增色作用减弱,可能原因同2.3。

图4 K+对紫甘薯花色苷稳定性的影响Fig.4 Effect of K+on stability of anthocyanins pigment from purple sweetpotato
2.5 葡萄糖对紫甘薯花色苷稳定性的影响
在所研究浓度范围(0~8%,以质量计)内,葡萄糖对紫甘薯花色苷影响规律如图5。
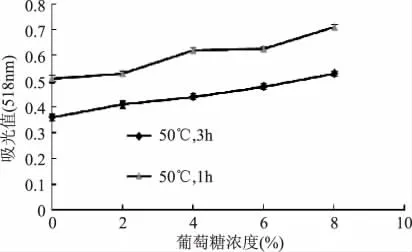
图5 葡萄糖对紫甘薯花色苷稳定性的影响Fig.5 Effect of glucose on stability of anthocyanins pigment from purple sweetpotato
由图5可知,从整体上看,葡萄糖对紫甘薯花色苷起增色作用,能帮助稳定花色苷构型。50℃下保持1、3h,添加葡萄糖组吸光值均大于未对照组吸光值,且在研究浓度范围内,随葡萄糖浓度升高,紫甘薯花色苷提取液吸光值逐渐递增,经单因素方差分析,差异性显著。
可见葡萄糖对花色苷的稳定性影响与糖浓度有关,在高浓度的糖存在下,由于水分活度降低,花色苷生成假碱式结构的速度减慢,所以花色苷的颜色得到了保护。
糖及其降解产物均能引起花色苷的降解,Daravingas等在研究中发现蔗糖、果糖、葡萄糖和木糖均能以同样的方式加速花色苷的降解,糖的典型降解产物中糠醛对花色苷的降解比羟甲基糠醛更重要[6]。在本实验过程中未见高浓度葡萄糖与蔗糖对紫甘薯花色苷提取液稳定性影响,可能是因为提取液低pH(pH3.07)抑制了美拉德反应。
2.6 蔗糖对紫甘薯花色苷稳定性的影响
在所研究浓度范围内(0~8%,以质量计),蔗糖对紫甘薯花色苷影响规律如图6。
由图6可知,从整体上看,蔗糖对紫甘薯花色苷起增色作用,能帮助稳定花色苷构型。50℃下保持1、3h,添加蔗糖组吸光值均大于未对照组吸光值,差异显著,添加蔗糖比对照组吸光值均增高0.1以上,且在研究浓度范围内,随蔗糖浓度升高,紫甘薯花色苷提取液吸光值逐渐递增。其原因同2.5。

图6 蔗糖对紫甘薯花色苷稳定性的影响Fig.6 Effect of sucrose on stability of anthocyanins pigment from purple sweetpotato
2.7 山梨酸钾对紫甘薯花色苷稳定性的影响
在所研究浓度范围内(0~0.2%,以质量计),山梨酸钾对紫甘薯花色苷影响规律如图7。

图7 山梨酸钾对紫甘薯花色苷稳定性的影响Fig.7 Effect of potassium sorbate on stability of anthocyanins pigment from purple sweetpotato
由图7可以看出,添加4种不同浓度山梨酸钾,50℃保存1h,紫甘薯花色苷提取液吸光值接近未添加对照组。50℃保存3h,紫甘薯花色苷提取液的吸光值明显高于未添加对照组。由此可见,山梨酸钾对紫甘薯花色苷有一定的护色作用。
2.8 抗坏血酸对紫甘薯花色苷稳定性的影响
在所研究浓度范围内(0~2.5mg/mL),抗坏血酸对紫甘薯花色苷影响规律如图8。
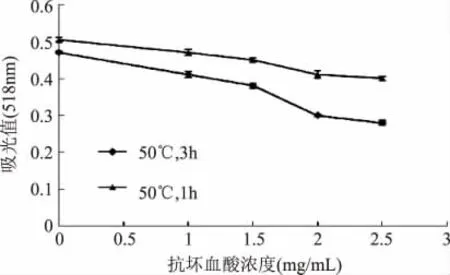
图8 抗坏血酸对紫甘薯花色苷稳定性的影响Fig.8 Effect of ascorbic acid on stability of anthocyanins pigment from purple sweetpotato
由图8可以看出,添加4种浓度抗坏血酸后,紫甘薯花色苷溶液的稳定性有所降低,添加抗坏血酸的花色苷提取液的吸光度从1h即低于未添加组,且溶液抗坏血酸浓度越高,吸光度越低,抗坏血酸浓度为0.25mg/mL的花色苷提取液,50℃下保温3h,吸光值下39%。
由此可见,抗坏血酸对黑莓色素有明显的降解作用,这可能是因为抗坏血酸被氧化后能产生H2O2,H2O2直接亲核进攻花色苷的C2位,使花色苷开环生成查尔酮引起花色苷的降解。
3 结论
不同的金属离子和食品添加剂对紫甘薯花色苷稳定性起到不同的作用:5种金属离子K+、Mg2+、Zn2+、Cu2+均有一定的护色或增色作用,帮助稳定花色苷构型。其中Zn2+、Cu2+均显现出较强的增色作用,Cu2+增色能力高于 Zn2+,10mg/kg Cu2+添加组在50℃条件下保存3h,吸光值增加33.3%,同浓度Zn2+添加组吸光值增加26.2%;Mg2+与 K+浓度超过0.15mol/L时其稳定作用减弱,这可能Mg2+、K+与紫甘薯花色苷配合物稳定性有关。
甜味剂葡萄糖和蔗糖对紫甘薯花色苷均有一定的护色作用,且在研究浓度范围内(0~8%,以质量计),随葡萄糖、蔗糖浓度升高,紫甘薯花色苷提取液吸光值逐渐递增。可见葡萄糖对花色苷的稳定性影响与糖浓度有关,在高浓度的糖存在下,由于水分活度降低,花色苷生成假碱式结构的速度减慢,所以花色苷的颜色得到了保护。防腐剂山梨酸钾对紫甘薯花色苷有一定的护色作用,但效果并不明显。抗坏血酸对紫甘薯花色苷有明显的破坏作用,50℃下保温3h,吸光值下降39%,这可能是因为抗坏血酸被氧化后能产生H2O2,H2O2直接亲核进攻花色苷的C2位,使花色苷开环生成查尔酮引起花色苷的降解。
[1]庞志申.2000.花色苷研究概况[J].北京农业科学,2000,18(5):37-42.
[2]任玉林,李华,邴贵德.天然食用色素-花色苷[J].食品科学,1995,7(16):22-27.
[3]Truong V,Deighton N,Thompson R T,et al.Characterization of Anthocyanins and Anthocyani dins in Purple -FleshedSweetpotatoes by HPLC-DAD/ESI-MS/MS[J].Journal of Agricultural and Food Chemistry,2010,58(2):404-410.
[4]毛建霏,付成平,郭灵安,等.可见分光光度法测定紫甘薯总花青素含量[J].食品与发酵科技,2010(2):101-104.
[5]顾红梅,张新申,蒋小萍.超声波法和冻结-融解法相结合提取紫甘薯中花色甙[J].食品科学,2004,25(7):104-108.
[6]Daravingas G,Cain R F.Thermal degradation of black raspberry anthocyanin pigments in model systems[J].Journal of Food Science,1968(33):138-142.

