酶法辅助提取红松种壳多酚的工艺优化研究
黄雨洋,王振宇
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150090;3.黑龙江粮食职业学院,黑龙江哈尔滨150080)
红松(Pinus koraiensis),亦称果松、海松。常绿乔木,高达40m。叶五针一束,长6~12cm。分布于我国东北长白山到小兴安岭地区,常与鱼鳞松、红皮云杉等组成混交林,是重要的农林资源,其果实红松种子以其颗粒饱满,营养丰富而闻名,自古就是食疗佳品,具有较高的药用价值及保健功能。研究表明,松属植物中含有萜类、多酚类、生物碱等多种生物活性成分[1],具有抗氧化、抗肿瘤及抗菌等生物活性[2-3]。其中多酚类成分是重要的抗氧化剂,具有很大的开发潜力。在利用食用松仁之后的红松种壳基本属于废弃物,没有得到充分利用,造成了资源浪费。有研究报道,红松种壳中多酚类成分具有抗氧化活性,可研制新药用于自由基引发疾病(心血管病、癌症等)的防御和治疗[4-5]。酶法辅助提取植物活性物质是近年来新兴的一种有效的提取方法。应用该方法对氨基酸、蛋白质和黄酮类物质、萜类物质进行提取的研究都有报道[6-8],但将此方法应用到红松壳多酚提取方面的研究尚未见文献报道。与传统提取方法相比,酶法提取具有无毒性、效率高、反应条件温和及催化活力可被调节控制等优势[9]。植物组织中的黄酮类物质等有效成分大多包裹在细胞壁中,对这些有效成分的提取,传统的热水、酸、碱、有机溶剂提取法,受细胞壁主要成分纤维素的阻碍,往往提取效率较低。恰当地利用纤维素酶处理这些植物材料,可改变细胞壁的通透性,提高有效成分的提取[10]。因此,作者采用纤维素酶辅助法对红松壳中多酚类物质的提取工艺进行了研究。在单因素实验的基础上,采用响应面分析法对酶法提取红松壳中多酚类物质的提取工艺和条件进行了优化,旨在探索一种在较低温度下进行快速、简便、最大限度地提取红松壳中多酚有效成分的提取方法。
1 材料与方法
1.1 材料与仪器
红松种子壳 收集于黑龙江省伊春,粉碎后40目过筛,低温干燥至恒质量后备用;纤维素酶(Sanlandchem international Inc,30u/mg)、没食子酸、福林试剂、碳酸钠、浓盐酸、氢氧化钠、无水乙醇 国产分析纯。
高速万能粉碎机 天津泰斯特仪器公司;恒温水浴锅 北京医疗电子仪器厂;酸度计 上海大中分析仪器厂;T6新世纪紫外可见分光光度计 北京普析通用公司;R-205B旋转蒸发仪 上海申胜仪器公司;电子天平 西安兴成智仪器。
1.2 实验方法
1.2.1 工艺流程 红松种壳→40℃条件下烘干→粉碎过40目筛→准确称取5.0g松壳粗粉于四颈中加入酶液→在不同酶解条件下(酶解时间、料液比、酶解温度、加酶量、pH)酶解处理→加入乙醇溶液→水浴振荡浸提→离心取上清液→测定多酚含量。
1.2.2 Folin-ciocalteu法测定总酚类成分含量
1.2.2.1 标准曲线的建立[8]准确称取没食子酸50mg,先加入少量乙醇,待没食子酸全部溶解后,加乙醇定容至500mL混合均匀得到浓度为100μg/mL的没食子酸溶液。量取0.05、0.10、0.15、0.20、0.25、0.30、0.35mL置于10mL比色管中,加乙醇定容至2mL,摇匀后加1.0mL福林试剂,4min后加入1.0mL 10%的碳酸钠溶液,25℃水浴下保持2h后测定溶液在765nm处的吸光值(A765),得到标准曲线方程:y=0.0534x+0.1529,R2=0.9992,式中,x为多酚含量(mg/g干重),y为吸光度。
1.2.2.2 松壳提取物中总酚含量的测定 准确吸取适量体积的松壳提取液1mL置于10mL比色管中,加乙醇定容至2mL。加入1.0mL福林试剂后摇匀,4min后加入1.0mL10%碳酸钠溶液,25℃水浴下保持2h后测定溶液在765nm处的吸光度值。将吸光度值代入标准曲线方程计算样品中多酚类成分含量。
1.2.3 响应面优化设计实验 分别考察乙醇浓度、酶解时间、液料比、酶解温度、加酶量、pH对红松种壳中总酚得率的影响,以确定各因素的适应范围。在单因素实验基础上,综合考虑6个因素对提取物中多酚得率的影响,按SAS9.1对红松种壳多酚条件进行优化。因素水平编码如表1所示。
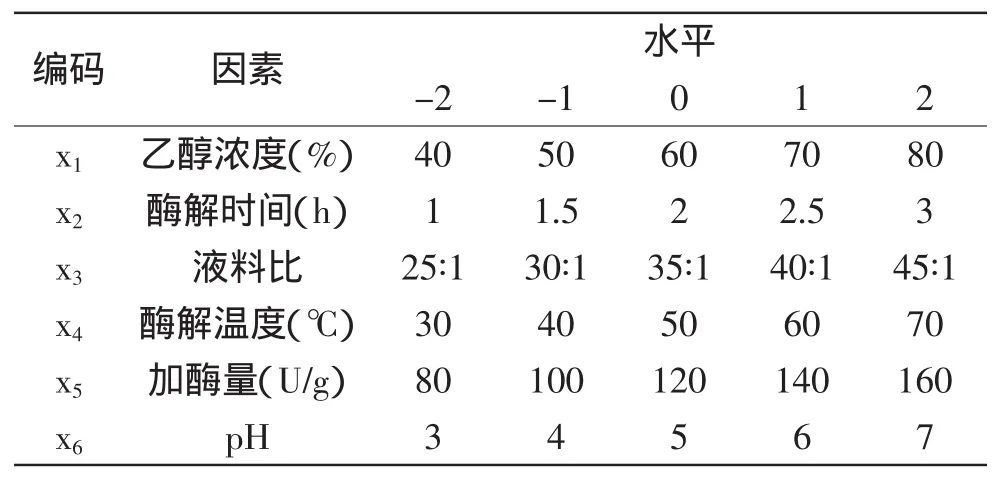
表1 因素水平编码表Table 1 Encode table of factors and levels
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 乙醇浓度对多酚得率的影响 设定液料比25∶1、温度50℃、pH5.0、加酶量60U/g底物条件下酶解2h,分别选取乙醇体积分数为20%、30%、40%、50%、60%、70%、80%、100%,测定多酚得率。由图1可知,随着乙醇体积分数的增加,多酚得率先增加后减小。在提取乙醇浓度为40%~80%附近,多酚得率有较大值出现。这是因为乙醇浓度为40%~80%溶液中传质阻力较小,而且随着溶剂的极性逐渐减小,多酚类物质的溶解性减小,从而导致多酚得率减小。

图1 乙醇浓度对多酚得率的影响Fig.1 Enzymatic temperature of polyphenols rate
2.1.2 酶解时间对多酚得率的影响 设定乙醇体积分数为50%、液料比25∶1、温度50℃、pH5.0、加酶量60U/g条件,分别选取酶解时间1、1.5、2、2.5、3、3.5、4h,测定多酚含量。由图2可知,随着酶解时间的延长,多酚得率先增加后略有下降。在酶解时间2h附近,多酚得率有较大值出现。多酚得率随酶解时间的增加,先增加后降低,这是因为酶解时间达到2h时,细胞壁大部分已经被酶解破坏,多数多酚被溶出,多酚得率最高。

图2 酶解时间对多酚得率的影响Fig.2 Enzymatic time of polyphenols rate
2.1.3 液料比对多酚得率的影响 设定乙醇体积分数为50%、温度50℃、pH5.0、加酶量60U/g条件下酶解2h,分别选取液料比为10∶1、15∶1、20∶1、25∶1、30∶1、35∶1、40∶1、45∶1,测定多酚含量。由图3可知,随着液料比比值的增加,多酚的得率先增大后略有下降。在液料比为35∶1附近,多酚得率有较大值出现。这是因为随着料液比的增加,溶剂和红松壳粉末之间的接触面增大,从而有利于红松树壳多酚得溶出。综合经济成本及后续浓缩处理等因素的考虑,液料比不宜继续增加。
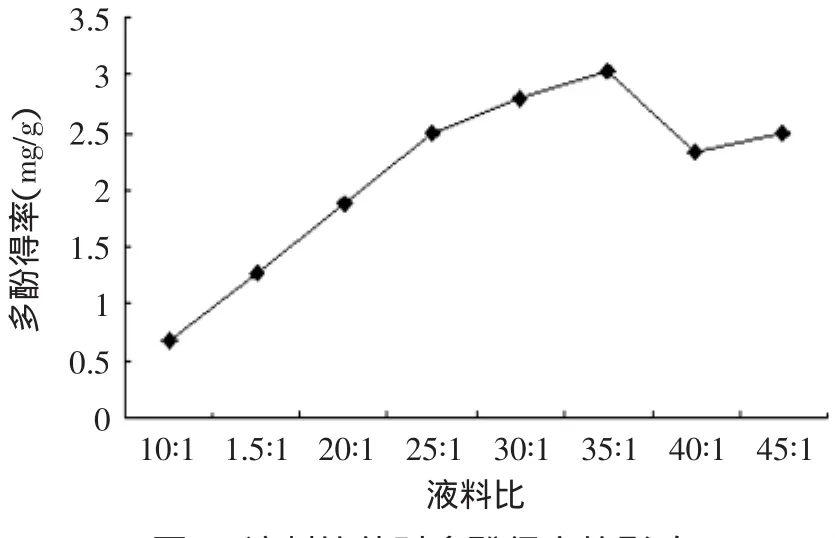
图3 液料比值对多酚得率的影响Fig.3 Liquid to solid ratio of polyphenols rate
2.1.4 温度对多酚得率的影响 设定乙醇体积法分数为50%、液料比25∶1、pH5.0、加酶量60U/g,分别选取酶解温度为20、30、40、50、60、70℃分别酶解2h,测定多酚含量。由图4可知,随着酶解温度的增大,多酚得率先增加后略有降低。在酶解温度为40~60℃附件,多酚得率有较大值出现。这是因为温度增加有利于提高酶活,当温度高于50℃会使多酚成分发生变性或降解,同时酶失活,导致多酚得率下降。

图4 温度对多酚得率的影响Fig.4 Temperature of polyphenol rate
2.1.5 pH对多酚得率的影响 设定乙醇体积分数为50%、液料比25∶1、温度50℃、加酶量60U/g条件下,分别选取酶解pH为2.0、3.0、4.0、5.0、6.0、7.0酶解2h,测定多酚含量。由图5可知,随着pH的增大,多酚得率先增加后下降。在酶解pH为5附近,多酚得率有较大值出现。这是因为纤维素酶的最佳作用pH范围为3.0~5.0,在此范围内能够发挥最大活力,可加速红松壳中多酚类物质的降解,使得多酚化合物的溶出效率提高,过低或过高的pH都会使纤维素酶活力降低,从而使多酚得率减小。

图5 pH对多酚得率的影响Fig.5 pH of polyphenol rate
2.1.6 酶用量对多酚得率的影响 设定乙醇体积分数为50%、液料比25∶1、温度50℃、pH5.0,分别选取酶用量为30、60、90、120、150、180、210、240U/g酶解2h,测定多酚含量。由图6可知,随着酶用量的增加,多酚得率先增加后不变。当酶用量大于120U/g后,多酚得率有较大值出现。这是因为红松壳多酚中含有大量的纤维素物质,它与多酚类物质结合紧密,纤维素酶能促使纤维素解链,使更多的多酚物质释放,从而使多酚得率提高,当加酶量为120U/g时,多酚得率达到最佳,酶解进行完全,此时继续增加加酶量,由于酶的反馈作用,酶解效率反而略有所下降。

图6 加酶量对多酚得率的影响Fig.6 Polyphenols rate plus the amount of enzyme
2.2 响应面法对松壳多酚提取工艺的优化
2.2.1 响应面实验设计 以红松壳多酚得率(y,mg/g)为响应值进行相应分析实验,Small Composite:Hartley Method设计每个因素取5个水平,以(-2,-1,0,1,2)编码,对数据进行二次回归拟合,得到包括一次项、平方项和交互项的二次方程,分析各因素的主效应和交互效应,最后在一定水平范围内求取最佳值[11-12]。表2中33组实验为因点和零点,其中析因点位自变量取值在x1、x2、x3、x4、x5、x6所构成的三维顶点,零点为区域的中心点,零点实验重复5次,用以估计实验误差。
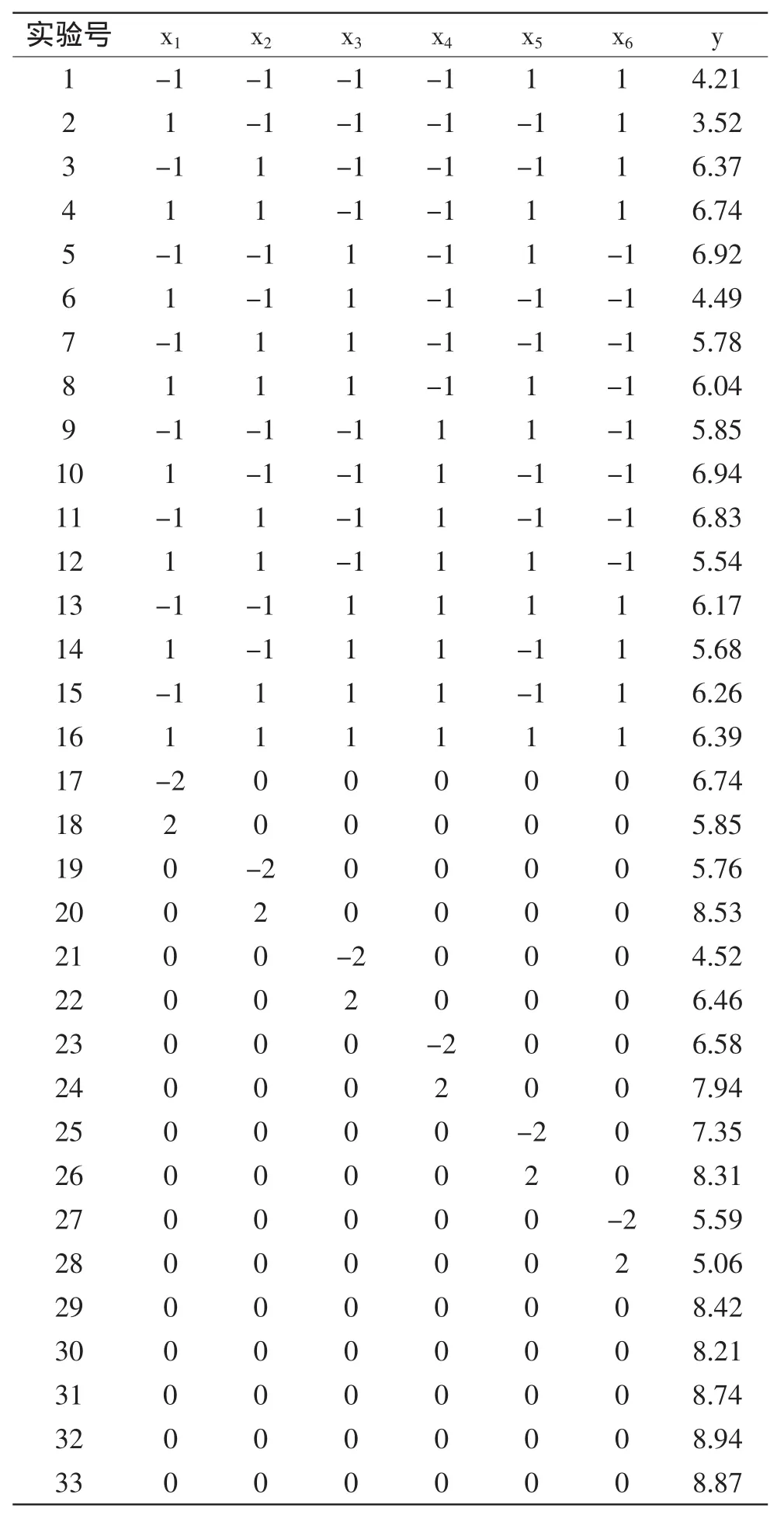
表2 实验设计及结果Table 2 Experimental design and results
2.2.2 回归方程建立与方差分析 利用SAS9.1软件对表2实验数据进行多元回归拟合,得到多酚得率(y)对乙醇浓度(x1)、酶解时间(x2)、料液比(x3)、酶解温度(x4)、加酶量(x5)、pH(x6)的二次多项回归模型为:
y=8.523-0.2225x1+0.693x2+0.485x3+0.34x4+0.24x5-0.133x6-0.522x12-0.116x1x2-0.126x1x3+0.121x1x4-0.307x1x5+0.106x1x6-0.309x22-0.234x2x3-0.338x2x4+0.032x2x5+0.387x2x6-0.723x32-0.058x3x4+0.289x3x5+0.009x3x6-0.280x42-0.344x4x5-0.377x4x6-0.138x52+0.086x5x6-0.764x62
表3是对方程的方差和回归分析结果。由表3可知,模型一次项的因子贡献率为x2>x3>x4>x5>x1>x6,即单因素对多酚得率的影响大小依次是酶解时间、液料比、酶解温度、加酶量、乙醇浓度、pH;二次项x12、x22、x32、x42、x62显著;交互项中x2x4、x2x6、x3x5、x4x5显著。由表3可知FModel=14.90875,p<0.01,表明二次多元回归模型极显著;p失拟项=0.116485>0.05,说明模拟失拟不显著;模型的相关系数R2=98.77%,表明方程模型与实验数据有98.77%的符合度,该模型有很高的可信度度,可以用此模型对红松壳提取多酚的工艺进行分析和预测。
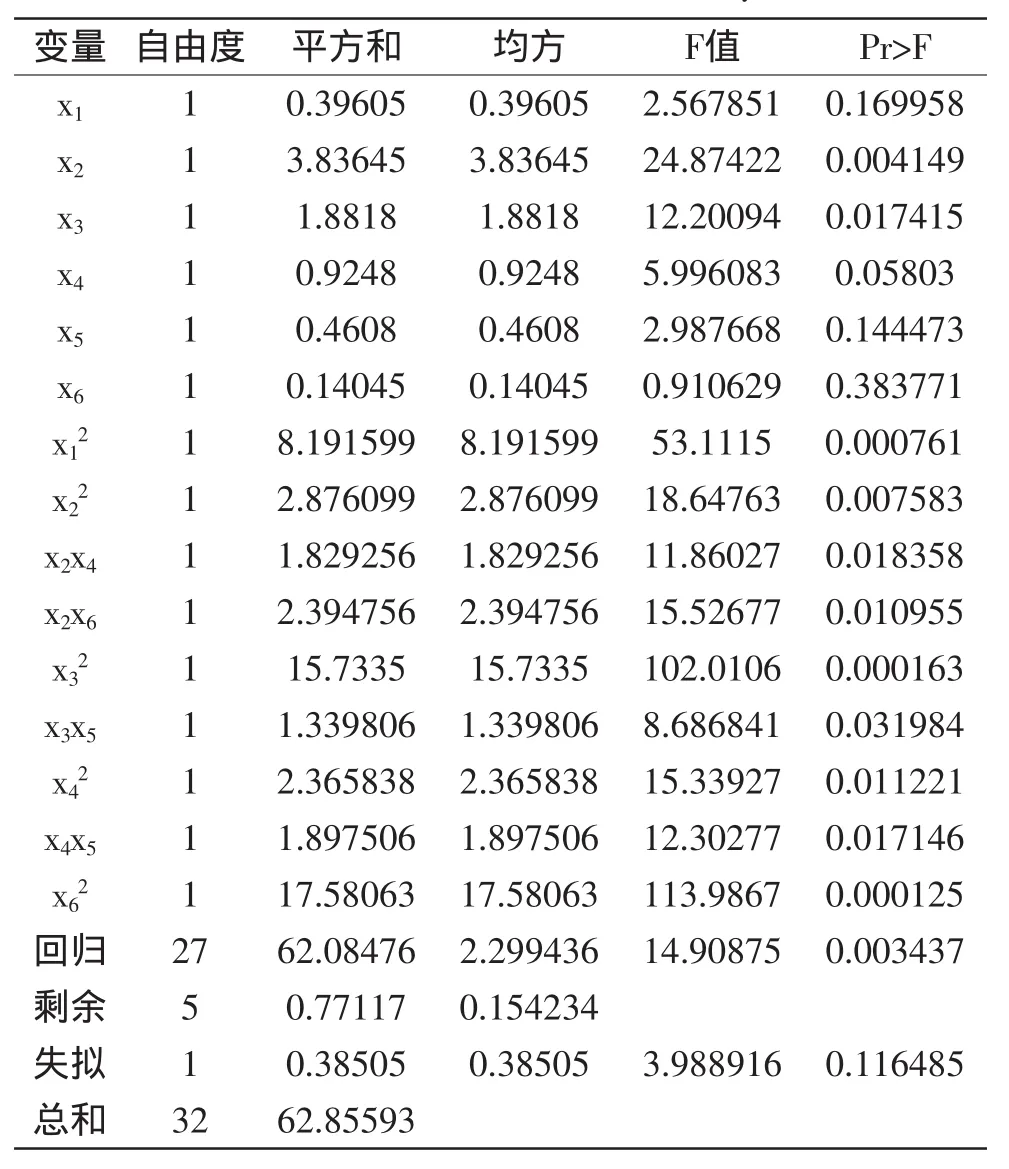
表3 回归与方差分析结果Table 3 The table of variance analysis
2.2.3 多酚得率的响应面法分析 响应面分析的图形是特定的响应面对应自变量构成的一个三维空间图,可以直观的反映出各自变量对响应值的影响[13]。图7~图10为因素交互作用的响应面图。响应面是响应值对各实验因素所构成的三维空间曲面图,因素对实验结果影响越大,表现为曲面越陡峭[14]。从图7~图10中可以看出,4个响应面均为开口向下的凸行曲线,说明响应值(红松壳多酚得率)存在极大值。

图7 酶解温度、酶解时间对多酚得率的响应面图Fig.7 Hydrolysis temperature and Hydrolysis time enzyme of the polyphenol yield response surface
酶解时间与酶解温度对红松壳多酚得率的交互作用见图7。酶解时间一定时,时间较短时,得率随着温度的增加而增加;时间较长时,红松壳得率随着温度的增加先增加后减少。
酶解时间与pH对红松壳多酚得率的交互作用见图8。酶解时间一定时,随着pH的增加,红松壳多酚得率先增加后减少。

图8 酶解时间、pH对多酚得率的响应面图Fig.8 Hydrolysis temperature and pH enzyme of the polyphenol yield response surface
液料比与加酶量对红松壳多酚得率的交互作用见图9。液料比一定时,随着加酶量的增加,红松壳多酚得率先增加后降低。

图9 液料比、加酶量对多酚得率的响应面图Fig.9 Liquid-solid ratio and the amount of enzyme of the polyphenol yield response surface
酶解温度与加酶量对红松壳多酚得率的交互作用见图10。酶解温度较低时,得率随着加酶量的增加而增加;酶解温度较高时,得率随酶量的增加先增加后减少。

图10 酶解温度、加酶量对多酚得率的响应面图Fig.10 Hydrolysis temperature and The amount of enzyme of the polyphenol yield response surface
2.2.4 实验验证与对比实验 为了检验模型预测的准确性,采用响应面优化的工艺条件(见表4,乙醇浓度61%、酶解时间2h、液料比36∶1、酶解温度62℃、加酶量106U/g、pH4.6)进行提取红松壳多酚得率验证实验。由表5结果可知,3次验证实验结果所测得的红松壳多酚得率的平均值为8.93mg/g,在预测值标准误差内,可见该模型能较好地预测红松壳多酚的提取情况,证明此次RSM实验参数准确可靠,具有一定的应用价值。

表4 响应面优化结果Table 4 Results of the optimization of response surface
由表5对比实验结果可知,在不加酶条件下提取红松种壳多酚(乙醇浓度61%、酶解时间2h、液料比36∶1、酶解温度62℃、pH4.6),多酚得率为7.96mg/g,比加酶提取工艺低0.97mg/g。由此可见,在乙醇提取红松壳多酚工艺中,采用纤维素酶预先进行酶解可以增加多酚得率。

表5 验证和对比实验结果Table 5 Validation test and contrast test results
3 结论
在单因素实验的基础上,考察了乙醇浓度、酶解时间、料液比、酶解温度、加酶量、pH对红松壳多酚得率的影响。由响应面分析实验得出,酶解时间、料液比、酶解温度、乙醇浓度是影响红松壳多酚得率的主要因素,其中酶解时间的影响最为显著。依据回归分析确定红松壳多酚提取的最佳工艺为乙醇浓度61%、酶解时间2h、液料比36∶1、酶解温度62℃、加酶量106U/g、pH4.6。在此工艺条件下,红松壳多酚得率可达8.93mg/g。由验证实验结果可见,通过响应面分析法优化红松壳多酚的提取工艺条件在实践上是可靠的。根据对比实验可知,在乙醇提取红松壳多酚工艺中,采用纤维素酶预先进行酶解可以增加多酚得率,增加量为0.97mg/g。而且,酶法辅助提取红松种壳多酚具有条件简便、反应时间短、反映条件温和、成本低、效率高等特点,具有一定的研究价值。
[1]Arrabal C,Cortijo M,Simon B F,et al.Differentiation among five Spanish Pinus Pinaster Provenance based on its oleoresin terpenic composition[J].Biochemical Systematics and Ecology,2005,33:1007-1016.
[2]D S Pureswaran, R Gries, H John.Quantitative Variation in Monoterpenesin FourSpeciesofConifers[J].Biochemical Systematics and Ecology,2004,32:1109-1136.
[3]C Arrabal,M Cortijo,B F Simon,et al.Differentiation among Five Spanish Pinus Pinaster Provenance Based on Its Oleoresin Terpenic Composition[J].Biochemical Systematics and Ecology,2005,33:1007-1016.
[4]Ribeiro S M R,Barbosa L C A,Queiroz J H,et al.Phenolic compounds and antioxidantcapacity ofBrazilian mango(Mangiferaindica L.) varieties[J].Food Chemistry,2008,110:620-626.
[5]Shikov A N,Makarov V G,Ryzhenkov V E.Plant fixed oils and extracts:Technology,standardization,properties[M].Moscow:Publishing house Russian Doctor,2004:177-185.
[6]张小清,程宁,秦蓓,等.酶解-溶剂提取银杏叶活性成分工艺条件[J].应用化工,2005,34(10):635-643.
[7]张巾英,张明春.应用纤维素酶提取中草药有效成分的研究进展[J].上海中医药杂志,2007,41(1):79-81.
[8]施英英,薛培俭,夏黎明,等.酶法提取葛根渣中异黄酮的研究[J].林产化学与工业,2006,26(1):62-64.
[9]苏东林,单杨,李高阳,等.酶法辅助提取柑桔皮总黄酮的工艺优化研究[J].农业工程学报,2008,24(4):240-245.
[10]郭娟,艾志录,崔建涛,等.苹果渣中多酚物质的福林法测定[J].食品工业科技,2006(2):178-180.
[11]吕国英,张作法,潘慧娟,等.响应面分析法优化香菇多糖发酵培养基[J].菌物学报,2010,29(1):106-112.
[12]汪鹏荣,蔡琪敏,崔宇辉,等.响应面优化红曲霉胞外多糖提取工艺[J].中国粮油学报,2011,26(12):83-87.
[13]孙萍萍,王颉,孙健,等.响应面法对缢圣粗多糖提取工艺的优化[J].水产科学,2010,29(4):203-205.
[14]稽豪,蒋冬花,杨叶,等.响应面法优化超声波辅助提取红曲米中水溶性色素[J].浙江师范大学学报:自然科学版,2011,34(1):91-96.

