产油丝状真菌高山被孢霉中蝶呤类化合物的提取及检测
王鸿超,陈海琴,*,赵建新,陈永泉,张 灏,王 磊,陈 卫
(1.食品科学与技术国家重点实验室,江南大学食品学院,江苏无锡214122;2.南开大学泰达生物技术学院,天津300457)
四氢生物蝶呤(BH4)广泛存在于自然界中,在高等生物中作为苯丙氨酸羟化酶、酪氨酸羟化酶、色氨酸羟化酶、一氧化氮合成酶以及烷基甘油单氧酶的必需辅助因子而存在,参与苯丙氨酸降解,血清素褪黑激素等神经传递素的合成过程,具有重要的生理功能[1-2]。研究还发现,BH4对长链多不饱和脂肪酸的脱氢和氧化有影响[3-5];BH4还可促进不饱和脂肪酸与磷脂的结合[6];苯丙酮尿症患者在服用BH4后,体内的多不饱和脂肪酸组分发生变化[7],这表明BH4与多不饱和脂肪酸的合成和积累也有重要关系。
BH4的传统来源为制药公司的有机合成,但是成本很高,而利用微生物发酵产BH4可以很好的解决这个问题。高山被孢霉是重要的产油丝状真菌,能够高产多种多不饱和脂肪酸[8]。通过本实验室前期对其全基因组测序以及四氢生物蝶呤的代谢途径鉴定,高山被孢霉是目前已知的唯一在分子水平上验证过可以从头合成BH4的真菌[9-10]。高山被孢霉BH4的合成途径见图1[9]。BH4及其前体二氢蝶呤三磷酸盐和6-丙酮酰四氢生物蝶呤的氧化产物生物蝶呤(Biopterin)、新蝶呤(Neopterin)、和蝶呤(Pterin)具有荧光吸收,可经高效液相色谱分离后经荧光检测器检测(图1)[11]。

图1 高山被孢霉的四氢生物蝶呤合成途径Fig.1 Pathways for BH4biosynthesis in M.alpina
BH4在哺乳动物、植物中的提取和检测方法都已得到广泛发展,主要通过HPLC或毛细管电泳将蝶呤混合物分离后,经电化学法直接检测或通过荧光法检测氧化产物来实现[11-13],而由于真菌一般不能自身合成BH4,在真菌中检测BH4的报道较少。同时由于真菌细胞壁较厚,细胞组成成分复杂,在高山被孢霉体内提取纯化蝶呤化合物也存在一定的难度。本研究采用离子交换树脂法纯化真菌体内蝶呤化合物,并运用高效液相色谱-荧光检测法进行检测,同时运用电喷雾质谱对定性结果进行确认。建立了一套真菌体内生物蝶呤化合物提取和检测的完整方法,为以后利用真菌发酵产BH4打下了基础。
1 材料与方法
1.1 材料与仪器
高山被孢霉孢子 接种于100mL肯德里克(Kendrick)培养基[14],25℃培养5d,过滤收集菌丝体,滤纸拍干样品,存于-80℃备用;蝶呤标准品(CAS号:2236-60-4,纯度95%)、新蝶呤标准品(CAS号:2009-64-5,纯度97.5%)、生物蝶呤标准品(CAS号:22150-76-1,纯度97%)标准品、Dowex®50WX8离子交换树脂 美国Sigma公司;甲醇、乙腈 色谱纯;其他试剂均为分析纯。
LC-20AT高效液相色谱仪、RF-20A荧光检测器、色谱工作站 日本岛津;热电Finnigan LCQ Advantage电喷雾质谱仪 美国;Eppendorf 5810R离心机 德国。
1.2 实验方法
1.2.1 标准溶液的配制 准确称取适量的标准品分别置于3个10mL的棕色容量瓶中,蝶呤、新蝶呤、生物蝶呤分别加数滴1mol/L NaOH溶液溶解,用超纯水稀释至刻度,摇匀,配成浓度分别为蝶呤76μg/mL、新蝶呤50μg/mL、生物蝶呤50μg/mL的标准储备液,置于冰箱内-80℃保存,保存期限为1个月。
1.2.2 高山被孢霉体内蝶呤化合物的提取 方法一:精确称取菌体样本0.5g,加入液氮研钵中充分研磨3次,加入500μL 2mol/L三氯乙酸,-20℃过夜。10000×g,30min离心去沉淀。称取1.2g离子交换树脂加入纯化柱,用超纯水清洗3次,1mol/L HCl清洗3次。将离心样品的上清液加入纯化柱中,用10mL超纯水洗涤后,再加入2mL 1mol/L醋酸铵甲醇溶液洗涤,接着加入7mL 1mol/L醋酸铵甲醇溶液洗脱并收集洗脱液。最后将洗脱液冻干后用甲醇复溶,即为所得样品。
方法二:精确称取菌体样本0.5g,加入液氮研钵中充分研磨3次。加入1mL 1mol/L HCl混匀,加入5mg二氧化锰摇匀,置于暗处避光氧化1h,然后加入100uL 3%维生素C溶液,接着加入500μL 2mol/L三氯乙酸,-20℃过夜,10000×g,30min离心去沉淀。称取1.2g离子交换树脂加入纯化柱,用超纯水清洗3次,1mol/L HCl清洗3次。将离心样品的上清加入纯化柱,用10mL超纯水洗涤后,再加入2mL 1mol/L醋酸铵甲醇溶液洗涤,接着加入7mL 1mol/L醋酸铵甲醇溶液洗脱并收集洗脱液。最后将洗脱液冻干后用甲醇复溶,即为所得样品。
方法三:精确称取菌体样本0.5g,加入液氮研钵中充分研磨3次。加入1mL 1mol/L HCl混匀,加入100μL碘-碘化钾溶液(含1%碘化钾和2%碘),置于暗处避光氧化1h,然后加入100μL 3%维生素C溶液,接着加入500μL 2mol/L三氯乙酸,-20℃过夜,10000×g,30min离心去沉淀。称取1.2g离子交换树脂加入纯化柱,用超纯水清洗3次,1mol/L HCL清洗3次。将离心样品的上清液加入纯化柱,用10mL超纯水洗涤后,再加入2mL 1mol/L醋酸铵甲醇溶液洗涤,接着加入7mL 1mol/L醋酸铵甲醇溶液洗脱并收集洗脱液。最后将洗脱液冻干后用甲醇复溶,即为所得样品。
1.2.3 高效液相色谱分析条件 采用Inertsil ODS-3 C18色谱柱(5μm,150mm×4.6mm;GL Science),荧光检测器激发波长设为350nm,吸收波长设为450nm。分别采用甲醇-水、乙腈-水、磷酸氢二钠缓冲溶液作流动相来尝试分离蝶呤类化合物。
1.2.4 电喷雾质谱条件 电喷雾电压为4.5kV,离子源温度为250℃,检测蝶呤和新蝶呤时采用负离子电离模式,检测生物蝶呤时采用正离子电离模式,扫描范围为100~300m/z,鞘气和辅助气为氮气。
2 结果与分析
2.1 色谱条件的选择
考察了不同流动相配比及流速对三种蝶呤类化合物色谱分离行为的影响。结果表明,乙腈-水体系作流动相时,各种蝶呤的荧光响应强度较低,且三种蝶呤类化合物的保留时间过短,同时其他共存物质对其检测干扰较大。而当使用甲醇-水作为流动相时,各物质分离效果较好,荧光响应强度较好。当使用10mmol/L磷酸二氢钠(pH6.0)作为流动相,流速设为1.2mL/min时,与采用10%甲醇作为流动相时相比,荧光响应强度更强。同时,各物质分离效果良好,保留时间适中,检测时间较短,且检测不受其他共存物质的影响。因此采用10mmol/L磷酸二氢钠(pH6.0)作为流动相,蝶呤、新蝶呤、生物蝶呤的标准品色谱图见图2。为分步收集样品进行电喷雾质谱分析,HPLC的流动相设为10%、甲醇,流速为1mL/min[15]。

图2 新蝶呤(A),蝶呤(B),和生物蝶呤(C)标准品图及高山被孢霉体内蝶呤化合物成分图(D)Fig.2 HPLC chromatograms of neopterin standard(A),pterin standard(B),biopterin standard(C),and the pteridines in M.alpina(D)
2.2 蝶呤标准品标准曲线与检出限
取适量的标准储备液,分别配制一系列不同浓度的标准工作液,按选定的色谱分离条件进行分析,并以峰面积对浓度作图。结果表明:新蝶呤、蝶呤和生物蝶呤在0.005~1.5、0.005~2、0.01~2.0μg/mL的浓度范围内与色谱峰面积呈良好的线性关系,其线性回归方程分别为:y=615.66x+0.29(r=0.9991);y=481.07x-2.58(r=0.9977);y=46.5x-2.83(r=0.9963),本方法的检出限依次是:0.003、0.002、0.005μg/mL。
2.3 不同样品处理方法的选择
为保证分析结果有效准确,考察了3种前处理方法对检测真菌中蝶呤类化合物的影响效果。当采用方法一对样品进行处理时,由于未加氧化剂,高山被孢霉体内的BH4及其前体6-丙酮酰四氢生物蝶呤,二氢蝶呤三磷酸盐没有被氧化成相应的氧化产物,因此荧光响应强度很低。方法二与方法三中,由于氧化剂的加入,使得四氢生物蝶呤及其前体都能被氧化成相应的氧化产物生物蝶呤,蝶呤和新蝶呤,荧光响应强度都很高,但是方法二中的二氧化锰氧化剂虽然能充分氧化四氢生物蝶呤及其前体,但样品检测时杂峰较多,干扰了各蝶呤化合物的检测,而方法三中这两个问题均得以解决,因此是目前从真菌高山被孢霉中提取蝶呤类化合物的最佳方法,高山被孢霉中蝶呤类化合物的检测结果见图2。液氮破壁也是本实验的关键步骤,充分的研磨能够保证真菌样品的破壁充分,同时合适的纯化条件也很重要,进一步的实验可通过选用不同离子交换树脂来优化纯化条件。
2.4 高山被孢霉中的蝶呤组分分析及方法学考察
2.4.1 精密度实验 按照上述方法提取纯化的样品,经高效液相色谱-荧光检测法分析并与标准品对照,发现保留时间为3、11.5、12.5min的组分分别为新蝶呤、蝶呤、生物蝶呤。样品中各组分的浓度由标准曲线计算得出,每个样品平行测定3次,结果见表1。相对标准偏差(RSD)<5%,表明本方法有良好的精密度。
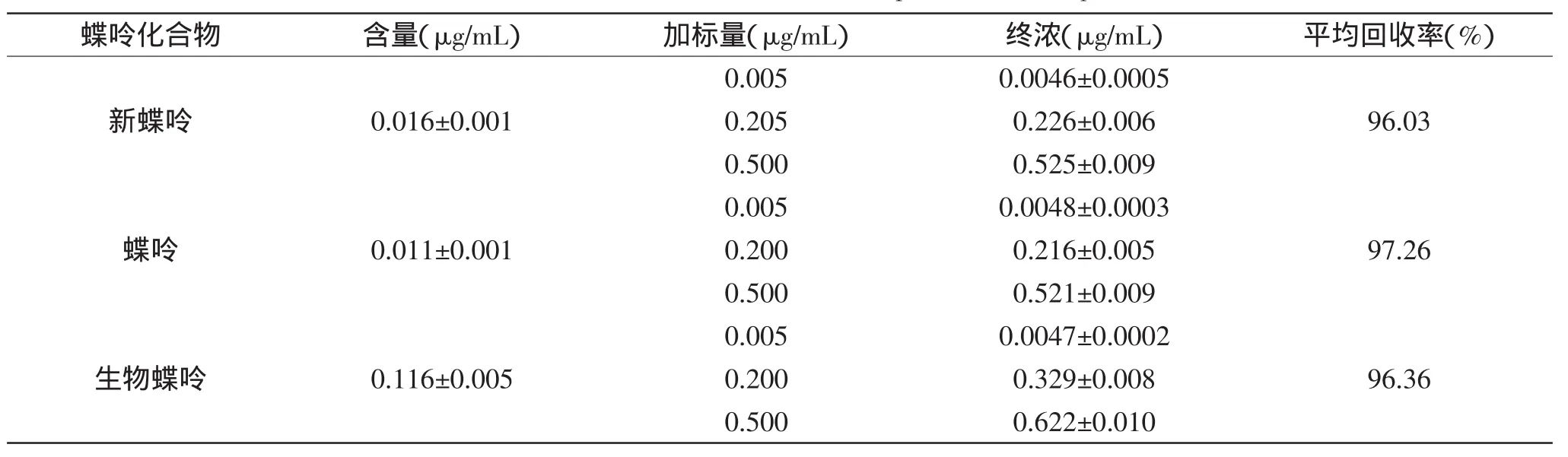
表1 高山被孢霉体内的蝶呤化合物含量及加标回收率Table 1 The amounts and recoveries of pterines in M.alpina
2.4.2 重复性实验 取一批3份上述条件下培养的样品,分别进行样品处理,测定其中新蝶呤、蝶呤、生物蝶呤的含量,相对标准偏差(RSD)为6.15%,表明本方法有较好的重复性。
2.4.3 回收率实验 对上述样品进行加标回收实验,分别添加三个不同水平的蝶呤、新蝶呤和生物蝶呤的标准溶液,每个水平均测定3次,结果见表1。三种蝶呤类化合物的平均回收率均在96%~98%之间,相对标准偏差(RSD)小于5%,表明本方法测定结果准确可靠。
2.5 高山被孢霉蝶呤样品的电喷雾质谱分析
为进一步确定高山被孢霉中的各氧化产物的组成,经过高效液相色谱分离的各组分经分布收集后,对其进行了电喷雾质谱分析,结果见图3。负离子电离模式下,保留时间为3min的峰测得m/z值为252.62(图3A),与新蝶呤的相对分子质量253.22相符合,保留时间为11.5min的峰测得m/z值为162.88(图3B),与蝶呤的相对分子质量163.14相符合。正离子电离模式下,保留时间为12.5min的峰m/z值为238.87(图3C),与生物蝶呤的相对分子质量237.22相符合。实验结果进一步证明了高效液相色谱分离的各组分的化合物成分。

图3 高山被孢霉体内新蝶呤(A),蝶呤(B)和生物蝶呤(C)的电喷雾质谱图Fig.3 ESI MS spectra of neopterin(A),pterin(B),biopterin(C)in M.alpina
3 结论
本文系统地探讨了产油丝状真菌中二氢蝶呤三磷酸盐,6-丙酮酰四氢生物蝶呤和BH4的检测方法。研究了高山被孢霉中蝶呤化合物的提取方法,并建立了利用高效液相色谱法-荧光法检测高山被孢霉体内新蝶呤、蝶呤、生物蝶呤的新方法。此方法快速、准确,能满足实际样品分析要求,为进一步利用高山被孢霉产四氢生物蝶呤奠定了基础。
[1]Werner-Felmayer G, Golderer G, Werner E R.Tetrahydrobiopterin biosynthesis,utilization and pharmacological effects[J].Curr Drug Metab,2002,3(2):159-173.
[2]孟英韬.四氢生物蝶呤缺乏症研究进展[J].国外医学:儿科学分册,1997(4):27-30.
[3]Kaufman S.New tetrahydrobiopterin-dependent systems[J].Annu Rev Nutr,1993,13:261-286.
[4]Forrest H S,Van Baalen C.Microbiology of unconjugated pteridines[J].Annu Rev Microbiol,1970,24:91-108.
[5]Kaufman S.Pteridine cofactors[J].Annu Rev Biochem,1967,36:171-184.
[6]Rudzite V,Jurika E,Baier-Bitterlich G,et al.Pteridines and lipid metabolism[J].Pteridines,1998,9(2):103-112.
[7]Vilaseca M A,Lambruschini N,Gomez-Lopez L,et al.Longchain polyunsaturated fatty acid statusin phenylketonuric patients treated with tetrahydrobiopterin[J].Clinical Biochemistry,2010,43(4-5):411-415.
[8]Sakuradani E,Ando A,Ogawa J,et al.Improved production of various polyunsaturated fatty acids through filamentous fungus Mortierella alpina breeding[J].Appl Microbiol Biotechnol,2009,84(1):1-10.
[9]Wang H,Yang B,Hao G,et al.Biochemical characterization of the tetrahydrobiopterin synthesis pathway in the oleaginous fungus Mortierella alpina[J].Microbiology,2011,157(11):3059-3070.
[10]Wang L,Chen W,Feng Y,et al.Genome characterization of the oleaginous fungus Mortierella alpina[J].PLoS One,2011,6(12):28319.
[11]Maier J,Ninnemann H.Biosynthesis of pteridines in Neurospora crassa,Phycomyces blakesleeanus and Euglena gracilis:detection and characterization of biosynthetic enzymes[J].Photochem Photobiol,1995,61(1):43-53.
[12]Willoughby R E, Opladen T, MaierT, etal.Tetrahydrobiopterin deficiency in human rabies[J].J Inherit Metab Dis,2009,32(1):65-72.
[13]Han F,Huynh B H,Shi H,et al.Pteridine analysis in urine by capillary electrophoresis using laser-induced fluorescence detection[J].Anal Chem,1999,71(7):1265-1269.
[14]Kendrick A,Ratledge C.Desaturation of polyunsaturated fatty acids in Mucor circinelloides and the involvement of a novel membrane-bound malic enzyme[J].Eur J Biochem,1992,209(2):667-673.
[15]Son J K,Rosazza J P N.Cyclic guanosine-3 ’5’-monophosphate and biopteridine biosynthesis in Nocardia sp.[J].J Bacteriol,2000,182(13):3644-3648.

