早秋萝卜不育系花药形态比较及细胞学观察
刘育华 ,李德超 ,骆海波 ,贺从安 ,张小康 ,熊秋芳 ,张贵生 ,李世升
(1.武汉市农业科学研究所,430345;2.武汉市蔬菜科学研究所)
萝卜作为重要的蔬菜作物对我国经济社会发展有着不可替代的作用。萝卜雄性不育系在萝卜种质优化及萝卜种子生产过程中贡献巨大[1,2]。萝卜的雄性不育有两大类型:细胞核雄性不育和核-质互作雄性不育。细胞核雄性不育只能获得不育株率为50%的雄性不育两用系,故其应用受到极大限制。武汉市蔬菜科学研究所十字花科研究室在以张雪清为首的老专家带领下,先后育成系列萝卜不育系20多套,并利用杂交手段,成功育成春夏红皮萝卜(春红一号)、春夏白皮萝卜(春白一号、春白二号、春雪)、夏秋白皮萝卜(夏抗40天)、夏秋红皮萝卜(双红一号、红宝)、早秋白皮萝卜 (中秋白、60早生)、秋冬萝卜(三白萝卜、武青一号、武杂一号、武杂三号萝卜)、冬春萝卜(四月白、春雪)、加工萝卜(武渍一号)等品种。自这些品种选育至今,已在我国大面积推广,种植面积超过2万hm2。随着对萝卜发育规律研究的不断加强和逐步深入[3~8],萝卜雄性不育在细胞发育形态、生理生化及分子调控水平方面 都 取 得 了 重 大 进 展[3,4,6],但 由 于 萝 卜 雄 性 不 育 遗传机制的复杂性及试验材料的差异性,研究结果不完全一致。为加强对原有品种的更新及开发力度,以早秋萝卜不育系12-A及其对应保持系为材料,从器官形态学及细胞形态学水平对小孢子败育的时期和原因进行分析,试图为揭示该品种萝卜的雄性不育机理提供思路和理论基础。
1 材料与方法
1.1 试验材料
试验材料为早秋萝卜不育系12-A及其保持系12-B,种植于武汉市蔬菜科学研究所武湖基地。按常规方法对上述萝卜品种进行栽培和管理。
1.2 试验方法
①花药组织切片 a.固定与脱水。将分选好的花药长度分别为1,2,3,4 mm的花蕾放入固定液(4%多聚甲醛,0.1%TritonX-100,1xPBS,pH 值7.4)中4℃固定过夜后,用 1xPBS(pH 值 7.4)清洗 3次,每次10 min。然后用体积分数分别为10%,30%,50%,75%,95%的乙醇依次脱水至100%乙醇,每级1 h。最后更换2次无水乙醇,各处理1 h。
b.浸蜡。将脱好水的材料放入Steedman'sWax与无水乙醇(1∶1)混合液中37℃处理过夜。次日早上,弃去上述混合液,换成纯的Steedman'sWax,37℃渗透1 h。更换新的蜡,并和材料一起转入锡箔纸盒中室温凝固1 h,随即放入4℃冰箱进一步凝固。
c.切片。由于Steedman'sWax熔点仅为37℃,而在23℃以上会变得很软,所以整个操作过程需要在23℃以下进行,否则不利于切片。根据材料的大小将包埋好的蜡块切成小块,并用熔化的蜡将其粘在木块上 (根据所要切片的方向摆放),放入冰箱的冷藏室中降温以保持蜡的硬度。用单面刀片将固定在木块上的小蜡块修成梯形。将木块固定在切片机上,调整方向至切面与切片刀的刀口平行,且要保证切面的下边缘与刀口也是平行的,然后进行厚度为10μm的连续切片。将切好的蜡带放在预先加有去离子水的玻片(玻片需预先以多聚赖氨酸包被好)上,待其充分伸展后吸干大部分水。贴片室温过夜即可。
d.脱蜡及封片观察。将贴好片的载玻片放入盛有无水乙醇的染色缸中脱蜡10 min,并重复该步骤一次。然后经过梯度乙醇处理,复水到去离子水中,并用Hoyer's Solution封片。
②花药形态及切片显微观察 利用SCX-12 Olympus体式荧光显微镜观察花药外形,Q-imaging CCD取图;利用Leica观察切片结果,Cooled-CCD取图。
③图像处理 图像经由平板扫描仪、照相机或者各种科研图像采集仪器配套程序获得,然后都在Photoshop CS2或Image J软件中进行调整,最后在CorelDraw X4软件中拼成图版。
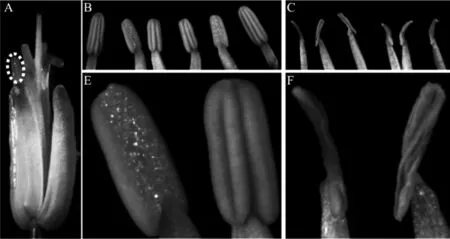
图1 萝卜母本不育系及保持系花药形态
2 结果与分析
2.1 不育系和保持系萝卜花药形态比较
花器官形态一直以来都是广大育种工作者在不育系选育过程中的重要标准,尤其是花药的发育形态,因为其好坏是不育系质量高低的关键因素。通过连续追踪观察12-A不育系及其保持系的早期花蕾及后期盛花形态,初步比较了二者的形态差异。
从外形上讲,不育系和保持系早期花蕾发育一致,形态正常;进一步对盛花(花瓣白色已显露即将开放,但还没张开)外形的观察发现,12-A不育系花药明显折皱、卷曲、褐化且花粉缺失(图1C、F)。由于花粉的缺失,12-A不育系的雄花最终是完全败育的。12-A不育系正常花药形态的丧失导致花粉不能正常形成,外部形态观察只能让我们了解到花药形态的发育情况,而且只是盛花时期花药外露后的形态,早期花形态比较也没有发现有关不育的端倪。因此,若要挖掘不育系形成过程的发育生物学机理,必须进一步在细胞学水平上深入观察。
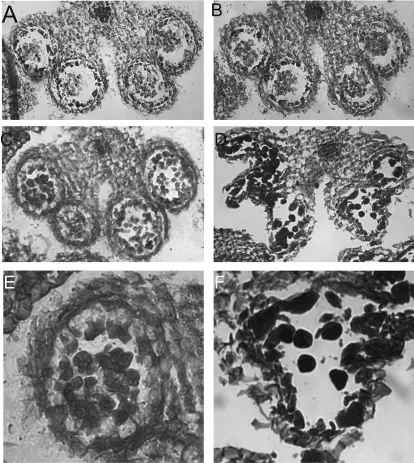
图2 不育系和保持系花药细胞结构
2.2 花粉发育过程中的比较观察
为了进一步研究萝卜12-A雄性不育系中花药败育及花粉缺失的原因,对早期花药进行了切片观察,希望通过对其内部细胞结构的了解,在细胞水平上寻找到花粉败育的原因。
以花药长度为参考标准,取长2,3mm的花药做切片观察。图2A,B显示的分别是12-A保持系及不育系的早期花药(花药长2 mm)切片结果,结果显示两者在花药早期发育过程中药室及花粉早期形态均正常;图2C,D显示的分别是12-A保持系及不育系的早期花药(花药长3 mm)切片结果,结果表明此时不育系中花药药室结构出现异常,通过放大图(图2E和F)可以知道,此时正处于四分体时期。对比结果表明,不育系花药败育是在花粉四分体时期左右药室壁结构崩解所致。
综合以上结果不难发现,12-A不育系及保持系的花粉都在正常发育中,只是由于不育系中花药药室壁结构在花粉四分体时期开始崩解导致最终花粉不成熟而完全败育。花药药室壁分内壁、中壁及外壁,到底是哪些结构崩解还不得而知。王建波通过电镜切片观察萝卜不育系花药发育情况,认为萝卜805不育系花粉出现败育是由于药室壁中层的绒毡层异常所致。因此12-A不育系花药败育原因是否因药室壁中层的绒毡层所致[3],还需要进一步研究才能确认,但目前可以肯定的是在花粉四分体时期便开始出现败育,表明12-A不育系中败育花粉在四分体时期开始停止发育,导致最终花粉完全败育。
3 结论
有研究者发现萝卜不育系中异常花药的出现与不育花蕾中淀粉酶活性及总糖、可溶性糖、生长素、淀粉、可溶性蛋白和游离脯氨酸的含量降低有关[1]。法国学者发现萝卜Ogura雄性不育由位于细胞质线粒体中的orf138和 orfB(atp8)控制,并对相关基因进行了功能研究,进一步发现细胞核内存在着 3个基因 PPR-A,PPR-B和PPR-C可以抑制ORF138在线粒体内的聚集从而完成育性恢复[4]。综合试验结果表明,萝卜不育系12-A中花粉在四分体时期开始出现异常,此异常情况是由不育系中花药药室壁结构崩解造成。
[1]韩晓雨.萝卜雄性不育系及其保持系的生理生化分析和SSR标记研究[D].泰安:山东农业大学,2012.
[2]Ogura H.Studies on the new male sterility in Japanese radish,with special reference to the utilization of this sterility towards the practical raising of hybrid seeds[J].Mem Fac Agric Kagoshima Univ,1968,6:39-78
[3]Shi S L,Ding D,Mei SY,et al.A comparative light and electron microscopic analysis of microspore and tapetum development in fertile and cytoplasmic male sterile radish[J].Protoplasma,2010,241:37-49.
[4]Uyttewaal M,Arnal N,Quadrado M,et al.Characterization of Raphanus sativus pentatricopeptide repeat proteins encoded by the fertility restorer locus for ogura cytoplasmic male sterility[J].The Plant Cell,2008,20:3 331-3 345.
[5]Diggle PK,Abrahamson N J,Baker R L,etal.Dynamics of maternal and paternal effects on embryo and seed development in wild radish(Raphanus sativus)[J].Annals of Botany,2010,106:309-319.
[6]Ian S Curtis.Genetic engineering of radish:current achievements and future goals[J].Plant Cell Rep,2011,30:733-744.
[7]Wang S F,Wang X F,He Q W,et al.Transcriptome analysis of the roots at early and late seedling stages using Illumina paired-end sequencing and development of ESTSSRmarkers in radish[J].Plant Cell Rep,2012,31:1 437-1 447.
[8]Shirasawa K,Oyama M,Hirakawa H,et al.An EST-SSR linkagemap of Raphanus sativus and comparative genomics of the Brassicaceae[J].DNA research,2011,18(4):221-232.

