环磷酰胺节拍化疗联合重组人血管内皮抑制素对非小细胞肺癌移植瘤裸鼠的影响及其机制研究
汪 蕊, 秦叔逵, 陈余清, 吴 穷, 杨 燕, 李玉梅, 汪子书, 郑荣生
(蚌埠医学院第一附属医院1肿瘤内科,3呼吸科,安徽 蚌埠233004;2南京八一医院全军肿瘤中心肿瘤内科,江苏 南京210002)
肺癌在癌症相关死亡中位居首位[1],其中,非小细胞肺癌(non-small-cell lung cancer,NSCLC)约占80%。对于非选择性的晚期NSCLC 患者而言,含铂的两药方案化疗是标准的一线治疗[2]。然而,系统化疗的疗效已经达到平台期,长程化疗并未带来总生存期(overall survival,OS)的额外获益[3]。目前,对于晚期NSCLC 初始治疗有效的病人,临床上推荐进行维持治疗,有效的维持治疗延长了病人的无进展生存期(progress-free survival,PFS)和OS,并能控制症状和改善生活质量[4]。例如,在4 ~6 周期化疗后,对治疗有效的病人转换成培美曲塞或厄洛替尼维持治疗有确定的PFS 和OS 获益[5-6]。但是,不同的维持治疗在疗效上却不尽相同[7-8]。因此,有必要探索更多安全有效的维持治疗方法。本研究在肺腺癌裸鼠皮下移植瘤模型上,考察了最大耐受剂量(maximum tolerated dose,MTD)的环磷酰胺(cyclophosphamide,CPA)化疗后,转换成CPA 节拍化疗(metronomic chemotherapy,MET)、重组人血管内皮抑制素治疗(recombinant human endostatin,Endostar/Endo)以及2 种方法联合使用作为维持治疗的疗效和抗血管形成机制,探索一种新的晚期NSCLC 维持治疗模式。
材 料 和 方 法
1 动物和药物
SPF 级BALB/c 裸鼠,雌性,4 周龄,16 ~18 g,购于上海斯莱克实验动物有限责任公司,生产许可证为SCXK(沪)2007-005。人肺腺癌细胞系A549 购自中国科学院上海生命科学研究院细胞库。Endostar购自江苏先声药业有限公司,CPA 购自International Laboratory。
2 主要试剂
DMEM 液体培养基和胎牛血清购自Gibco;7-氨基放线菌素D(7-aminoactinomycin D,7-AAD)细胞活性染色液、荧光抗体APC anti-mouse CD45、PE antimouse CD146、APC-rat-IgG2b、PE-rat-IgG2a、goat antimouse CD31 和DAPI 购自BioLegend;Rabbit antimouse NG2、chicken anti-goat IgG-TRITC 和donkey anti-rabbit IgG-FITC 购自Abcam。
3 动物研究方案
A549 细胞置于含10%胎牛血清的DMEM 培养基中,在37 ℃、5%CO2、饱和湿度培养箱中培养。细胞处于对数生长期时,用0.25%胰酶消化细胞制成细胞悬液,浓度为1 ×1010/L。在裸鼠的右侧背部皮下接种0.25 mL(2.5 ×106)细胞悬液。移植瘤体积长至150 ~250 mm3时,腹腔注射给药MTD CPA(CPA 100 mg/kg,第1、3、5 d 分别腹腔注射给药1次,21 d 为1 周期)。药物干预4 个周期后随机分为4 组,转换成以下治疗:生理盐水(生理盐水0.2mL,每天腹腔注射给药,control 组)、MET CPA 维持治疗(CPA 10 mg/kg,每天灌胃给药,MET CPA 组)、Endo维持治疗(Endostar 4 mg/kg,每天腹腔注射给药,Endo 组)和MET CPA+Endo 维持治疗(药物剂量和给药途径同MET CPA 和Endo 组,MET CPA + Endo组)。每3 d 测量移植瘤最长径(length,L)和最短径(width,W),计算移植瘤体积(volume,V;V =0.52 ×L×W2)。记录动物的生存期。本研究方案经蚌埠医学院第一附属医院伦理委员会批准。
4 外周血循环内皮细胞(circulating endothelial cells,CECs)和存活CECs(viable CECs)的测定
在维持治疗第6 周时,每组随机选取8 只荷瘤鼠,分别获取外周血50 μL,肝素钠抗凝,混匀,加入2 mL 溶血素,室温避光孵育20 min。加入1 μL CD45-APC(1∶10)、1 μL CD146-PE(1∶10)和10 μL 7-AAD(1∶10)至流式管中,对照管加入1 μL IgG2b-APC(1∶10)和1 μL IgG2a-PE(1∶10),混匀,室温避光孵育20 min,1 500 r/min 离心5 min,倒去上清,加入2 mL 缓冲液洗涤,1 500 r/min 离心5 min,加入100 μL 缓冲液。BD 公司FACScalibur 型流式细胞术测定外周血CECs 和存活CECs。
5 免疫荧光染色
处死取血后的荷瘤鼠(每组8 只),剥离瘤体。在含10%中性甲醛溶液4 ℃固定1 h,浸泡于4 ℃30%蔗糖PBS 液中直至沉底。用OCT 包埋剂进行包埋后冰冻,制成4 μm 切片。从每例标本的20 张切片中选取5 张不连续切片进行免疫荧光染色。步骤如下:含10%血清PBS 室温封闭切片1 h,加入goat anti-mouse CD31(1 ∶50)、rabbit anti-mouse NG2(1∶50)单克隆抗体及同型对照4 ℃孵育过夜。PBS洗涤(3 ×10 min),加入荧光素标记的chicken antigoat IgG-TRITC(1 ∶100)和donkey anti-rabbit IgGFITC(1∶100)Ⅱ抗37 ℃孵育1 h。PBS 洗涤(3 ×10 min),加入含DAPI(10 mg/L)的抗荧光淬灭封片液,盖玻片封片[9]。激光共聚焦显微镜(×100 倍)观察切片血管密集区域,并在高倍(×400 倍)镜下计数微血管数(CD31 标记的血管结构);管周细胞覆盖率为管周细胞(NG2 标记)覆盖血管内皮(CD31 标记)周径(横切面)或长度(纵切面)的百分比。每张切片随机选取5 个视野计算微血管密度(microvessel density,MVD)及管周细胞覆盖率。
6 统计学处理
用SPSS 13.0 软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用Student-Newman-Keuls 检验,生存分析使用log-rank 检验。以P <0.05 为差异有统计学意义。
结 果
1 移植瘤生长情况
裸鼠接种7 ~10 d 后形成瘤结节,成瘤率为100%。在维持治疗第6 周时,MET CPA 和Endo 组肿瘤体积显著小于control 组(P <0.05),MET CPA+Endo组肿瘤体积又显著小于单药维持治疗组(P <0.05),见图1。
2 CECs 和存活CECs 测定结果
应用CellQuest 软件获取10 000 个细胞进行分析,计算CD45-CD146+细胞和CD45-CD146+7-AAD-细胞占R1 门内细胞的百分比,见图2。结果显示MET CPA 组和Endo 组外周血CECs 显著低于control 组(P <0. 01)。在存活CECs指标上,MET CPA 组和Endo 组也显著低于control 组(P <0.01)。MET CPA+Endo 组在外周血CECs 和存活CECs 上又显著低于单药维持治疗组(P <0.05)。
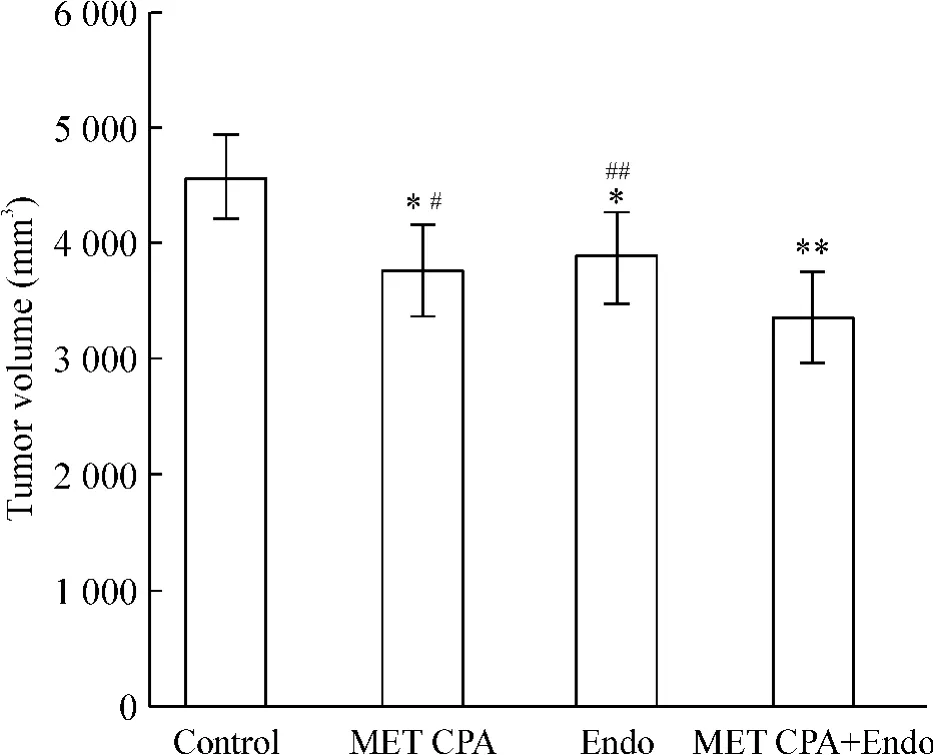
Figure 1. The tumor volume in BALB/c nude mice at the 6th week of maintenance treatment. Mean±SD. n=22 in control group;n =23 in MET CPA,Endo and MET CPA+Endo groups. * P <0.05,**P <0.01 vs control;#P <0.05,##P <0.01 vs MET CPA+Endo.图1 维持治疗第6 周时荷瘤鼠移植瘤的体积
3 肿瘤MVD 测定结果
移植瘤的微血管荧光染色见图3。结果表明MET CPA 组(18. 34 ± 2. 37)和Endo 组(20. 08 ±1.99)肿瘤组织MVD 较control 组(28.83 ±2.05)显著减少(P <0.01);MET CPA + Endo 组(10.71 ±2.39)与单药维持组比较则进一步减少(P <0.05)。
4 管周细胞覆盖率
移植瘤血管的管周细胞覆盖见图4。在管周细胞覆盖率上,Endo 组(60.39% ±11.44%)显著低于control 组(68.23% ±11.05%;P <0.05),MET CPA+Endo 组(42.05% ±13.63%)较Endo 组又被进一步下调(P <0.05)。MET CPA 组(65.64% ±11.81%)较control 组有下降的趋势,但差异无统计学意义(P >0.05)。在荷瘤鼠正常肝脏组织中,血管管周细胞覆盖率在各治疗组间无显著差异(图略)。
5 荷瘤鼠生存期
在截尾分析时,模型鼠生存曲线见图5。在中位OS 上,MET CPA 组(107.00 d ±14.17 d)和Endo组(109.00 d ± 10.63 d)较control 组(72.00 d ±12.88 d)显著延长(P <0.05)。MET CPA +Endo 组OS(154.00 d±8.37 d)较Endo 和MET CPA 组进一步延长(P <0.05)。
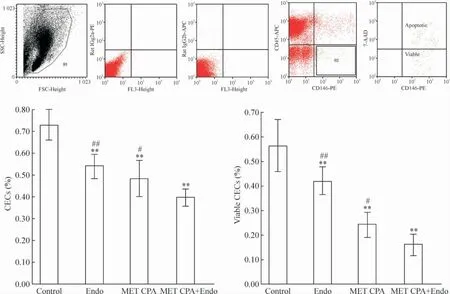
Figure 2. The peripheral blood CECs and viable CECs detected by flowcytometry. Mean ±SD. n =8. **P <0.01 vs control;#P <0.05,##P <0.01 vs MET CPA+Endo.图2 流式细胞术分析外周血CECs 和存活CECs
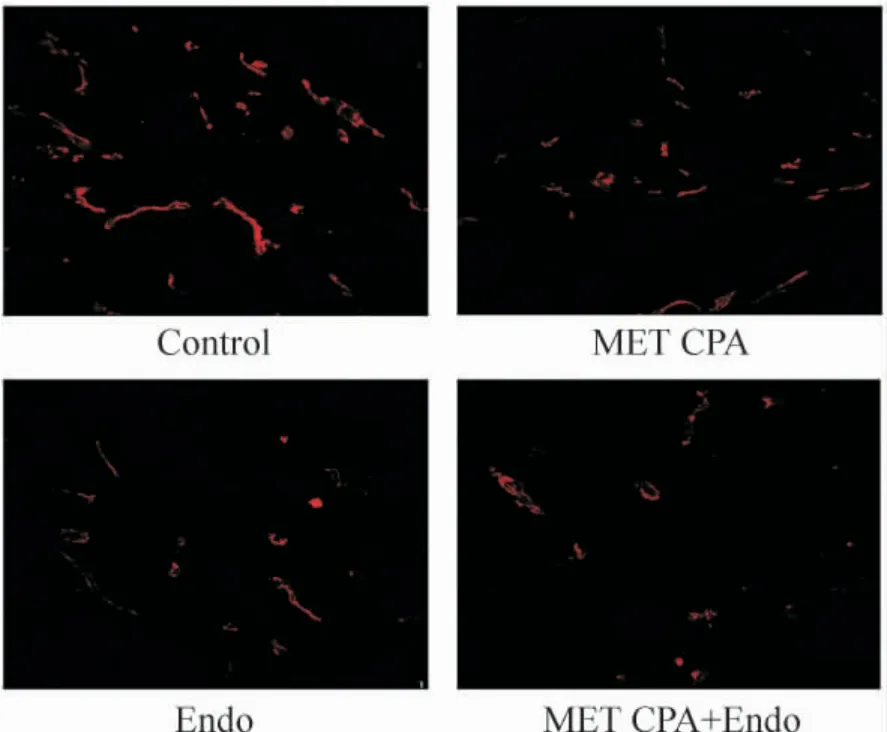
Figure 3. Tumor microvessel density in the four groups observed by confocal microscopy (× 400). The microvessel density in xenograft tumors was determined by immunofluorescence marked by CD31.图3 共聚焦显微镜观察移植瘤微血管密度
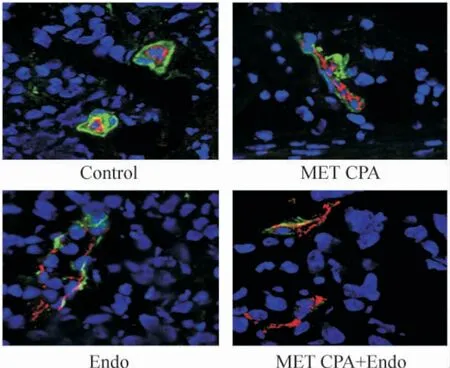
Figure 4. Confocal microscopic images showing the pericyte coverage in xenograft tumors in the four groups (×400).Fluorescence images of tumors showed CD31-positive endothelial cells (red), NG2-positive pericytes(green),and DAPI-positive nuclei (blue).图4 共聚焦显微镜分析移植瘤管周细胞覆盖率
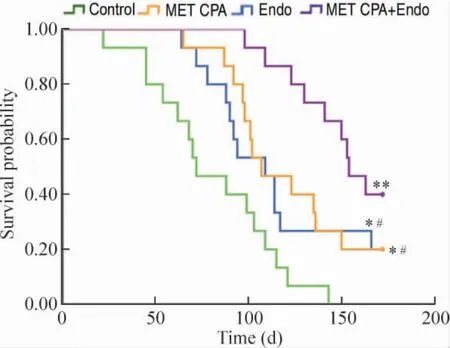
Figure 5. Survival curves of mice bearing xenograft tumors in the four groups. n =14 in control group;n =15 in MET CPA,Endo and MET CPA + Endo groups. * P <0.05,**P <0.01 vs control;#P <0.05 vs MET CPA+Endo.图5 荷瘤鼠生存曲线
讨 论
对于一线化疗有效的晚期NSCLC,维持治疗可以获得生存期利益,但并非所有的维持治疗均有临床获益,因此,有必要探索新的维持治疗方法[10-11]。我们曾在肺腺癌细胞A549 移植瘤的动物模型上,发现CPA 节拍化疗联合血管形成抑制剂Endostar 能产生增强的抗肿瘤作用,并改善了模型动物的生存期,这种疗效可能与两药联合使用具有抗血管形成的增效作用有关[12]。本研究在相同模型上,考察了大剂量CPA 化疗4 个周期后,CPA 节拍化疗联合Endostar 作为维持治疗的疗效和抗血管形成机制。结果表明在维持治疗第6 周时,CPA 节拍化疗和Endostar 单药抑制肿瘤生长优于生理盐水对照组,而两药联合使用则产生了增强抗肿瘤和改善生存期的作用。可见,CPA 节拍化疗联合Endostar 有成为晚期NSCLC 维持治疗的潜在价值,这种增效作用可能与联合用药能产生抗血管形成增效作用有关,表现为联合用药较单药维持治疗进一步下调了外周血CECs、MVD 和管周细胞覆盖率。
新生血管形成在肿瘤生长和扩散中扮演着关键角色,其过程涉及到肿瘤细胞、血管内皮细胞、基质细胞和管周细胞之间的交互作用[13]。研究表明富血管肿瘤中MVD 和管周细胞覆盖明显增多,并且与预后不良相关[14]。Endostar 通过抑制VEGF 信号通路发挥抗肿瘤血管形成作用[15-16]。例如,Endostar 在血管内皮细胞中能阻断VEGF 诱导的VEGFR2 表达和磷酸化,并抑制VEGFR 信号通路下游的多个蛋白激酶的活性[17]。VEGF 抑制剂也能阻断G 蛋白信号转导调节因子5 (regulator of G-protein signaling 5,RGS5)表达而下调新生血管的管周细胞覆盖[18]。节拍化疗有确定的抗血管形成作用。例如,CPA 节拍化疗显著增加血管内皮细胞中血小板反应蛋白1(thrombospondin 1,TSP1)的表达,后者是内源性的血管形成抑制剂[19]。CPA 节拍化疗也能下调外周血中VEGF 和血小板源性生长因子(platelet-derived growth factor,PDGF)等促血管形成因子的水平,后者在介导管周细胞稳态中发挥重要作用[20-22]。因此,联合使用CPA 节拍化疗和Endostar 有可能在多个环节上产生增强的抗肿瘤血管形成作用,这与其它血管形成抑制剂联合节拍化疗的研究结果是一致的。在本研究中,使用CPA 节拍化疗与Endostar 进行维持治疗降低了肿瘤的MVD,而Endostar 又显著降低了管周细胞覆盖,两药联合则进一步降低了MVD 和管周细胞覆盖率,这些作用有可能转化成对肿瘤生长的抑制作用和生存期获益。同时,我们也测定了模型动物肝脏组织血管的管周细胞覆盖情况,在不同治疗组间并未发现显著差异,说明CPA 节拍化疗和Endostar 只影响肿瘤组织中新生血管的形成。
在抗肿瘤血管形成治疗时,CECs 被认为是疗效替代指标[22-23]。目前,至少有2 种CECs 能被鉴定,即骨髓起源的前体CECs 和成熟的CECs。外周血CECs 水平和活性能反映肿瘤的进展,常作为血管形成的标志物[21]。有研究显示在大剂量的化疗时,外周血CECs 出现短暂的下降,然而在化疗间期又迅速反弹。一些节拍化疗方案能使外周血CECs 和内皮前体细胞持续处于较低的水平,有可能产生持续抗肿瘤新生血管形成的作用[24]。我们的研究发现,在维持治疗第6 周时,CPA 节拍化疗组的CECs 和存活CECs 水平较生理盐水对照组明显降低,而联合使用Endostar 时则产生了更强的下调作用。不同维持治疗组间其外周血CECs 和存活CECs 的水平又与肿瘤体积和MVD 相关,可见,CECs 有作为CPA 节拍化疗联合Endostar 疗效预测指标的潜在价值。
综上所述,CPA 节拍化疗联合血管内皮抑制素Endostar 用于NSCLC 维持治疗能延缓移植瘤生长,改善荷瘤鼠生存期,这可能与联合用药具有抗血管形成的增效作用有关。本研究为晚期NSCLC 维持治疗提供了新的治疗思路。
[1] Jemal A,Bray F,Center MM,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[2] Azzoli CG,Temin S,Aliff T,et al. 2011 Focused Update of 2009 American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage IV Non-Small-Cell Lung Cancer[J]. J Clin Oncol,2011,29(28):3825-3831.
[3] Goffin J,Lacchetti C,Ellis PM,et al. First-line systemic chemotherapy in the treatment of advanced non-small-cell lung cancer:a systematic review[J]. J Thorac Oncol,2010,5(2):260-274.
[4] Soon YY,Stockler MR,Askie LM,et al. Duration of chemotherapy for advanced non-small cell lung cancer:a systematic review and meta-analysis of randomized trials[J]. J Clin Oncol,2009,27(20):3277-3283.
[5] Ciuleanu T,Brodowicz T,Zielinski C,et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer:a randomised,double-blind,phase 3 study[J]. Lancet,2009,374(9699):1432-1440.
[6] Cappuzzo F,Ciuleanu T,Stelmakh L,et al. Erlotinib as maintenance treatment in advanced non-small-cell lung cancer:a multicentre, randomised,placebo-controlled phase 3 study[J]. Lancet Oncol,2010,11(6):521-529.
[7] Miller VA,O'Connor P,Soh C,et al. A randomized,double-blind,placebo-controlled,phase IIIb trial (ATLAS)comparing bevacizumab (B)therapy with or without erlotinib (E)after completion of chemotherapy with B for first-line treatment of locally advanced,recurrent,or metastatic non-small cell lung cancer (NSCLC)[J]. J Clin Oncol,2009,27(18S):LBA8002.
[8] Belani CP,Waterhouse DM,Ghazal H,et al. Phase III study of maintenance gemcitabine (G)and best supportive care (BSC)versus BSC,following standard combination therapy with gemcitabine-carboplatin (G-Cb)for patients with advanced non-small cell lung cancer (NSCLC)[J]. J Clin Oncol,2010,28(15 Suppl):7506.
[9] 南庆玲,阳 诚,徐 勇. 高糖作用的肾小球系膜细胞SonN/Ski 蛋白表达及泛素化降解[J]. 中国病理生理杂志,2012,28(3):506-511.
[10]Belani CP,Brodowicz T,Ciuleanu T,et al. Maintenance pemetrexed (Pem)plus best supportive care (BSC)versus placebo (Plac)plus BSC:a randomized phase Ⅲstudy in advancednon-small cell lung cancer (NSCLC)[J]. J Clin Oncol,2009,27(18S):CRA8000.
[11]Cappuzzo F,Ciuleanu T,Stelmakh L,et al. SATURN:A double-blind,randomized,phase Ⅲstudy of maintenance erlotinib versus placebo following nonprogression with firstline platinum-based chemotherapy in patients with advanced NSCLC[J]. J Clin Oncol,2009,27 (15S):8001.
[12]Wang R,Qin S,Chen Y,et al. Enhanced anti-tumor and anti-angiogenic effects of metronomic cyclophosphamide combined with Endostar in a xenograft model of human lung cancer[J]. Oncol Rep,2012,28(2):439-445.
[13]Folkman J. Angiogenesis:an organizing principle for drug discovery?[J]. Nat Rev Drug Discov,2007,6(4):273-286.
[14]Miyata Y,Kanda S,Ohba K,et al. Lymphangiogenesis and angiogenesis in bladder cancer:prognostic implications and regulation by vascular endothelial growth factors-A,-C,and -D[J]. Clin Cancer Res,2006,12(3 Pt 1):800-806.
[15]岳 滔,朱振宇. 血管内皮抑制素的研究进展[J]. 中国病理生理杂志,2002,18(7):865-868.
[16]Ling Y,Yang Y,Lu N,et al. Endostar,a novel recombinant human endostatin,exerts antiangiogenic effect via blocking VEGF-induced tyrosine phosphorylation of KDR/Flk-1 of endothelial cells[J]. Biochem Biophys Res Commun,2007,361(1):79-84.
[17] Kim YM,Jang JW,Lee OH,et al. Endostatin blocks vascular endothelial growth factor-mediated signaling via direct interaction with KDR/Flk-1[J]. Biol Chem,2002,277(31):27872-27879.
[18] Mitchell TS,Bradley J,Robinson GS,et al. RGS5 expression is a quantitative measure of pericyte coverage of blood vessels[J]. Angiogenesis,2008,11(2):141-151.
[19]Tas F,Duranyildiz D,Soydinc HO,et al. Effect of maximum-tolerated doses and low-dose metronomic chemotherapy on serum vascular endothelial growth factor and thrombospondin-1 levels in patients with advanced non-small cell lung cancer[J]. Cancer Chemother Pharmacol,2008,61(5):721-725.
[20]Caballero M,Grau JJ,Blanch JL,et al. Serum vascular endothelial growth factor as a predictive factor in metronomic (weekly)Paclitaxel treatment for advanced head and neck cancer[J]. Arch Otolaryngol Head Neck Surg,2007,133(11):1143-1148.
[21] Loven D,Bepery E,Yerushalmi R,et al. Daily lowdose/continuous capecitabine combined with neoadjuvant irradiation reduces VEGF and PDGF-BB levels in rectal carcinoma patients[J]. Acta Oncol,2008,47(1):104-109.
[22]Furuhashi M,Sjoblom T,Abramsson A,et al. Plateletderived growth factor production by B16 melanoma cells leads to increased pericyte abundance in tumors and an associated increase in tumor growth rate[J]. Cancer Res,2004,64(8):2725-2733.
[23]Pietras K,Hanahan D. A multitargeted,metronomic,and maximum-tolerated dose "chemo-switch" regimen is antiangiogenic,producing objective responses and survival benefit in a mouse model of cancer[J]. J Clin Oncol,2005,23(5):939-952.
[24]Bertolini F,Paul S,Mancuso P,et al. Maximum tolerable dose and low-dose metronomic chemotherapy have opposite effects on the mobilization and viability of circulating endothelial progenitor cells[J]. Cancer Res,2003,63(15):4342-4346.

