β-连环蛋白在胃癌组织中的表达
,,,,
(青岛大学医学院附属医院病理科,山东 青岛 266003)
β-连环蛋白(β-catenin)在细胞中起两个作用:一是作为细胞黏附或肌动蛋白细胞骨架网络的结构组分;二是游离的β-catenin作为信号转导分子在基因转录中起作用。这两种作用均与肿瘤的演进异质化过程有关。目前,对胃癌β-catenin的研究多侧重于蛋白表达水平,而其结构改变对于胃癌演进异质化的影响报道较少[1]。本研究采用聚合酶链反应(PCR)-单链构象多态性(SSCP)方法及DNA序列分析法,分析胃癌β-catenin的exon3基因突变及其蛋白表达情况,从基因水平和蛋白水平探讨胃癌β-catenin功能异常的调控机制。现将结果报告如下。
1 资料与方法
1.1 标本及其来源
收集我科2011年9—11月间的新鲜胃癌手术切除标本35例,癌周正常黏膜(距肿瘤边缘≥5 cm)组织10例。根据日本胃癌研究会1995年的分型方案,中分化腺癌6例,低分化腺癌22例,黏液腺癌5例,印戒细胞癌2例。按Lauren分型方法,肠型6例,混合型4例,弥漫型25例。
1.2 PCR-SSCP方法
1.2.1DNA提取 取液氮保存的新鲜手术标本约1 g,加入4 μL的蛋白酶K(终浓度为0.1 g/L)和DNA提取缓冲液500 μL,55 ℃温浴3 h,酚-氯仿-异戊醇抽提,冰无水乙醇沉淀,体积分数0.75冰乙醇洗涤,重溶于双蒸水中,置4 ℃冰箱中保存备用。
1.2.2引物设计及合成 β-catenin外显子3引物序列参考文献[2]设计,序列如下:F 5′-CCAATCTACTAATGCTAATACTG-3′(310 bp),R 5′-CTGCATTCTGACTTTCAGTAAGG-3′。
1.2.3PCR扩增 PCR反应总体积为25 μL,其中含有基因组DNA 500 ng,4×dNTPs 0.25 mmol/L,Mg2+1.5 mol/L,引物各1 μmol/L,TaqDNA聚合酶1 U和10×buffer 2.5 μL。于PCR循环仪中94 ℃变性75 s,58 ℃(exon3)退火60 s,72 ℃延伸60 s,循环30次,最后72 ℃延伸5 min。
1.2.4电泳、银染 取PCR产物2~3 μL加等体积变性缓冲液混匀,沸水中变性10 min,冰上骤冷5 min。快速上样,行80 g/L非变性聚丙烯酰胺凝胶电泳(丙烯酰胺∶甲双叉丙烯酰胺=29∶1)。电泳条件:缓冲液1×TBE,环境温度4 ℃,恒压150 V,时间120~180 min。取下凝胶,于固定液(体积分数0.10乙醇+体积分数0.005冰醋酸)中固定5~10 min,双蒸水漂洗两次;凝胶浸泡于染色液(2 g/L硝酸银)中5~10 min,双蒸水漂洗两次;将凝胶浸泡于显色液(10 g/L氧化钠+2 g/L甲醛)中显色,至出现棕褐色DNA区带为止。最后用双蒸水漂洗,观察结果。
1.2.5DNA测序 将经SSCP筛选β-catenin编码基因突变阳性的PCR产物100 μL,送至上海生工测序部测序。
1.3 β-catenin蛋白表达检测
采用免疫组织化学方法。将石蜡标本切成5~7 μm厚切片,采用PV-9000两步法染色,DAB显色,以PBS代替一抗作为阴性对照。兔抗人β-catenin单克隆抗体及PV-9000试剂盒均购于北京中山试剂公司,严格按试剂盒说明操作。正常组织β-catenin蛋白阳性表达的细胞膜呈棕黄色染色,免疫阳性染色位于细胞质或细胞核为表达异常或阴性[2]。
2 结 果
2.1 β-catenin的exon3 PCR产物
PCR扩增产物经15 g/L琼脂糖凝胶电泳证实,每一标本都扩增出β-catenin的exon3(图1)。
2.2 β-catenin的exon3的SSCP银染条带
PCR扩增的双链DNA片段经过变性处理后,β-catenin的exon3可以出现2~4条单链带(exon3 310 bp)(图2)。本文35例胃癌组织中,仅有1例分化不良型胃癌组织β-catenin的exon3出现了异常条带(图3)。
2.3 β-catenin exon3突变
检测到β-catenin的exon3突变1例,突变类型为插入突变。突变标本在编码16位点处插入C碱基(图4)。
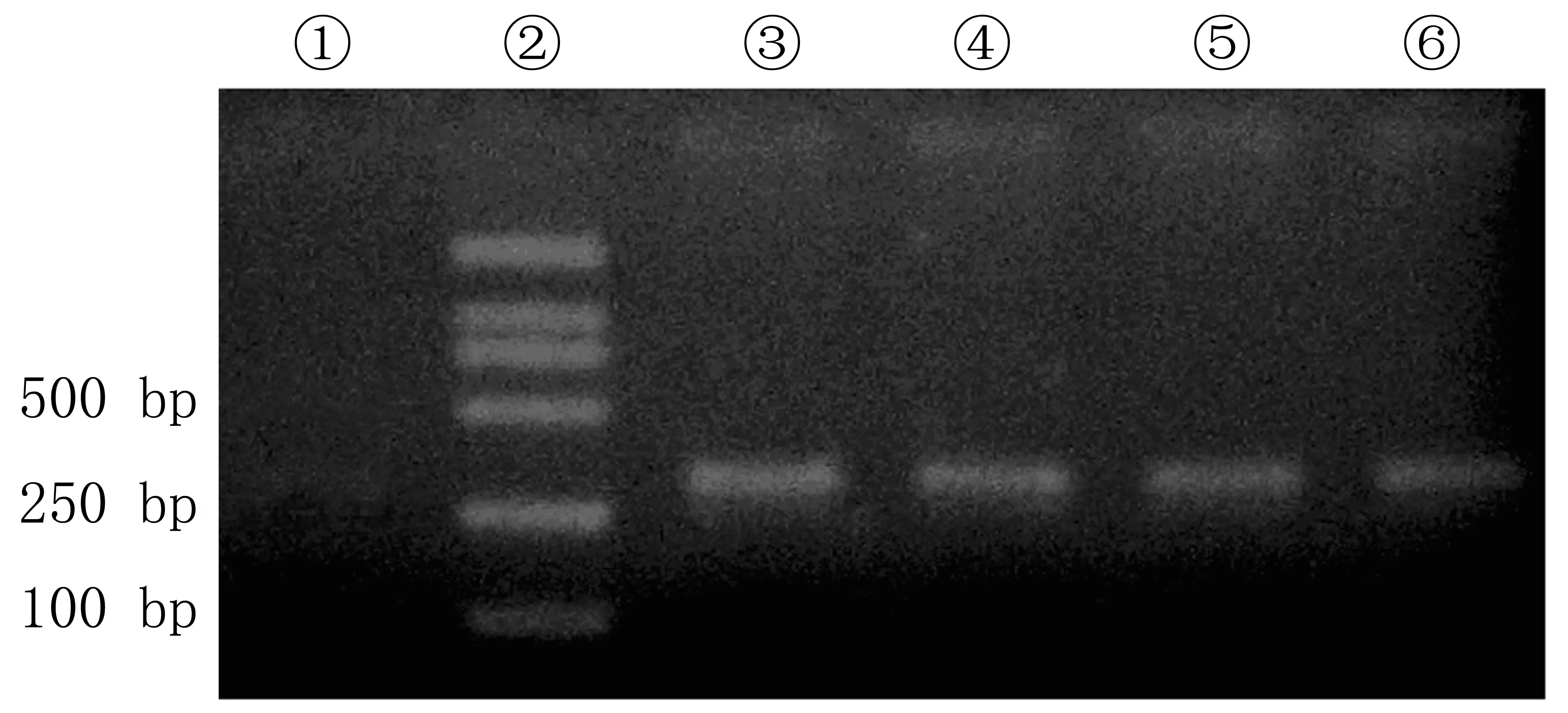
①阴性对照;②DL2000 Marker;③、⑤胃癌组织的exon3产物;④、⑥癌旁组织的exon3产物。
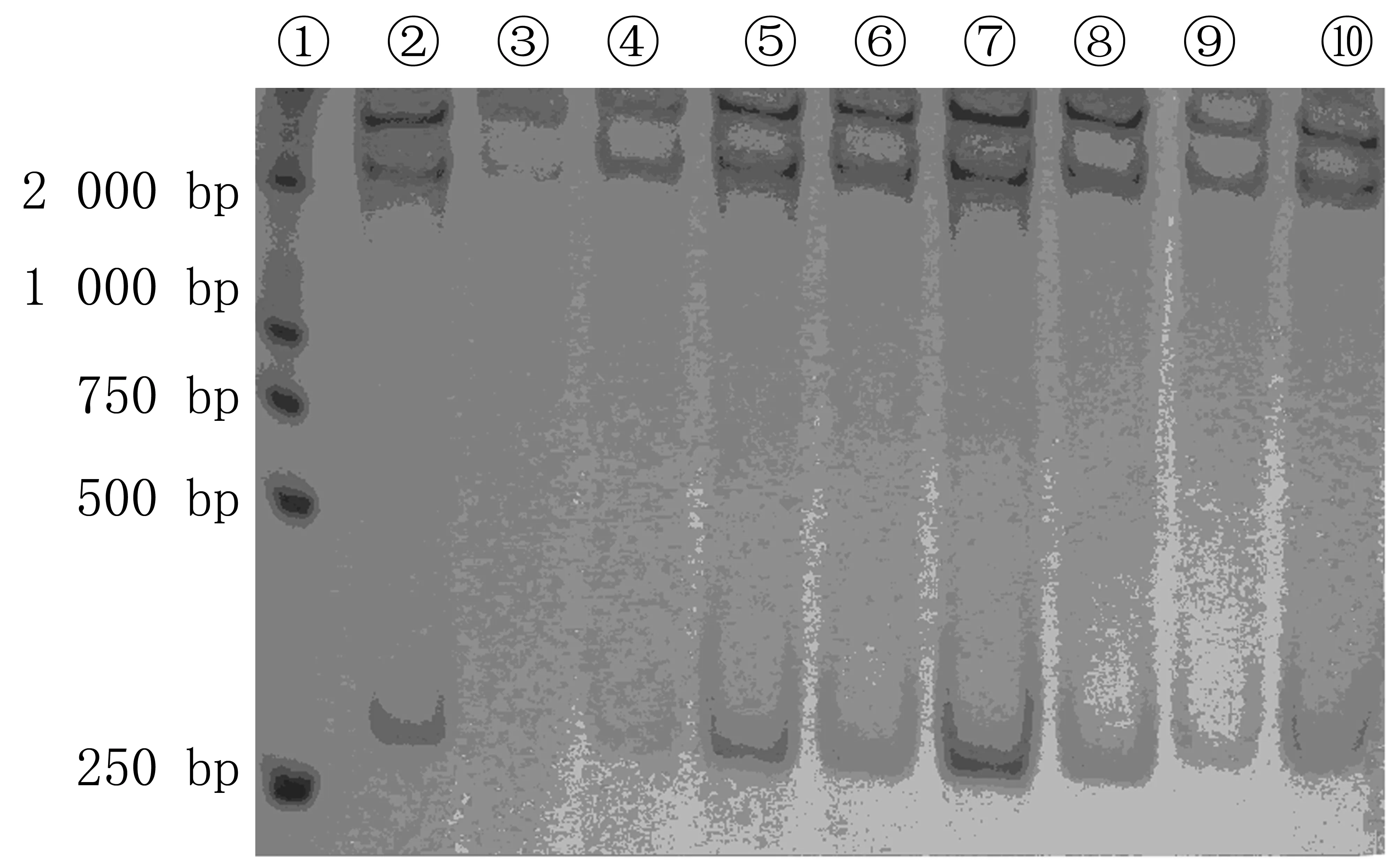
①为未变性的DL2000 Marker;②~④为癌旁组织;⑤~⑩为胃癌组织。

①、③~⑨为胃癌组织;②为癌旁组织;⑩为未变性的DL2000 Marker。箭头所示为β-catenin的exon3的SSCP银染异常条带。

图4 β-catenin exon3突变标本在编码16位点处插入C碱基
2.4 β-catenin蛋白表达情况
癌周胃组织β-catenin连续性表达于细胞膜上。胃癌组织中β-catenin在细胞膜表达明显减弱甚至消失,其中7例(20%)胃癌组织β-catenin在胞浆和胞核内异常蓄积表达,尤其是印戒细胞癌、低分化胃癌和弥散性浸润的癌细胞β-catenin异常表达率高。
3 讨 论
β-catenin通过与E-cadherin胞内肽段结合再与α-catenin结合,介导细胞黏附,同时参与Wnt途径的信号传导, β-catenin在细胞内的水平直接反映了Wnt通路的激活水平[4-5]。目前已有研究结果显示,多种肿瘤β-catenin基因突变、缺失和蛋白表达转变或转位;而β-catenin转位又是细胞向恶性转变的原因之一,尤其是向细胞核转移后,该蛋白可通过与转录因子Tcf/Lef结合,并调节靶基因如C-myc、MMP7、ID2、CIM4、EphB2和FGF20等的转录活性,启动靶基因的转录,促进细胞的增殖和活化[6-7]。
本文免疫组化检测结果显示,胃癌组织细胞中β-catenin异常表达。这种异常表达主要表现在胞浆的蓄积以及出现核定位,同时细胞膜上表达减少。这种异常表达存在多种机制,现在已知的机制主要有β-catenin磷酸化,对其降解的体系如APC、GSK-3β异常,以及β-catenin基因突变。研究β-catenin在细胞胞浆、胞核内的异常蓄积机制将有利于进一步认识恶性肿瘤侵袭、扩散、转移的机制。
已有研究显示,大多数β-catenin突变邻近或位于磷酸化位点上,而第3外显子含有编码丝氨酸和苏氨酸位点的序列,导致β-catenin磷酸化位点或其附近的氨基酸序列改变。本文对exon3基因突变检测结果显示,35例胃癌组织中1例发生β-catenin的exon3基因突变,免疫组化染色显示该标本细胞膜β-catenin蛋白表达减少的同时,伴有胞浆、胞核的蓄积,说明该病人既存在β-catenin基因的异常,也可能存在胞浆中游离β-catenin的降解体系异常。β-catenin的exon3基因突变率极低,提示β-catenin基因突变是胃癌中β-catenin异常蓄积的机制之一,但可能不是主要机制。β-catenin基因可能不是胃癌发生过程中主要的突变基因。
本文7例(20%)胃癌组织出现β-catenin蛋白胞浆、胞核的异位表达,仅检测到1例基因突变,提示其他原癌基因激活的机制在胃癌发生发展过程中起着重要的作用。本研究某些病例β-catenin蛋白在细胞膜中度表达的同时,也出现胞浆的蓄积表达,推测肿瘤细胞胞浆中游离β-catenin的降解体系发生了异常。
综上所述,β-catenin是一个与胃癌发生及发展较为相关的生物学指标,是反映肿瘤恶性程度和病期早晚的可靠指标,具有临床应用的价值和潜力。β-catenin表达状态可能改变癌细胞的侵袭能力,为研究癌细胞侵袭、转移提供新的思路;β-catenin表达水平异常有多种机制,提示临床可从多角度、多层次了解肿瘤的演进和异质化。基因突变可能不是胃癌组织中β-catenin异常蓄积的主要机制。肿瘤发生过程中β-catenin异常改变的机制及其在肿瘤发生过程中的作用需进一步研究。
[1] BECKER K F, ATKINSON M J, REICH U, et al. E-cadhe-rin gene mutations provide clues to diffuse type gastric carcinomas[J]. Cancer Research, 1994,54(14):3845-3852.
[2] YUTAKA K, YAE K, MICHIIE S, et al. β-Catenin accumulation and mutation of exon 3 of the β-catenin gene in hepatocellular carcinoma[J]. The Journal of Cancer Research, 1999,90:1301-1309.
[3] 厉建强,王文宏,李玉军,等. β-cat和cyclin D1表达与胰腺癌临床病理学的关系[J]. 齐鲁医学杂志, 2002,17(3):192-194.
[4] JI J F, YAMASHITA T, WANG X W. Wnt/beta-catenin signaling activates microRNA-181 expression in hepatocellular carcinoma[J]. Cell & Bioscience, 2011,1(1):4-9.
[5] GOKHALE A, KUNDER R, GOEL A, et al. Distinctive microRNA signature of medulloblastomas associated with the WNT signaling pathway[J]. Journal of Cancer Research and Therapeutics, 2010,6(4):521-529.
[6] KOTOH M W. FGF, Notch, BMP, and hedgehog signaling pathways during carcinogenesis[J]. Stem Cell Reviews, 2007,3(1):30-38.
[7] 张英,林洪生. Wnt信号转导通路与肿瘤干细胞[J]. 现代肿瘤医学, 2009,17(2):347-350.

