NaCl胁迫对小麦种子胚在萌发时期蛋白含量的影响
刘向标 牛文婷 段江燕
(山西师范大学生命科学学院,临汾 041000)
土壤盐渍化影响着人类的农业生产,生态环境也面临着严峻的挑战。联合国粮农组织(FAO)和联合国教科文组织(UNESCO)对地球土壤进行分析,得出全世界约1.5亿hm2的耕地,0.77亿hm2受到盐化的影响[1]。我国的盐化地约2 000万hm2,次生盐化土壤约670万hm2,约占全国耕地总面积的14%,次生盐化土壤面积每年以3%的速度扩大[2]。
种子的萌发是植物生长的最关键时期,在一定的温度、水分、湿度条件下萌发时蛋白质的变化反映了植物基因组从休止到开启的表达情况[3]。近年来出现了大量的有关植物种子萌发时期蛋白质组学研究的文献报道:Callard等[4]以拟南芥种子为研究对象,分离到1 300多种蛋白质。Fu等[5]对拟南芥做了进一步分析,鉴定出355个独立基因编码的437个蛋白点。Yang等[6]对水稻种子萌发进行蛋白质组研究发现,有63种蛋白下调,69种蛋白上调。这些研究中多集中于拟南芥、水稻等植物,而在重要粮食作物小麦中却少有报道。小麦拥有抗盐基因[7],并且有类似的调节途径和抗盐因子。
2-DE技术为研究蛋白质的动态变化提供了重要的技术支撑,可以对生物细胞或组织的蛋白质表达进行定量分析,用于揭示不同条件下蛋白质表达的变化情况。该技术具有高通量、高灵敏度、高分辨率、重复性好等优点[8]。蛋白质组学技术在植物种子萌发过程中鉴定出的蛋白质,大部分是这一过程中的下游成分,而不是上游成分[9]。同时在所鉴定的相关蛋白质在数量、种类上还不能组建成详细的动力学代谢途径。这些信息的缺乏对我们进一步了解种子萌发机制是远远不足的。因此,我们通过识别NaCl胁迫下小麦种子萌发的蛋白含量变化的研究,对真正在蛋白质水平上进行种子萌发的研究有重要的意义。
本研究以“晋麦-47”为研究材料,比较不同浓度的NaCl溶液对小麦种子萌发过程中的抑制作用,确定小麦种子萌发的NaCl浓度伤害阈值和存活阈值。在小麦萌发时28 h(胚根突破种皮2-3 mm)时,把胚和胚乳(包含糊粉层)分离,将胚用于2-DE电泳、考马斯亮蓝染色、PDQuest软件对其进行研究,将有助于我们进一步从时空变化的角度理解NaCl胁迫下对小麦种子萌发的伤害机制和适应机制。
1 材料与方法
1.1 材料
1.1.1 小麦种子 “晋麦-47”由山西省农科院小麦研究所提供。
1.1.2 主要试剂 曲拉通X-100、超纯水、蒸馏水、丙酮、过硫酸铵(AP)、尿素、硫脲、十二烷基硫酸钠(SDS)、三羟基甲基氨基甲烷(Tris)、N、N、N、N-四甲基乙二胺(TEMED)、0.1% HgCl2、牛血清蛋白(BSA)、冰乙酸、甘油、两性电解质(Bio-Lyte)1%溴酚蓝、1 mol/L盐酸、CHAPS、碘乙酰胺(IAM)、低熔点琼脂糖、甘氨酸、丙烯酰胺(Acr)、85%磷酸、二硫苏糖醇(DTT)、95%乙醇、考马斯亮蓝G-250、甲叉双丙烯酰胺(Bis)。
1.2 方法
1.2.1 不同NaCl浓度对小麦种子萌发的影响 选取干燥度一致、饱满、种皮色泽正常的种子420粒。(经0.1% HgCl2溶液浸没消毒2 min后再用纯水漂洗5次),置于25 mL纯水,铺有双层定性滤纸的玻璃培养皿中,每皿60粒盖上盖。25℃恒温避光处理发芽。在7个培养皿内分别加入0、0.05、0.1、0.15、0.2、0.3和0.4 mol/L浓度的NaCl溶液,实时对培养皿进行称重补充蒸发的水分,保证各处理组浓度不变。以28 h胚根突破种皮2-3 mm的种子为标准。在4、8、12、16、20、24和28 h随机取20粒,统计每组的发芽率,每组均重复3次。
1.2.2 取样 根据不同NaCl浓度对小麦种子发芽率的影响,选出有显著差异的3个NaCl浓度,分别是0、0.1和0.2 mol/L。选取干燥度一致、饱满、种皮色泽正常的小麦种子,按照上述方法进行消毒、冲洗、吸去多余的水分后,分别用0、0.1和0.2 mol/L的NaCl溶液中,在25℃恒温箱中进行避光培养28 h,以胚根突破种皮2 mm为准,进行取样,将胚和胚乳(包含糊粉层细胞)进行分离。
1.2.3 小麦种子胚中可溶性蛋白2-DE样品的制备 按照上述3个浓度处理的小麦种子,用尿素/硫脲法提取小麦种子胚蛋白。取出的胚样品在液氮中磨成粉末加入离心管中,加入尿素/硫脲蛋白提取液振荡30 s,离心15 min后,取上清液再重复离心,收集上清液,加入3倍体积冷丙酮,并放入-20℃的冰箱里过夜,次日收集沉淀(视具体情况可再加一次,离心同上),4℃放置,使丙酮充分发挥,待沉淀干燥后,溶于400 μL样品裂解液,4℃冰箱中过夜,第2天离心取上清液,得到蛋白质样品液,4℃放置待用。
1.2.4 小麦种子胚中可溶性蛋白浓度的定量测定 把牛血清蛋白母液(100 mg/L)配成不同浓度用分光光度计测其OD值,得出标准曲线。再根据测得样品OD值估算出蛋白样品的浓度,以此确定后续试验中加样量的一致。进行多次重复试验,减少试验的偶然性几率。
1.2.5 小麦种子胚可溶性蛋白的2-DE 取出已经配好的水化上样液,加入0.001 g DTT,5 μL的40%Bio-Lyte(pH3-10),充分溶解,取均质的水化上样液与蛋白样品溶液以4∶1混匀,即为上样液。采用pH3-10,7 cm线性IPG预制胶条。主动水化在50 V电压下12 h后,经过250 V 0.5 h、500 V 0.5 h、4 000 V 3 h、最后稳定在4 000 V下进行20 000 Vh,500 V快速保持时间视情况而定。聚焦完毕后,胶条先在平衡液Ⅰ[尿素36 g、SDS 2 g、Tris-HCl(pH8.8)25 mL、甘油20 mL、DTT 0.2 g]中,在摇床上平衡15 min,再在平衡液Ⅱ(0.25 g IAM代替0.2 g DTT,其余组分同平衡Ⅰ)中平衡15 min。然后进行第二向SDS-聚丙烯酰胺凝胶电泳,分离胶浓度为12%。
1.2.6 考马斯亮蓝染色 剥离凝胶立即放入固定液(12% TCA)中固定2 h,充分固定后用双蒸水洗3次,每次5 min,取出放入考马斯亮蓝染液(20%甲醇、1.8%磷酸、8%硫酸铵、0.08%的考马斯亮蓝G250染色至少2 h,脱色液(7%、5%甲醇)脱色1 h后换用双蒸水进行脱色,直到蛋白点清晰为止。
1.2.7 2-DE图像分析 凝胶用扫描仪(UMAX)进行扫描,得到蛋白图像用PDQest软件进行分析包括背景消减、斑点检测、匹配、蛋白含量表达分析等。
2 结果
2.1 NaCl胁迫下小麦种子萌发的浓度确定
随着浓度的增大,未萌发的种子数目的趋势增强,选出具有代表不同盐胁迫下的3个NaCl浓度,即0(对照组)、0.1 mol/L(伤害阈值)、0.2 mol/L(存活阈值),作为盐胁迫下对小麦种子胚蛋白影响的浓度(图1)。
由图1可知,通过不同浓度NaCl处理后小麦萌发率均下降。浓度越高萌发率下降的程度越大,对种子的危害程度也越大,这表明NaCl胁迫确实降低了小麦种子的萌发能力。对不同浓度下NaCl对萌发率的影响发现,0 mol/L萌发率为93%、0.05 mol/L萌发率为89%,发现之间的萌发率差异不明显,说明0.05 mol/L的NaCl对小麦萌发的影响并不明显,可以把0.05 mol/L视作小麦种子萌发过程中的抗盐阈值;0.1 mol/L萌发率为68%、0.15 mol/L萌发率为60%,发现萌发率差异不明显,但是与0 mol/L的萌发率差异显著,表明这时的浓度已经达到或者超过了小麦种子抗伤害的界限,0.1 mol/L可看作是NaCl溶液对小麦种子的伤害阈值;0.2 mol/L萌发率为27%、0.3 mol/L萌发率为19%,此时的萌发率急剧下降,0.2 mol/L可看作是NaCl溶液对小麦种子存活阈值;0.4 mol/L这个浓度萌发率接近0,可认为0.4 mol/L为致死浓度。根据不同浓度NaCl胁迫下萌发情况,选取了有代表性的3个浓度,分别是0(对照组)、0.1 mol/L(伤害阈值)、0.2 mol/L(存活阈值)作为以下研究的NaCl浓度。本研究讨论NaCl胁迫下小麦种子萌发过程中胚蛋白含量的变化,因此致死浓度0.4 mol/L不在本研究的考虑范围之内。

图 1 不同浓度NaCl对小麦种子萌发率的影响
2.2 标准曲线绘制
根据改良Bradford方法测定蛋白质含量,并制成标准曲线(图2)。蛋白质上样量为0.5 mg。由图2可见,牛血清蛋白的含量与在595 nm的OD值呈线性相关。

图2 标准牛血清蛋白曲线
由图2标准曲线公式可以得出:0.1 mol/L NaCl时 样 品 的OD值 为0.207,浓 度 为1.096 μg/μL;0 mol/L NaCl时样品的OD值为0.202,浓度为1.07 μg/μL;0.2 mol/L NaCl时样品的OD值为0.197,浓度为1.045 μg/μL。
2.3 不同盐胁迫浓度下提取胚蛋白进行SDS-PAGE所得凝胶胶图像
为了进一步确定盐胁迫下影响小麦种子蛋白含量的浓度,分别提取7个浓度下的小麦胚蛋白样品100 μg进行SDS-PAGE(图3)。从图3可以清晰地看到随着盐胁迫浓度的上升,在凝胶上出现的蛋白条带出现的变化,充分说明盐胁迫确实对小麦胚的蛋白含量产生了影响。

图3 不同浓度的盐胁迫对小麦种子胚蛋白的SDS-PAGE
2.4 不同NaCl浓度处理后小麦种子胚差异蛋白变化
选取0、0.1及0.2 mol/L浓度的NaCl处理过的小麦种子露白时期的小麦胚蛋白100 μg,选用10 cm pH3-10的非线性胶条对上述的材料进行双向电泳。3种浓度的蛋白样品都进行3次重复操作。重点检测变化点,用来了解不同NaCl浓度处理对小麦种子萌发过程中蛋白质变化的影响。2-DE上的污点的灰度和位置的变化可以理解为蛋白质点的降解、合成或翻译后修饰。以0 mol/L NaCl处理的种子胚作为参考胶与其他两块胶0.1 mol/L NaCl胁迫、0.2 mol/L NaCl胁迫,通过用PDQuest8.0进行比对分析发现:在检测到的种子胚中以0 mol/L 时为对照胶约有蛋白点121个(图4);0.1 mol/L NaCl胁迫下(图5)有117个,其中有32个蛋白点丰度下调,21个蛋白点丰度上调,其中包括10个表达消失的点,3个新表达的点;在0.2 mol/L NaCl胁迫下(图6)有102个蛋白点,检测到46个蛋白质点丰度下调,16个蛋白点的丰度上调,其中包括16个表达消失的点,7个新表达的点。为了使差异蛋白点更清楚的观察,对部分变化的蛋白点进行了放大(图7)。
3 讨论
3.1 盐胁迫条件下NaCl浓度的选择

图4 0 mol/L NaCl胁迫下小麦种子2-DE图谱

图5 0.1 mol/L NaCl胁迫下小麦种子2-DE图谱
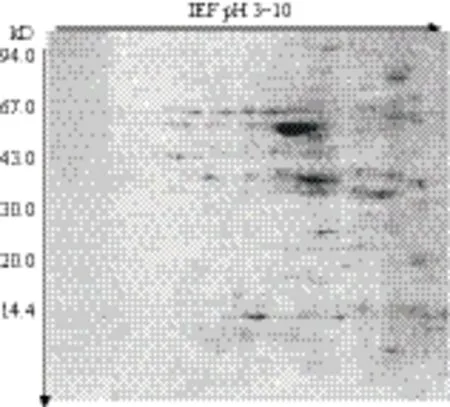
图 6 0.2 mol/L NaCl胁迫下小麦种子2-DE图谱
从不同NaCl浓度对小麦种子萌发率影响来看,明显地呈现出随着浓度的升高未萌发的种子数量的趋势加强。同时,对各浓度下小麦种子蛋白的SDSPAGE上更显著地体现出图一相同的特点,即0和0.05 mol/L之间,0.1 mol/L和0.15 mol/L之间,0.2 mol/L和0.3 mol/L之间对种子萌发的胁迫程度相近。因此,从中选出具有代表不同盐伤害程度的3个NaCl浓度,即0(CK对照)、0.1 mol/L(伤害阈值)、0.2 mol/L(存活阈值),作为本研究的NaCl处理浓度。因本研究只讨论NaCl胁迫下萌发种子的胚蛋白含量的变化,所以致死浓度0.3 mol/L不在选择范畴内。
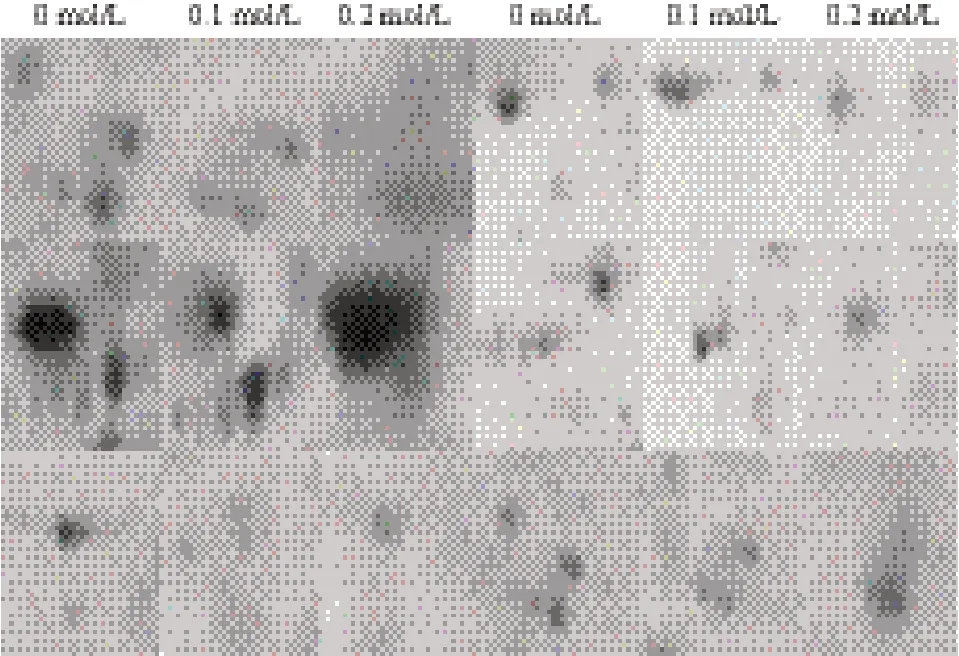
图 7 不同浓度盐胁迫下小麦种子萌发过程中胚蛋白部分放大的差异蛋白点
3.2 双向电泳分析差异蛋白
植物的整个生命活动周期中,种子的萌发过程是一个异养过程。对不同浓度处理后的小麦种子,很清楚地发现盐胁迫延迟了小麦种子的萌发。植物在受到非生物胁迫的时候,有些蛋白在萌发的过程中表达丰度上调了,这体现了植物体内会诱导产生一些新蛋白质或原有的蛋白含量的明显增加以适应逆境胁迫。本试验中NaCl胁迫下处理的小麦种子,其胚蛋白的凝胶图谱与正常的不同,说明NaCl胁迫处理影响了小麦种子胚中蛋白含量和组分。这与前人的研究结果一致。在盐胁迫、臭氧等外界因素的胁迫下,小麦种子中SAM基因的表达增强[10]。大麦、玉米、拟南芥种子中LEA蛋白质丰度的降低程度与种子处于寒冷和干旱胁迫有关[11],LEA蛋白能够通过束缚水分子来保护萌发中的活性组织,进而起到稳定蛋白的作用。盐胁迫下水稻、拟南芥中PSCS基因的转录水平提高了5倍[12],说明PSCS基因可被盐胁迫下诱导表达。山梨醇和海藻糖等也都是细胞渗透调节时产生的重要的可溶性物质,有利于增强植物的耐盐性[13],超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等在清除盐胁迫情况下产生的有害物质起到重要作用,同时,在转基因植物中也发现保护植物组织的相关蛋白表达含量提高了植物的耐盐性[14-16]。本研究中通过对不同浓度盐胁迫下2-DE分析发现,蛋白含量有下降和上升,也出现一些新蛋白。我们推测,这些变化都是植物体调节自身的理化反应,从而减缓盐胁迫情况下给机体带来的损伤。胁迫影响了胚正常发育过程中蛋白质的表达,并随胁迫程度的加强而加大。无规律变化上调的蛋白质,多是种子萌发过程中新产生的蛋白质,下调蛋白质是成熟种子原来贮藏的蛋白或是原有的mRNA翻译来的,对上调点和下调点影响的不同,说明盐胁迫的危害主要是由于影响了种子萌发过程中新蛋白的表达模式。
4 结论
代表不同盐伤害程度的3个NaCl处理浓度,即0 mol/L(CK对照)、0.1 mol/L(伤害阈值)、0.2 mol/L(存活阈值);在该处理浓度下,既有新的蛋白质的出现,也有原蛋白子含量的增加和减少。检测到正常的种子胚有121个点,0.1 mol/L NaCl胁迫下有32个蛋白点丰度下调,21个蛋白点丰度上调,其中包括10个表达消失的点,3个新表达的点;在0.2 mol/L NaCl胁迫下,检测到46个蛋白质点丰度下调,16个蛋白点的丰度上调,其中包括16个表达消失的点,7个新表达的点。
[1] Khan AG. Review:Mycorrhizoremediation—an enhanced form of phytoremediation [J]. Journal of Zhejiang University Science B, 2006, 7(7):503-514.
[2] 王宝山, 赵可夫, 邹琦. 作物耐盐机理研究进展及提高作物抗盐性的对策[J]. 植物学通报, 1997, S1:26-31.
[3] 程思思, 乙引, 张习敏, 马琛. 双向电泳技术在植物应答非生物胁迫蛋白质组学研究中的应用[J]. 安徽农业科学, 2010, 03:1135-1138.
[4] Xu X, Fan R, Zheng R, et al. Proteomic analysis of seed germination under salt stress in soybeans[J]. Journal of Zhejiang University Science B, 2011, 7:507-517.
[5] Phang TH, Shao Gm, Lam HM. Salt tolerance in soybean[J]. Journal of Integrative Plant Biology, 2008, 10:1196-1212.
[6] Yin C, Teng Y, Luo Y, Christie P. Proteomic response of wheat embryos to fosthiazate stress in a protected vegetable soil[J]. Journal of Environmental Sciences, 2012, 24(10):1843-1853.
[7] 张恒, 戴绍军. 植物盐胁迫应答蛋白质组学研究的技术策略[J]. 应用生态学报, 2011, 8:2201-2210.
[8] 刘卫, 陈蕊红, 张改生, 牛娜. 小麦遗传型与生理型雄性不育花药蛋白质双向电泳分析[J]. 遗传, 2008, 30(8):1063-1068.
[9] Jan A, Komatsu S. Functional characterization of gibberellinregulated genes in rice using microarray system[J]. Genomics Proteomics & Bioinformatics, 2006, 4(3):137-144.
[10] 陈章良, 瞿礼嘉. 高等植物基因表达的调控[J]. 植物学报, 1991(5):390-405.
[11] 刘昀, 刘国宝, 李冉辉, 等. 胚胎晚期富集蛋白与生物的干旱胁迫耐受性[J]. 生物工程学报, 2010(5):569-575.
[12] 贺长征, 胡晋, 朱志玉, 等. 混合盐引发对水稻种子在逆境条件下发芽及幼苗生理特性的影响[J]. 浙江大学学报:农业与生命科学版, 2002(2):59-62.
[13] Iordachescu M, Imai R. Trehalose biosynthesis in response to abiotic stresses[J]. Integr Plant Biolo, 2008, 10:1223-1229.
[14] 李国龙, 吴海霞, 温丽, 等. 作物抗旱生理与分子作用机制研究进展[J]. 中国农学通报, 2010, 23:185-191.
[15] 马长乐, 王萍萍, 曹子谊, 等. 盐地碱蓬(Suaeda salsa)APX基因的克隆及盐胁迫下的表达[J]. 植物生理与分子生物学学报, 2002(4):261-266.
[16] 马秀灵, 王增兰, 戚元成, 等. 硫腺苷甲硫氨酸合成酶基因的克隆及其在盐胁迫条件下的不同表达(英文)[J]. Acta Botanica Sinica, 2003(11):1359-1365.

