低氘白酒对人肺腺癌细胞的抑制作用
张亚茹,沈才洪,郑有丽,卢中明,敖宗华,丛峰松,*
(1.上海交通大学生命科学与技术学院,上海 200240;2.四川泸州老窖股份有限公司,四川 泸州 646000)
长期以来,酒精在肿瘤发展过程中所扮演的角色一直是不清楚的[1]。通常,白酒本身被认为是具有致癌性的。Mufti等[2]提出,在化学性的诱导食道癌过程中,白酒作为一个促进剂出现,但是在这个过程开始之前以及开始期间,它又抑制了肿瘤的发生率。Hayashi等[3]认为,慢性白酒促进了1,1-二甲肼所诱导的结肠癌的生成,进一步证实了Mufti等的观点。然而,杨连君等[4]认为,低剂量乙醇能够明显地诱导HCC-9204肝癌细胞凋亡。目前,白酒与肿瘤的关系还没有定论。
在自然界,水由2个氢原子和1个氧原子组成,其中氢元素有氕、氘和氚3种同位素。在地表水中,氘和氕的比率大约是1:6600,即水中氘的体积分数为0.015%[5]。通常把氘体积分数低于0.015%的水称为低氘水(DDW)。关于DDW的抑制肿瘤研究方面,Somlyai等[6]报道,DDW可以抑制小鼠成纤维L929细胞的生长速率和引起移植瘤小鼠肿瘤组织消退。俄罗斯研究人员最近发现,如果把普通水中氘的体积分数减少65%,就会表现出一定的抗肿瘤特性,抑制瘤小鼠实验结果也显示,DDW能抑制肿瘤生长,延长小鼠存活期[6-8]。本课题的研究也进一步证实,氘体积分数为0.0050% DDW在体内外均可抑制肿瘤的生长[9]。
中国白酒与水的关系密切。选择合适的发酵用水或加桨降度以提高酒的品质,降低白酒对人体的危害性,一直以来是人们关注的问题。本实验从体内、外实验探讨了低氘水、白酒以及低氘白酒对人肺腺癌细胞生长的抑制作用。
1 材料与方法
1.1 动物与材料
BALB/c裸鼠60只,5~6周龄,雄性,(20±2)g,购自必凯实验动物有限公司[动物合格证号SCXK(沪)]。饲养于上海交通大学药学院实验动物中心SPF级动物房,室温25℃,湿度40%~70%之间,自由进食与饮水。
白酒由泸州老窖股份有限公司提供。
1.2 试剂与仪器
人肺腺癌细胞株H460 上海市中国医学科院细胞研究所;人肺癌细胞株A549 中国科学院细胞库。DDW(体积分数0.0050%) 上海池天超轻水生物工程有限公司;胎牛血清 杭州四季清公司;RPMI1640培养基 美国Gibco公司;MTT、TUNEL和Anexin-Ⅴ试剂盒 南京凯基生物公司。
Multiskan MK3型酶标仪 美国Thermo公司;倒置显微镜 日本尼康公司;HF151UV CO2培养箱 立申仪器有限公司;超净工作台(净化效率100级) 瑞士梅特勒-托利多公司;FACSCalibur流式细胞仪型号 美国BD公司。
1.3 方法
1.3.1 细胞培养
人肺癌细胞株A549和H460分别在含10%胎牛血清的RPMI1640培养基、5% CO2、37℃条件下培养。实验中,细胞种植于培养瓶中,90%的细胞汇合时,用于实验。
1.3.2 MTT法
A549细胞(104个/孔)接种于96孔培养板中。共分为4组,空白组:由正常1640培养基培;白酒组:在正常培养基中加入0~300mmol/L酒精,设置不同的酒精浓度梯度,以便测出最佳酒精作用浓度;DDW组:氘体积分数为0.00050%;DDA组:DDW配制的培养基中含0~300mmol/L的酒精。不同组别培养A549细胞24、48、 72h,分别加入50μL MTT试剂溶液继续培养4h后,吸净培养液后每孔加150μL DMSO,振荡10min,选择550nm波长,测定各孔的OD值。每组设5个复孔。

1.3.3 TUNEL法检测细胞凋亡
空白组、白酒组(含180mmol/L酒精)、DDW组以及DDA组(含180mmol/L酒精)培养A549 细胞48、72h。阴性对照组:正常条件下培养,标记过程中不加TDT Enzyme。阳性对照组:A549细胞用1000U DNaseⅠ反应液处理。按照试剂盒说明进行操作,选择苏木素进行复染。光学显微镜观察,细胞体积缩小及变形;核浓染及丧失亚形态结构,可见核染色质呈新月型,或者核碎裂成大小不等的核碎片,即典型凋亡的形态学改变。每张片子随机计数200个细胞,计算凋亡率。
1.3.4 流式细胞仪检测细胞凋亡
培养A549细胞48、72h,收集空白组、白酒组、DDW组以及DDA组的细胞。用PBS洗两次,用不含EDTA的胰酶消化细胞,约1~2min后终止消化。离心收集细胞,用PBS洗2次后弃上清,加500μL Binding Buffer悬浮,加5μL PI后混匀,再加入5μL FITC混匀,避光反应10min,上机检测。
1.3.5 人肺腺癌细胞裸鼠移植瘤模型的建立和分组
将裸鼠随机分为6组:空白组、白酒低剂量(CL)组(V(白酒):V(超纯水)=1:5.7)、白酒高剂量(CH)组(V(白酒):V(超纯水)=1:3)、DDW组、DDA低剂量(DDAL)组(V(白酒):V(DDW)=1:5.7)、DDA高剂量(DDAH)组(V(白酒):V(DDW)=1:3),每组10只。DDW组、DDAL组和DDAH组,提前饮用灭菌DDW,其他3组正常饲养。2周后,收集人肺癌细胞H460株,调整密度为1×107个/mL,用1mL注射器取上述细胞悬液0.2mL(含细胞数目2×106个),注射于裸鼠右腋部皮下,即完成裸鼠肿瘤接种。
1.3.6 给药情况及样本的采集
造模当日灌胃,每天灌胃1次,每次0.2mL。25d后,采血后断颈处死荷瘤裸鼠,剥取皮下实体瘤瘤块,剔除筋膜,用电子天平分别称质量。计算各组瘤质量和抑瘤率。-70℃保存小鼠肺、肝、肾、脾以及瘤体,后续以备进行病理以及蛋白检测之用。
1.3.7 肿瘤生长情况及抑瘤效果的观察
造模10d,每3d测量瘤体的最长径(a)和最短径(b),根据式(2)计算肿瘤体积(V),绘制肿瘤生长曲线。最后一次灌胃24h后剥离瘤体,按公式(3)计算抑瘤率。

1.3.8 HE染色
取血后,颈椎脱臼处死动物,取瘤体、肝、肺组织于4%中性甲醛固定、取材、脱水、石蜡包埋、4μm厚切片、HE染色、封固,光镜条件下进行病理学观察。
1.4 统计学处理
采用SPSS 统计软件包进行数据分析,采用单因素方差分析,两组间的差异比较,以P<0.05为具有统计学差异。
2 结果与分析
2.1 不同浓度酒精对A549细胞增殖的影响

图 1 不同酒精浓度与A549细胞增殖的关系Fig.1 Effect of alcohol on the proliferation of A549 cells
已知高剂量的白酒对细胞有损伤作用,本研究首先确定体外实验白酒的剂量。由图1可知,在酒精浓度为180、200mmol/L处,细胞的增殖率几乎相等,分别为88.429%、88.943%,而酒精浓度超过200mmol/L时,细胞增殖随着酒精浓度的增加被抑制,因此体外MTT的酒精浓度范围确定为150~200mmol/L。
在上述初定范围内,分别选取150、180、200mmol/L 3个不同酒精浓度,进一步确定最佳细胞增殖抑制浓度。
由图2A可知,与空白组比较,DDW组、白酒组(含150mmol/L酒精)及DDA组(含150mmol/L酒精)细胞增殖受到抑制(P<0.05)。其中,在72h时,DDA组(细胞增殖率为(71.88±2.47)%与白酒组(细胞增殖率为(91.81±3.70)%)比较,差异具有统计学意义(P<0.05);DDA组与DDW组(细胞增殖率为(72.96±1.22)%)比较,无显著性差异。
由图2B可知,与空白组比较,DDW组、白酒组(含180mmol/L酒精)及DDA组(含180mmol/L酒精)细胞增殖受到抑制(P<0.05)。其中,在72h时,DDA组(细胞增殖率为(70.58±2.73)%)与白酒组(细胞增殖率为(94.36±3.31)%)比较,差异具有统计学意义(P<0.05)。DDA组与DDW组(细胞增殖率为(72.96±1.22)%)比较,无显著性差异。
由图2C可知,与空白组比较,DDW组、白酒组(含200mmol/L酒精)及DDA组(含200mmol/L酒精)细胞增殖受到抑制(P<0.05)。其中,DDA组与白酒组比较,差异具有统计学意义(P<0.05)。在48h时,DDA组(细胞增殖率为(77.50±2.00)%)与DDW组(细胞增殖率为(81.25±0.72)%)比较,无显著性差异。

图 2 3种不同酒精浓度对A549细胞增殖的影响Fig.2 Effect of alcohol concentration on the proliferation of A549 cells
含酒精180mmol/L的白酒组、含酒精150mmol/L的白酒组与含酒精200mmol/L的白酒组比较,前者对细胞增殖抑制作用介于后两者之间,故本研究选定180mmol/L酒精浓度进行后续体外实验。
2.2 TUNEL 法检测DDA对A549 细胞凋亡的影响
TUNEL检测显示,DDW、DDA以及白酒作用A549 细胞48、72h后,引起细胞出现典型的细胞凋亡特征(图3)。空白组细胞的凋亡率为(8.468±1.203)%,阳性对照组细胞凋亡率为(36.762±2.733)%。DDW组、白酒组以及DDA组与空白组比较,能显著诱导细胞凋亡,差异具有统计学意义(P<0.05)。同时,DDW组以及DDA组与白酒组比较,能显著促进细胞凋亡(P<0.05)。DDA组与白酒组比较,细胞凋亡更加显著(P<0.05)。随着时间的推移,相同浓度白酒组之间,凋亡率增加(图4)。

图 3 TUNEL法检测DDA诱导的细胞凋亡(×400)Fig.3 DDA-induced apoptosis of A549 cells evaluated by TUNEL method (×400)

图 4 图片显示TUNEL数据Fig.4 Plot of the TUNEL data
2.3 流式细胞仪检测DDA引起的A549细胞凋亡
用DDW、DDA和白酒组分别培养A549细胞,48h后收集处理,上机检测细胞凋亡情况,如图5所示。

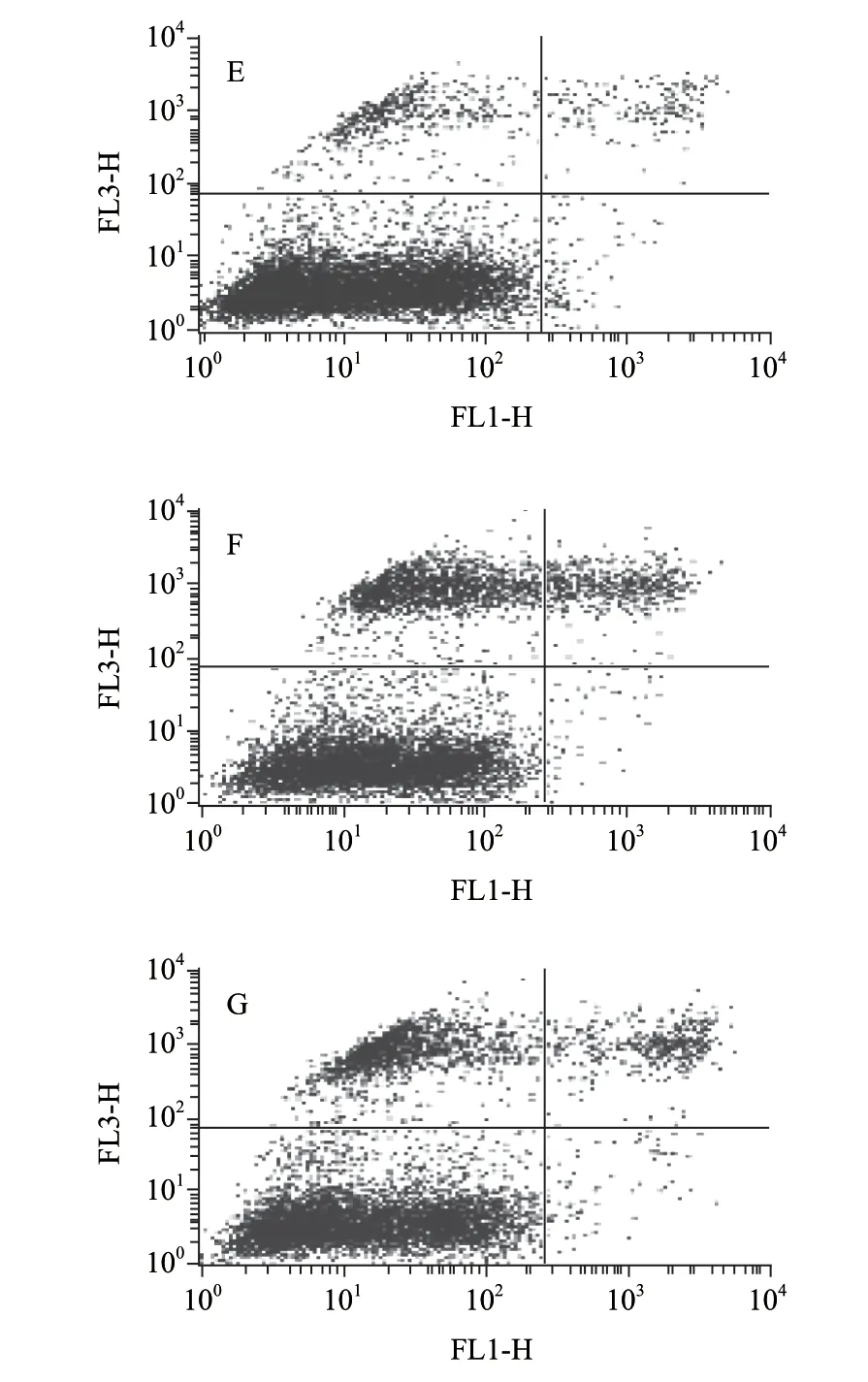
图 5 流式细胞仪检测DDA诱导的细胞凋亡Fig.5 DDA-induced apoptosis of tumor cells evaluated by FCM assay
表 1 流式细胞仪检测DDA诱导细胞凋亡(±s)Table 1 DAA-induced apoptosis of tumor cells evaluated by FCM assay (±s) %

表 1 流式细胞仪检测DDA诱导细胞凋亡(±s)Table 1 DAA-induced apoptosis of tumor cells evaluated by FCM assay (±s) %
组别48h72h空白组2.23±0.211.45±0.20 DDW组2.64±0.172.58±0.15白酒组4.59±0.236.99±0.39 DDA组4.04±0.145.80±0.54
由表1可知,作用48h时,空白组细胞凋亡率为(2.23±0.21)%,DDW组细胞凋亡率为(2.64±0.17)%,白酒组凋亡率为(4.59±0.23)%,DDA组凋亡率为(4.04±0.14)%。作用72h后则各组凋亡率与48h的各组凋亡率无明显变化。
2.4 DDA对肺癌移植瘤生长的抑制
治疗前各组裸鼠生理状态无明显差异。由图6可知,灌胃9d后,各组肿瘤体积均有所增长,除CH组与空白组外,其他各组肿瘤的生长速度明显缓慢。其中DDAL组瘤体生长最为缓慢,其次是DDW组,接着是DDAH组和CL组。由表2可知,DDAL组抑瘤率为31.014%,DDW组抑瘤率为27.639%,与空白组比较,差异具有统计学意义。CH组对移植瘤生长具有促进作用。

图 6 肺癌移植瘤生长曲线Fig.6 Growth curve of xenograft with lung cancer cells
表 2 裸鼠移植瘤体积以及抑瘤率(±s) Table 2 Volumes and inhibitory rates of H460 cells in nude mice (±s)

表 2 裸鼠移植瘤体积以及抑瘤率(±s) Table 2 Volumes and inhibitory rates of H460 cells in nude mice (±s)
注:*.与空白组比较有显著性差异(P<0.05)。
组别数量瘤体体积/cm3抑瘤率/%空白组102.56±0.56 DDW组101.85±0.1327.639*DDAL组101.77±0.2331.014*DDAH组92.14±0.6616.531 CL组102.05±0.1319.584 CH组102.75±1.26-7.64
2.5 HE染色观察移植瘤、肺、肝组织病理变化

图 7 HE染色法检测肿瘤组织的病理变化(×100)Fig.7 Pathological change of tumor tissues with HE staining (×100)
由图7可知,空白组中肿瘤细胞排列密集,组织生长活跃(图7D)。相比较之下,DDW组与DDAL组,肿瘤细胞周围有坏死的组织,肿瘤细胞的数量明显低于空白组(图7A、B)。而CL组和DDAH组与空白组比较,肿瘤细胞排列更为松散,有坏死的肿瘤细胞(图7C、E)。CH组中肿瘤细胞排列紧密,切片显示肿瘤组织中有血管,癌细胞生长旺盛(图7F)。

图 8 HE染色法检测肺组织的病理变化(×100)Fig.8 Pathological change of lung tissues with HE staining (×100)
由图8裸鼠肺部组织HE染色可知,空白组中小鼠肺部正常无肿瘤病灶产生,肺部有完成的肺泡,肺泡管及肺泡囊、肺泡和肺泡之间的间隔正常(图8D)。其余各组的肺泡结构与空白组比较,无病理变化(图8A~F)。
图9裸鼠肝脏组织HE染色显示,空白组中小鼠的肝脏结构正常,肝细胞形态,大小结构正常,肝细胞排列整齐,细胞间界限清晰(图9D)。其余各组的肝部结构与空白组比较,无病理变化(图9A~F)。


图 9 HE染色法检测肝组织的病理变化(×100)Fig.9 Pathological change of liver tissues with HE staining (×100)
3 讨 论
通过实验研究证实,低剂量低氘白酒在体内外均能显著抑制人肺腺癌肿瘤细胞的生长。MTT结果显示,与同浓度的白酒组比较,低氘白酒能显著抑制肺癌细胞A549的生长。TUNEL法检测表明低氘白酒、低氘水以及白酒均能引起A549细胞凋亡。其中,低氘白酒比白酒组诱导凋亡更显著。同时,随着时间的推移,凋亡率增加。流式细胞术检测进一步证实低氘白酒、低氘水以及白酒均能引起A549细胞凋亡,与正常组比较,低氘白酒诱导了更多的凋亡。目前认为,酒精抑制肿瘤细胞生长的可能性机制为:1)导致细胞染色体受到损伤,DNA发生断裂,DNA修复酶的功能受到抑制[10];2)致使细胞内电子传递链收到损伤,ATP合成的功能受到损害,激发脂质的过氧化,促使细胞内生物膜的流动性发生改变[11];3)酒精代谢产生的中间产物,潜在的造成细胞的损伤,影响细胞的增殖。已有的研究表明[9],低氘水主要是通过诱导肿瘤细胞凋亡发生作用的。在体外,低氘水和酒精共同促进了肿瘤细胞凋亡。
在体内实验中,发现高剂量白酒促进肿瘤生长,而低剂量白酒抑制肿瘤生长。已有的研究指出[12]长期摄入酒精能增大肿瘤并增加血管生成因子和血管内皮生长因子(VEGF)的水平。研究还发现,低剂量的低氘白酒能显著抑制裸鼠移植瘤的生长,且与空白组比较,具有显著性差异,并且较其他实验组抑瘤效果好。病理观察显示,低氘白酒组瘤组织细胞排列松散,并发现有坏死肿瘤细胞。体内实验结果表明,低氘水与白酒联合使用具有协同作用进一步抑制了肿瘤细胞生长。
肝、肺病理切片显示,低氘水组和低氘白酒组小鼠的肝、肺组织正常,无明显病理变化,与Kovacs等[13]的结论一致。未来抗肿瘤药物的研究方向将是高效低毒,因此低氘水具有进一步深入研究的价值。
[1] MUFTI S I, ESKELSON C D, ODELEYE O E, et al. Alcoholassociated generation of oxygen free radicals and tumor promotion[J]. Alcohol & Alcoholism, 1993, 28(6): 621-638.
[2] MUFTI S I, BECKER G, SLIPES I G. Effet of chronic dietary ethanol consumption on the initiation and promotion of chemically-induced esophageal carcinogenesis in experimental rats[J]. Carcinogenesis, 1989, 10(2): 303-309.
[3] HAYASHI N, TSUTSUMI M, FUKURA M, et al. Effect of chronic dietary ethanol consumption on colonic cancer in rats induced by 1,1-dimethylhydrazine[J]. Alcohol Clin Exp Res, 2007, 31(Suppl 1): 72-76.
[4] 杨连君, 王文亮. 乙醇诱导肝癌细胞凋亡及其相关蛋白的研究[J]. 中国肿瘤临床与康复, 2001, 8(2): 3-5.
[5] SINIAK I E, TURUSOV V S, GRIGOREV A I, et al. Consideration of the deuterium-free water supply to an expedition to Mars[J]. Aviakosam Ekolog Med, 2003, 37(6): 60-63.
[6] SOMLYAI G, JANCSO G, JAKLI G, et al. Naturally occurring deuterium is essential for the normal growth rate of cells[J]. FEBS, 1993, 317: 1-4.
[7] TURUSOV V S, SINIAK I E, GRIGOR’EV A I, et al. Low-deuterium water effect on transplantable tumors[J]. Vopr Onkol, 2005, 51(1): 99-102.
[8] TYRYSOV V S, SINIAK I E, ANTOSHINA E E, et al. The effect of preliminary administration of water with reduced deuterium content on the growth of transplantable tumors in mice[J]. Vopr Onkol, 2006, 52(1): 59-62.
[9] CONG Fengsong, ZHANG Yaru, WANG Juyong, et al. Deuteriumdepleted water inhibits human lung carcinoma cell growth by apoptosis[J]. Experimental and Therapeutic Medicine, 2010, 1: 277-283 .
[10] DUDLEY B F, BRIMFIELD A A, WINSTON G W. Oxidation of thiodiglycol (2,2’-thiobis-ethanol) by alcohol dehydrogenase: comparison of human isonzymes[J]. J Biochem Mol Toxicol, 2000, 14(5): 244-251.
[11] NAVASUMRIT P, WARD T H, DODD N J, et al. Ethanol-induced free radicals and hepatic DNA strand breaks are prevented in vivo by antioxidants: effects of acute and chronic ethanol exposure[J]. Carcinogenesis, 2002, 21(1): 93-99.
[12] TAN W, BAILEY A P, SHPARAGO M, et al. Chronic alcohol consumption stimulates VEGF expression, tumor angiogenesis and progression of melanoma in mice[J]. Cancer Biol Ther, 2007, 6(8): 1211-1217.
[13] KOVACS A, GULLER I, KREMPELS K, et al. Deuterium depletion may delay the progression of prostate cancer[J]. Journal of Cancer Therapy, 2011, 2: 548-556.

