两步固态发酵法酿造功能性豆豉*
龚福明,宋园亮,张忠华,李晓然,罗义勇,柳陈坚
1(昆明理工大学生命科学与技术学院应用微生物研究室,云南昆明,650500)
2(德宏职业学院基础系,云南芒市,678400)
豆豉是以大豆为主要原料,经由原料处理、制曲及后发酵三阶段酿制而成,不仅风味独特,而且富含多种生理活性物质,因而具有开胃增食、消积化滞、驱风散寒及预防心脑血管疾病等功能。虽然中国豆豉历史悠久,然而传统作坊式生产及研究起步晚等因素导致缺乏相应的科研成果。与之相比,纳豆(Natto)和天培(Tempeh)则分别建立以Bacillus natto sawamura及Rhizopus oligosporus NRRL2710作为发酵菌种[1-2]的纯种发酵工业模式。因此,有必要分析豆豉发酵参数及发酵菌群,以期筛选出符合制曲要求的微生物进行纯种发酵,实现豆豉生产的规模化和产业化。
研究发现,豆豉后发酵阶段存在诸如枯草芽孢杆菌与植物乳杆菌、短乳杆菌、屎肠球菌及嗜酸片球菌等乳酸菌[3-4]。其中的枯草芽孢杆菌能通过分泌多种生物酶来水解蛋白并产生水溶性氮,从而降低豆粒硬度,利于发酵。乳酸菌则能通过合成与有机酸代谢、脂肪分解及维生素合成等相关的酶系,来分解发酵基质中的糖类、脂肪和多肽等化合物而产生各种风味物质及生理活性物质,最终达到提高食品营养价值、改善风味、延长食品保质期,增强豆豉生理保健机能的目的[5]。
本研究运用分离自云南传统发酵豆豉的Bacillus subtilis SP-8-5(GenBank No.JX993830)与Lactobacillus plantarum YM-5-2(GenBank No.GU369765)进行两步固态发酵酿制功能性豆豉。经该工艺发酵得到一种风味良好、感官极佳、保质期长且具有极强纤溶酶活性的豆豉,以期为生产新型功能性混合发酵豆豉奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验用菌株
分离自云南传统发酵豆豉的8株具有高产豆豉纤溶酶活性的枯草芽孢杆菌(菌株编号依次为LC-2-1,SP-8-5,LC-6-3,JS-13-1,JS-6-2,JS-1-2,ZT-13 和 JS-1-3)、2 株乳酸菌,Lactobacillus plantarum YM-5-2和Lactobacillus brevis GJ-1-3(GenBank No.JX993837),上述菌株均保存于昆明理工大学生命科学与技术学院应用微生物研究室。
1.1.2 实验用大豆及对照样品
原料大豆为金谷散装大豆;对照样品:香葱豆豉及牛肉豆豉;花芝麻豆豉及太和豆豉;老干妈风味豆豉;干煸肉丝油辣椒豆豉;花大门豆豉及风吹豆豉;日本纳豆。以上原料均购于昆明各大超市。
1.1.3 主要试剂及培养基
(1)50 mmol/L的磷酸盐缓冲液(pH7.4)精确秤取15.4 g Na2HPO4和1.25 g NaH2PO4溶于蒸馏水,定容至1 000 mL,121℃灭菌后即为50 mmol/L的磷酸盐缓冲液。
(2)纤维蛋白含量0.3%的琼脂糖平板制备[6]:将3.0 g纤维蛋白溶于500 mL灭菌磷酸盐缓冲液(浓度50 mmol/L,pH7.4)中搅拌过夜;然后将10 g琼脂糖溶于500 mL灭菌磷酸盐缓冲液(浓度50 mmol/L,pH7.4),待琼脂糖溶液冷却至70℃时将二者混匀制平板,每个平板25 mL,待凝固后打孔(打孔直径为6.0 mm)。
(3)MRS肉汤培养基[pH(6.2±0.2),Oxoid]。除特别注明,所有试剂均为分析纯。
1.2 方法与步骤
1.2.1 豆豉发酵工艺流程
豆豉种类繁多,酿造工艺复杂,但主要分为前处理(即原料处理)、制曲及后发酵3个阶段[7-12],本研究所使用的酿造工艺基本上也分成3个阶段,只是在制曲时采用了两步固态混合发酵,其主要酿造工艺流程见图1。
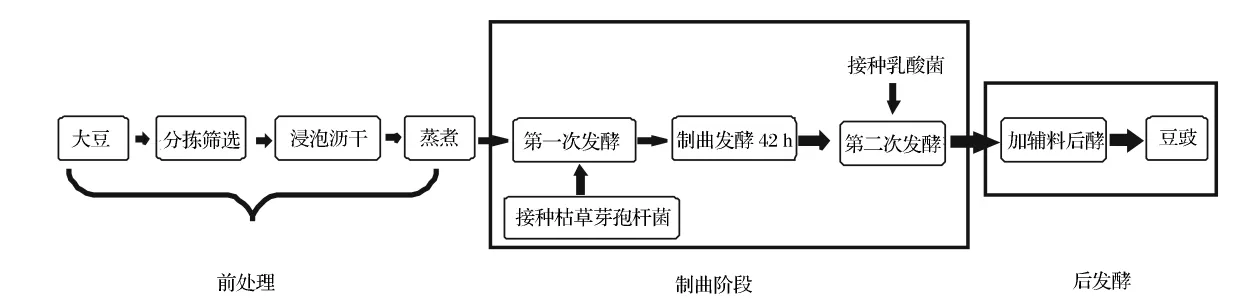
图1 豆豉的发酵工艺流程Fig.1 The flow chart of Douchi processing
1.2.2 原料豆的处理
按1∶3的浸泡比例于室温 (20℃)连续浸泡24 h,每隔2 h检查一次大豆的浸泡程度。将浸泡好的大豆沥干后放入器皿中,纱布封口后分别于108℃、110℃、115℃、118℃及121℃高压蒸煮,以确定蒸煮温度和时间对大豆的影响。
1.2.3 发酵制曲
1.2.3.1 豆豉发酵制曲
(1)种子液制备及扩大培养:将上述8株高产豆豉纤溶酶的枯草芽孢杆菌保存液解冻,分别吸取30 μL菌种液接种至5 mL灭菌营养肉汤中 (杭州天和微生物试剂),35℃振荡(170 r/min)培养48 h,随后将该种子液按2%(v/v)的比例接种至40 mL灭菌营养肉汤中振荡培养 (35℃,170 r/min,48 h),培养结束后离心弃上清液(4℃,8 000 r/min,10 min),用25 mL灭菌生理盐水洗脱菌体2次;乳酸菌则按上述步骤将菌株分别接种至MRS肉汤培养基中进行菌种复壮、扩大培养及菌体处理,培养条件为35℃静置48 h。
(2)枯草芽孢杆菌的耐盐性分析:分别将50 μL复壮活化的枯草芽孢杆菌种子液接种至NaCl浓度为0%、3%、4%、5%、6%、7%的营养肉汤中振荡培养24 h(35℃,170 r/min),培养结束后对培养液进行适当稀释,于600 nm处测定菌体浓度[13-15],进而初步确定菌株耐盐性。
(3)豆豉发酵制曲条件探讨:将耐盐菌株分别接种至100 g经蒸煮处理并冷却至30℃的大豆中,随后分别置于20℃、23℃、26℃、29℃、32℃、35℃及37℃发酵42 h,并以菌体生长量及感官评定值为评价标准确定最佳发酵温度。最终将豆豉在最适发酵温度(26℃)下连续发酵54 h,在发酵24 h后每间隔6 h取样1次,并根据豆豉发酵程度及感官评定结果确定豆豉最佳发酵时间。
(4)感官评定对16名食品专业的老师和学生(男女各半)进行基本的感官评价培训后按表1体系进行评价,评价完一个样品后休息1 min,并用纯净水漱口后再评定下一个样品。将16份感官评定的各项目得分求均值后再将各项目得分均值加合即为总得分,总得分越高表明豆豉感官越好,越容易被消费者接受。
1.2.3.2 盐含量对B.subtilis SP-8-5发酵豆豉纤溶酶活性及活菌数影响
(1)盐含量对发酵豆豉中酶活性影响:在发酵半成品豆豉中分别添加 0%、1%、2%、3%、4%、5%NaCl,4℃后发酵72 h,随后分别秤取豆豉样品1.0 g,添加至5 mL灭菌生理盐水振荡混匀,4℃浸泡24 h后的离心上清液(4℃,8 000 r/min)即为豆豉纤溶酶粗酶液。分别将50 μL豆豉纤溶酶粗酶液滴加至0.3%纤维蛋白平板 (平板使用前先进行30 min紫外灭菌),待粗酶液完全被吸收后,35℃静置培养24 h。培养结束后,观察并测量纤溶圈直径,以纤溶圈大小来初步测定豆豉纤溶酶活性。
(2)豆豉中活菌数测定:分别秤取样品豆豉1.0 g,用5 mL灭菌生理盐水,4℃浸泡6 h,混匀后选适宜稀释度的菌液20 μL涂营养肉汤琼脂平板,35℃倒置培养48 h后计数(计数时琼脂平板菌落数应在30~300之间)。此外,对9个市售豆豉样品的纤溶活性及活菌数进行测定并与样品豆豉比较。
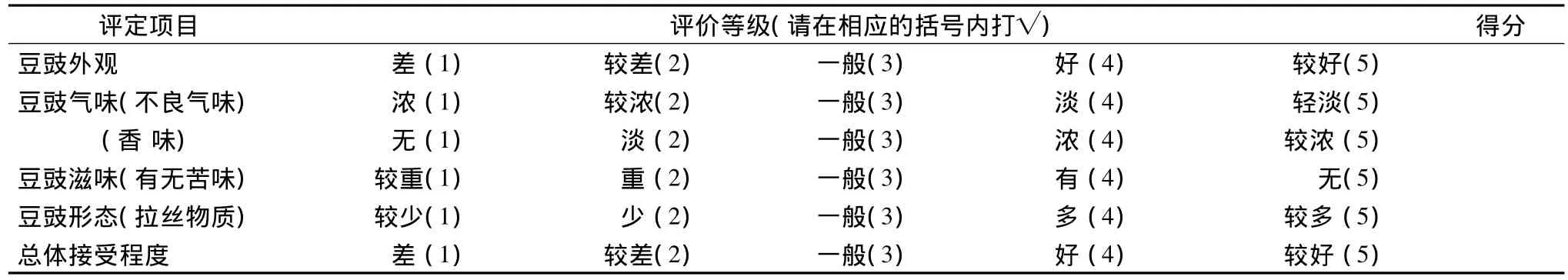
表1 豆豉感官评价Table 1 The sensory evaluation experiment of Douchi
1.2.4 乳酸菌的二次发酵制曲
1.2.4.1 乳酸菌与B.subtilis SP-8-5的拮抗实验
(1)乳酸菌复壮活化:将乳酸菌解冻混匀后各取30 μL接种至5 mL灭菌MRS肉汤培养基中复壮(35℃,静置48 h);随后按2%的接种比例用50 mL灭菌MRS肉汤培养基扩大培养(35℃,静置36 h)。
(2)采用spot-on-lawn法研究乳酸菌对B.subtilis SP-8-5的拮抗作用,用MRS琼脂培养基做基层平板,将5 μL适当稀释的乳酸菌菌液(106CFU/mL)滴加至基层平板中央,待其完全吸收后35℃静置培养48 h;随后将含有20 μL指示菌液(106CFU/mL)营养软琼脂培养基(0.75%琼脂)迅速平铺于已培养48 h的基层培养基上,35℃静置培养24 h后观察抑菌现象。
1.2.4.2 乳酸菌发酵对豆豉感官评价影响
将1.6 kg大豆按最佳条件进行初步发酵,发酵结束后分4组:A组为对照;B组接种50 mL L.brevis GJ-1-3菌液;C组接种50 mL L.plantarum YM-5-2菌液;D组接种25 mL L.brevis GJ-1-3菌液及25 mL L.plantarum YM-5-2菌液,30℃静置发酵48 h后,4℃后酵48 h,即为成品豆豉。最后按表2体系进行感官评价,得分越高表明其感官越好,越容易被消费者接受。

表2 乳酸菌发酵豆豉的感官评价Table 2 The sensory evaluation experiment of lactic acid bacteria fermented Douchi
1.2.4.3 乳酸菌对豆豉后发酵影响
(1)乳酸菌发酵对豆豉纤溶酶活性及枯草芽孢杆菌活菌数影响:参照1.2.3.2方法检测乳酸菌发酵后成品豆豉中枯草芽孢杆菌活菌数变化及其纤溶酶活性。
(2)样品豆豉pH值变化:分别取后发酵3 d、7 d、14 d、21 d、26 d、31 d、45 d 及 61 d 时的成品豆豉1.0 g,于5 mL灭菌生理盐水4℃浸泡24 h后用便携式pH计(pH BOY-KS723;日本AS ONE)测定离心上清液的pH值(4℃,8000 r/min,8 min)。
(3)样品豆豉中维生素含量变化将乳酸菌二次发酵后14 d的样品豆豉送至云南省农产品质量安全检验测试中心对部分维生素(叶酸、烟酸、VB6、VB5等)含量进行分析测定。
(4)豆豉样品货架期将完成发酵的豆豉置于4℃及室温下跟踪观察霉变情况及风味变化,以分析确定成品豆豉的货架期。
2 结果与分析
2.1 原料豆前处理
前处理(即原料处理)是豆豉酿制的首要环节,只有经过充分前处理的大豆才有利于微生物附着制曲。本研究显示,大豆按1∶3的比例于室温(20℃)浸泡10 h,110℃蒸煮20 min,此条件浸泡时无泡沫出现,豆粒含水量适宜且软硬合适,蒸煮后豆粒柔软且散发浓郁豆香味,用手压后种皮易被搓破。
2.2 发酵制曲
2.2.1 温度对制曲影响
枯草芽孢杆菌于26℃,发酵42 h后豆豉产生大量拉丝物质并伴有浓郁豉香。
2.2.2 制曲菌株耐盐性
本研究所使用的8株枯草芽孢杆菌均显示较强耐盐性,其中B.subtilis SP-8-5和B.subtilis ZT-13的耐盐性尤为突出;盐添加量为7%时,2菌株所发酵豆豉的活菌数分别为(1.87±0.02)×109CFU/mL与(1.97±0.02)×109CFU/mL,与空白对照组相比差异不显著[分别为(2.41±0.02)×109CFU/mL和(2.11±0.02)×109CFU/mL],当盐添加量为4%时,反而能促进B.subtilis SP-8-5的生长(样品活菌数可高达4.85×109CFU/mL)。
2.2.3 感官评价
按表1体系感官评定结果表明,B.subtilis SP-8-5发酵效果最好,其总分值达20.8,具体表现为该发酵豆豉无论外观、气味、滋味还是总体接受度各方面的评定分值均为最佳。
2.3 盐含量对B.subtilis SP-8-5发酵豆豉的影响
2.3.1 盐添加量对豆豉纤溶酶活性影响
食盐浓度低于4%时,其纤溶酶活性随盐添加量增加而增强,当盐浓度大于4%时,其纤溶酶活性则呈负相关。B.subtilis SP-8-5菌株呈现很强耐盐性,食盐量为5%时,孵育24 h的纤溶直径仍达(1.37±0.02)cm,为该菌株空白对照的62%。
2.3.2 样品豆豉与市售豆豉比较
检测结果表明,试验菌株B.subtilis SP-8-5的发酵样品中活菌数为(8.5×1010~5.6×1011)CFU/g,纤溶直径则高达(2.21±0.02)cm,与9种市售豆豉比较结果见表3。B.subtilis SP-8-5发酵豆豉无论是活菌数还是纤溶酶活性均比云南常见市售豆豉高,而市售豆豉仅日本纳豆的活菌数及溶血栓能力较强外,其余表现均较差。综合考量各指标,遂将B.subtilis SP-8-5用作后续发酵制曲的种子菌种。
2.4 乳酸菌二次发酵对豆豉后发酵影响
2.4.1 乳酸菌对B.subtilis SP-8-5的抑制作用
应用spot-on-lawn法检测乳酸菌对B.subtilis SP-8-5抑制作用结果表明 (图 2),L.brevis GJ-1-3和L.plantarum YM-5-2对B.subtilis SP-8-5的生长均有抑制作用,L.brevis GJ-1-3的抑菌圈直径达2.89 cm(菌落直径0.65 cm,图3);而L.plantarum YM-5-2的抑制作用相对较弱(抑菌圈直径2.57 cm,菌落直径0.67 cm,图2)。因此,为保证使用B.subtilis SP-8-5初步发酵制曲品质,必需先使用B.subtilis SP-8-5进行充分发酵后,再接种乳酸菌进行二次发酵。

表3 B.subtilis SP-8-5发酵豆豉中活菌数及溶血栓能力与9种市售豆豉比较Table 3 The comparative results of living bacteria number and fibrinolytic enzyme activity between B.subtilis SP-8-5 fermented Douchi and nine commercial Douche

图2 乳酸菌对B.subtilis的抑菌作用Fig.2 The antibacterial function of lactic acid bacteria against B.subtilis SP-8-5
2.4.2 乳酸菌二次发酵对样品豆豉感官影响
按1.2.4.2实验设计,在B.subtilis SP-8-5发酵制曲的半成品中接种乳酸菌进行二次发酵,30℃静置发酵48 h后于4℃后酵48 h,即得成品豆豉。B.subtilis SP-8-5与L.plantarum YM-5-2混合发酵的豆豉按表2体系进行感官评价得分最高(15分),因为经L.plantarum YM-5-2二次发酵后,成品豆豉酯香味浓郁,能基本掩盖B.subtilis SP-8-5制曲过程中所产生的氨味,后续实验将以 B.subtilis SP-8-5与L.plantarum YM-5-2混合发酵为基础,进行豆豉两步固态发酵研究。
2.4.3 L.plantarum YM-5-2对豆豉后发酵影响
2.4.3.1 L.plantarum YM-5-2对豆豉样品活菌数、pH值及纤溶酶活性影响
L.plantarum YM-5-2对样品豆豉后发酵的动态监测结果见表4。随着后发酵时间延长,活菌数有所下降,B.subtilis SP-8-5的数量下降尤为明显(减少近6个数量级),而L.plantarum YM-5-2活菌数则是先升后降,然而下降幅度只有1个数量级。混合发酵时的pH值变化则与L.plantarum YM-5-2活菌数变化呈正相关,随着发酵早期菌体增加而逐渐酸化,后酵31天后,活菌数开始减少,酸度也逐渐降低,其pH值最终升至6.4。混合发酵时,样品豆豉的纤溶酶活性则随发酵时间延长而降低,然而混合发酵时,纤溶酶活性较B.subtilis SP-8-5单纯发酵时略有上升,综合考量各发酵指标,将 L.plantarum YM-5-2活菌数达(3.50±0.35)×1011CFU/g,B.subtilis SP-8-5活菌数达 (5.88±0.53)×108CFU/g,纤溶圈直径 (2.99±0.06)cm时(48 h孵育)的后酵时间21 d确定为混合发酵的后酵时间。

表4 L.plantarum YM-5-2对样品豆豉中活菌数、纤溶酶活性及pH值影响Table 4 Effects of L.plantarum YM -5-2 on living bacteria number,fibrinolytic enzyme activity and pH values of sample Douche
2.4.3.2 L.plantarum YM-5-2对样品中维生素含量影响
表5结果显示,发酵豆豉中几种重要维生素含量较原料豆有所增加,其中叶酸含量增加最为显著。混合发酵时,烟酸与VB5含量比B.subtilis SP-8-5单独发酵时高,叶酸与VB6含量则较低,由此可推测L.plantarum YM-5-2在一定程度上能抑制B.subtilis SP-8-5生物合成某些B族维生素。
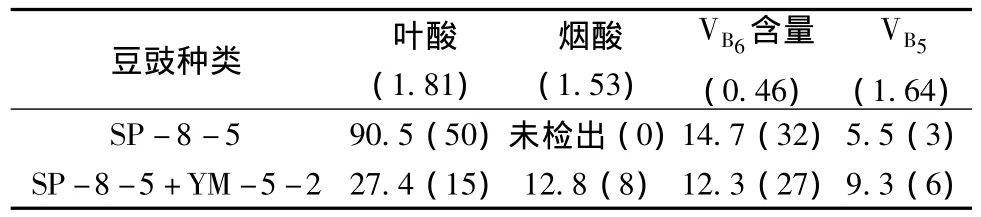
表5 两种发酵样品豆豉的维生素含量比较(mg/100 g)Table 5 Comparison of vitamin content between two fermented sample Douche
2.4.3.3 L.plantarum YM-5-2对豆豉货架期影响
将混合发酵豆豉于室温及4℃条件下进行实时追踪调查发现,样品豆豉在室温至少可以贮藏45 d,而在4℃则至少可以贮藏60 d;结合各项发酵指标,建议豆豉低温(4℃)贮藏,同时贮藏期限不宜超过60 d。
3 讨论
本研究运用从云南传统发酵豆豉中分离到的高纤溶活性菌株B.subtilis SP-8-5与产酸能力及抑菌效果均佳的L.plantarum YM-5-2进行两步固态发酵。为利于菌种附着发酵,将大豆按1∶3的比例(水豆质量比)室温(20℃)浸泡10 h,110℃蒸煮20 min,冷却至30℃时先接种B.subtilis SP-8-5,26℃发酵42 h,即得纤溶活性较高的豆豉曲,该发酵工艺与传统酿制工艺基本相似[16-19]。为提升风味,降低含盐量,保证品质并延长保质期,本研究在初步制曲后,添加L.plantarum YM-5-2进行二次发酵,在二次发酵过程中产生的大量芳香物质不仅能够掩饰枯草芽孢杆菌在制曲过程中产生的氨味,同时还能赋予豆豉浓郁的酱香味。此外,混合发酵过程中该植物乳杆菌还能通过产生乳酸、苯乳酸及细菌素等抑菌物质,对食源性致病菌发挥抑菌杀菌作用,从而能够在不添加任何化学防腐保鲜剂的情况下延长豆豉货架期,甚至利于实现低盐乃至无盐发酵。虽然经过L.plantarum YM-5-2的二次发酵,样品豆豉可在不添加任何食盐的条件下,室温贮藏45 d,4℃贮藏60 d,然而鉴于实际生产销售周期,有必要探讨长期保持豆豉纤溶酶活性及乳酸菌活菌数的发酵工艺,如能切实有效地解决该问题,将能大大提高功能性发酵豆豉的市场前景。
此外,随着人们对豆豉深入了解与认识,不仅仅满足于其风味,而且对其安全性及保健功效提出了更高要求。枯草芽孢杆菌因能产生豆豉纤溶酶而广泛用于豆豉发酵,乳酸菌则是一种有着重要生理功能的益生菌,因此被国际社会公认为食品安全级微生物并被广泛用于医疗保健及食品工业。本研究就是在充分考虑两种菌种各自优势的前提下,将二者有机结合开发出两步固态发酵法,通过该发酵工艺处理后,每克豆豉样品中枯草芽孢杆菌活菌数可高达109个数量级,而植物乳杆菌的活菌数更是高达(3.50±0.35)×1011CFU/g,是国内市售豆豉活菌数的数十倍乃至数百万倍。同时,L.plantarum YM-5-2具有极强的耐酸耐胆盐活性,因此该乳酸菌菌株进入人体后,能在肠道内有效定植,并通过产生大量乳酸与苯乳酸等有机酸来发挥维持肠道菌群平衡的作用。而B.subtilis SP-8-5则能通过分泌枯草菌素、多粘菌素、制霉菌素等活性物质来发挥维持肠道菌群平衡的作用。因此,相对市售豆豉而言,本研究所发酵的豆豉将有着巨大的市场发展前景。
[1] Sumi H,Nakajima N,Taya N.The method of determination of the thrombolytic enzyme nattokinase[J].Journal of the Brewing Society of Japan,1993,88(6):482-486.
[2] Teran F R,Owens J D.Chemical and enzymatic changes during the fermentation of bacteria-free soya bean tempeh[J].Journal of the Science of Food and Agriculture,1996,(71):523-530.
[3] Liu Chen-jian,Gong Fu-ming,Li Xiao-ran,et al.Natural population of lactic acid bacteria from douchi in Yunnan Province of China[J].Journal of Zhejiang University-Science B(Biomedicine& Biotechnology),2012,13(4):298-306(in English).
[4] 孙森,宋俊梅,曲静然.豆豉后发酵过程中微生物菌相的变化[J].中国食品添加剂,2008(2):138-143.
[5] 张刚.乳酸细菌-基础、技术和应用[M].北京:化学工业出版社,2007.
[6] Astrup T,Mullertz S.The fibrin plate method for estimating fibrinolytic activity[J].Archives of Biochemistry and Biophysics,1952,40(2):346-351.
[7] Fujita M,Nomura K,Hong K,et al.Purification and characterization of a strong fibrinolytic enzyme(nattokinase)in the vegetable cheese natto,a popular soybean fermented food in Japan[J].Biochemical and Biophysical Research Communications,1993,197(3):1 340-1 347.
[8] Suzuki Y,Kondo K,Matsumoto Y,et al.Dietary supplementation of fermented soybean,natto,suppresses intimal thickening and modulates the lysis of mural thrombi after endothelial injury in rat femoral artery[J].Life Sciences,2003,73(10):1 289-1 298.
[9] Sszuki Y,Kondo K,Ichise H,et al.Dietary supplementation with fermented soybeans suppresses intimal thickening[J].Nutrition,2003,19(3):261-264.
[10] 庞庆芳,张炳文,刘晓婷,等.豆豉溶栓酶溶栓作用的初步研究[J].营养学报,2007(2):195-196.
[11] 张炳文,庞庆芳,孙超.对中国传统细菌型豆豉溶栓酶酶学性质的研究[J].中国调味品,2008(12):45-49.
[12] 张建华.曲霉型豆豉发酵机理及其功能性的研究:[D].北京:中国农业大学,2003.
[13] 金建玲,张为灿,李瑜,等.大豆氧化物酶-过氧化氢-碘化钾体系杀菌作用[J].微生物学报,2011,51(3):393-401.
[14] Li Z,Nimtz M,Rinas U.Optimized procedure to generate heavy isotope and selenomethionine-labeled proteins for structure determination using Escherichia coli-based expression systems[J].Applied Microbiology and Biotechnology,2011,92(4):823-833.
[15] Van Ditmarsch D,Xavier J B.High-resolution time series of Pseudomonas aeruginosa gene expression and rhamnolipid secretion through growth curve synchronization[J].BMC Microbiology,2011,11:140.
[16] 庞庆芳,张炳文,孙爱东.中国传统大豆发酵食品-豆豉功能成分的研究进展[J].食品研究与开发,2006,27(2):185-187.
[17] 杜木英,闵健全.豆豉多菌种发酵工艺研究[J].西南农业大学学报,1999,21(4):364-366.
[18] 张发柱.我国古代制豆豉方法资料辑要[J].调味副食品科技,1981(1):21-24.
[19] 高庆明.浏阳豆豉产销史略考[J].中国调味品,1984(6):9-12.

