基于mtCOII基因对山东省越冬代亚洲玉米螟不同种群的遗传结构分析
李丽莉,于 毅,国 栋,陶云荔,褚 栋,*
(1.山东省农业科学院植保所,山东省植物病毒学重点实验室,济南 250100;2.青岛农业大学农学与植物保护学院,山东省植物病虫害综合防控重点实验室,青岛 266109)
亚洲玉米螟Ostriniafurnacalis(Guenée)是我国玉米上的重要害虫,它可在玉米的不同生育期危害,严重影响玉米的产量和质量[1]。该害虫具有较广的地理分布[2]和寄主范围[3]。近年来,随着全球气候变暖以及玉米种植面积的扩大,其发生危害有不断加重的趋势[4]。
亚洲玉米螟不同种群遗传结构分析对于该害虫的演化、迁飞以及综合治理等具有重要的意义[2]。目前,分子标记广泛应用于物种的遗传分化研究中[5]。线粒体COII基因(mtCOII)在昆虫种群遗传学研究中常作为分析地理种群系统发育关系的分子工具[6]。前人利用mtCOII基因分别对日本与中国的亚洲玉米螟不同种群进行遗传分化分析的结果表明,日本与中国的亚洲玉米螟种群分别具有2个遗传支系[2,7]。其中,李菁等[2]对1个山东省种群进行了遗传分化分析,结果表明属于其中1个支系。山东省是我国玉米的重要产区之一,又是黄淮海地区的主要粮食生产地,所处的地理位置特殊,种植结构复杂多样,全省各地亚洲玉米螟的发生危害程度也有很大的不同[8]。因此,有必要进一步扩大采集范围,全面揭示山东省越冬代亚洲玉米螟种群的遗传分化。此外,中国、日本的亚洲玉米螟种群分化支系[2,7]之间的关系尚未清楚,山东省亚洲玉米螟种群与上述结果中不同分化种群[2,7]之间的关系尚需进一步解析。不同的分化种群往往对环境具有不同的适应能力[9-10],因此,明确山东省不同地理种群的亚洲玉米螟遗传分化地位对于该害虫的综合防控具有重要的理论意义与实践价值,并将促进我国亚洲玉米螟分子系统学的深入研究。
为了全面揭示亚洲玉米螟尤其是山东省亚洲玉米螟不同种群的遗传结构,本研究对山东省9个地区17个亚洲玉米螟种群的mtCOII序列进行了测序分析,获得126条mtCOII基因序列;结合GenBank上所有国内外亚洲玉米螟已有mtCOII序列,进一步解析了国内外亚洲玉米螟不同地理种群的系统进化关系;分析了山东省不同地理种群的遗传多样性;构建了利用mtCOII基因PCR-RFLP标记来快速鉴别亚洲玉米螟遗传支系的方法。
1 材料与方法
1.1 供试昆虫
亚洲玉米螟种群样品于2004年10—11月采集自山东省9个地区的17个地点,采集带虫的玉米秸秆、穗轴放置室外自然条件下越冬,待第2年化蛹后取单头蛹置于离心管中,-20 ℃保存至DNA提取。详细情况见表1。
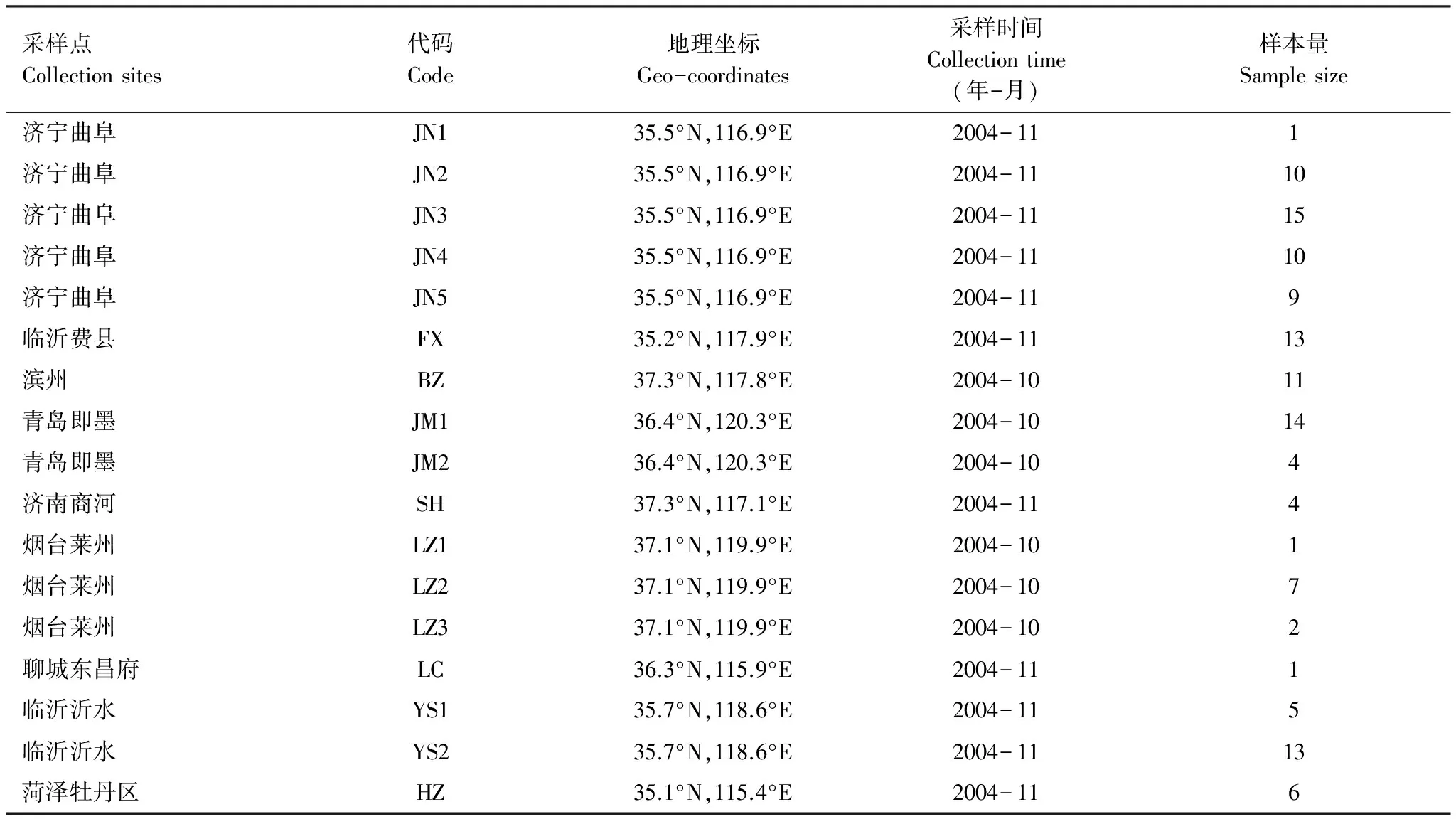
表1 山东省亚洲玉米螟不同种群样品的采集情况
1.2 单头玉米螟DNA提取、PCR反应条件及电泳检测
单头玉米螟DNA提取采用DNA提取试剂盒(天根生化科技),具体步骤按说明书进行。mtCOIIPCR反应体系及反应程序参照李菁等[2]。取5 μL PCR产物经1.0%琼脂糖凝胶(含EB)电泳后,紫外灯下成像检测。选取有条带的个体进行5′端单向测序。
1.3 数据处理与统计分析
利用MEGA5.05[11]软件将测序得到的序列进行多序列同源比对。采用软件DnaSP 5.0[12]分析了单倍体型的数量,计算了山东省亚洲玉米螟不同采集种群(个体数量不少于3个)的多样性指数:多态位点的个数(S);突变位点(η);单倍体型数量(H);核苷酸多态性(π);平均核苷酸差异(K);Jukes和Cantor校正π值(π(JC))。利用MEGA5.05[11]软件,采用邻接法(NJ)以家蚕和桃小食心虫的mtCOII基因(GenBank登录号分别为AB083339、HM156482)为外群,分别以最大似然法(ML)与邻位法(NJ)构建所有亚洲玉米螟mtCOII基因单倍体型的系统树。利用Arlequin3.11[13]软件进行分子变异(AMOVA)分析。
1.4 亚洲玉米螟2个支系mtCOII酶切位点分析以及PCR-RFLP鉴别方法构建
利用酶切位点在线查询(http://watcut.uwaterloo.ca/watcut/watcut/template.php?act= restriction _ new)对2个支系所有单倍体型进行了酶切位点分析。取5 μL的PCR产物加入1 μL内切酶PspFI(酶切位点为CCCAGC)以及2 μL的10×Buffer,用双蒸水补足至20 μL。37 ℃消化5 min,80 ℃反应5 min终止反应,取5 μL酶切产物经1.5%琼脂糖凝胶(含EB),100 V电压电泳20 min后紫外灯下成像拍照。
2 结果与分析
2.1 亚洲玉米螟mtCOII基因单倍体型分析
对GenBank检索以及本研究测序获得的mtCOII进行比对处理后,片段长度为656 bp。通过GenBank检索获得亚洲玉米螟的mtCOII基因214条(截止2011年10月1日数据)。对上述214条序列通过DnaSP 5.0[12]分析得到56条单倍体型(编号为Hap1—Hap56)(表2)。本实验中获得126条mtCOII基因的部分序列,共有20个单倍体型,其中14个单倍体型能够在GenBank中发现相应序列;有6种单倍体型为山东种群所特有(表3)。
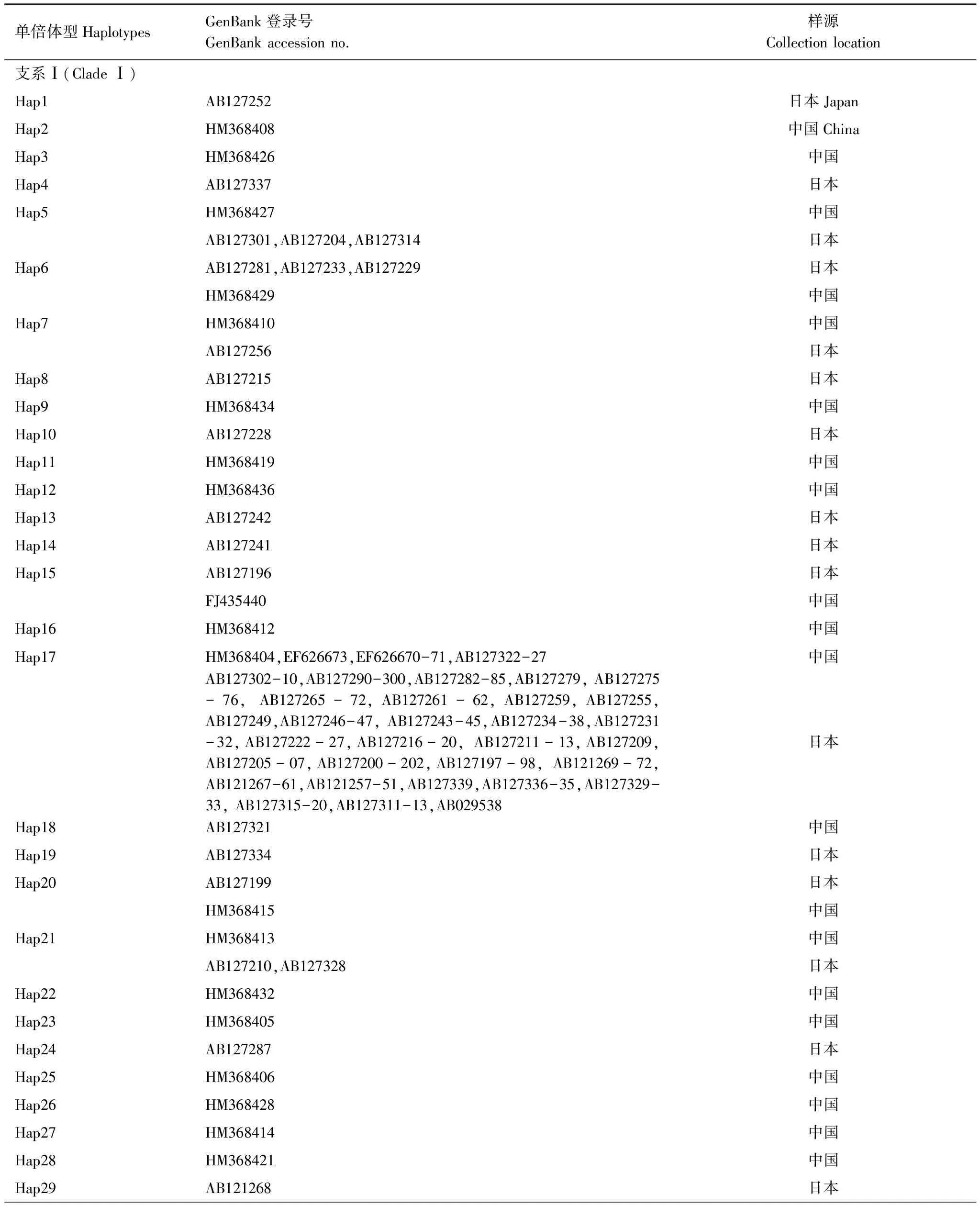
表2 GenBank中亚洲玉米螟mtCOII单倍体型分布情况
续表
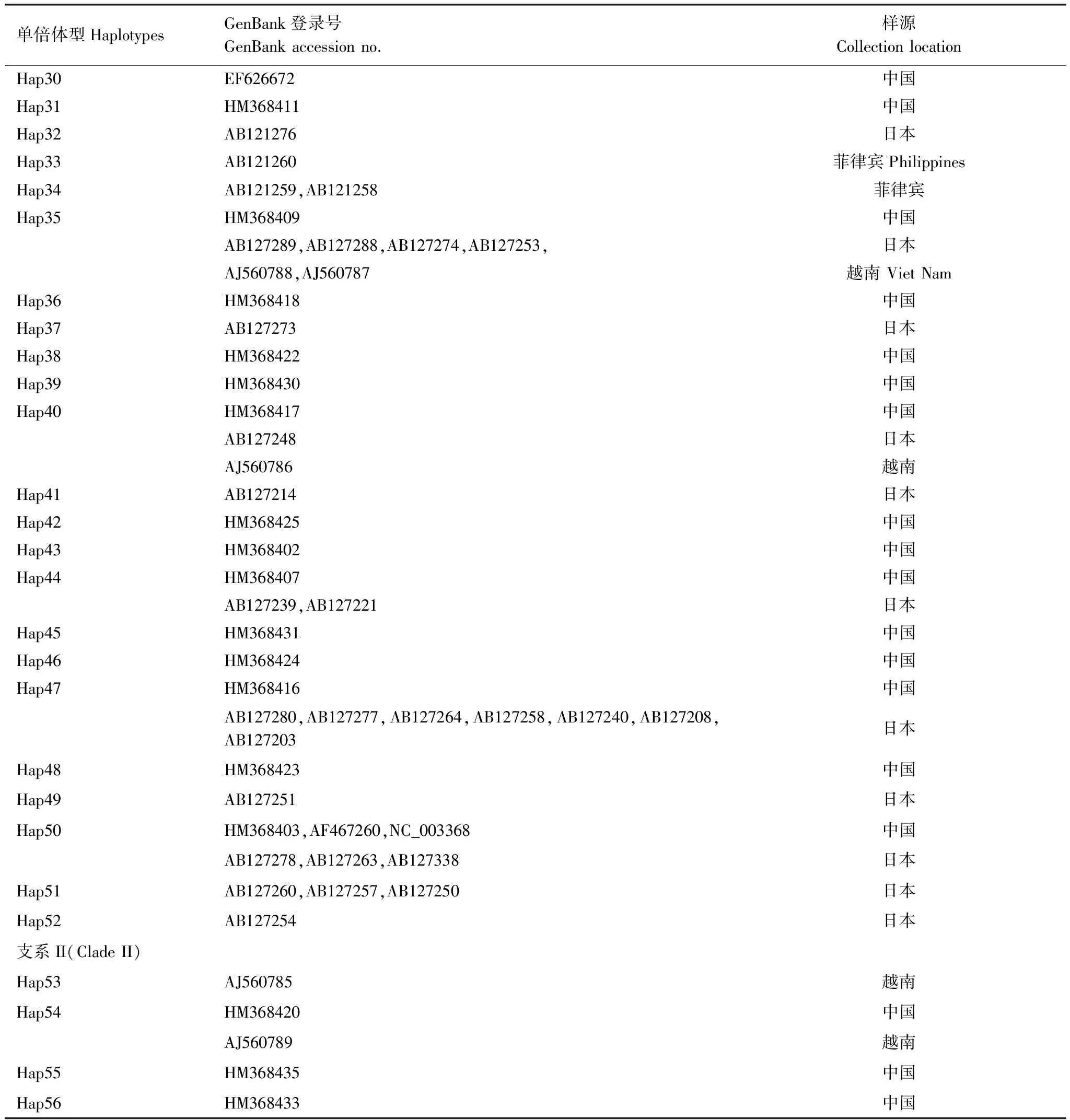
单倍体型HaplotypesGenBank登录号GenBankaccessionno.样源CollectionlocationHap30EF626672中国Hap31HM368411中国Hap32AB121276日本Hap33AB121260菲律宾PhilippinesHap34AB121259,AB121258菲律宾Hap35HM368409中国AB127289,AB127288,AB127274,AB127253,日本AJ560788,AJ560787越南VietNamHap36HM368418中国Hap37AB127273日本Hap38HM368422中国Hap39HM368430中国Hap40HM368417中国AB127248日本AJ560786越南Hap41AB127214日本Hap42HM368425中国Hap43HM368402中国Hap44HM368407中国AB127239,AB127221日本Hap45HM368431中国Hap46HM368424中国Hap47HM368416中国AB127280,AB127277,AB127264,AB127258,AB127240,AB127208,AB127203日本Hap48HM368423中国Hap49AB127251日本Hap50HM368403,AF467260,NC_003368中国AB127278,AB127263,AB127338日本Hap51AB127260,AB127257,AB127250日本Hap52AB127254日本支系II(CladeII)Hap53AJ560785越南Hap54HM368420中国AJ560789越南Hap55HM368435中国Hap56HM368433中国
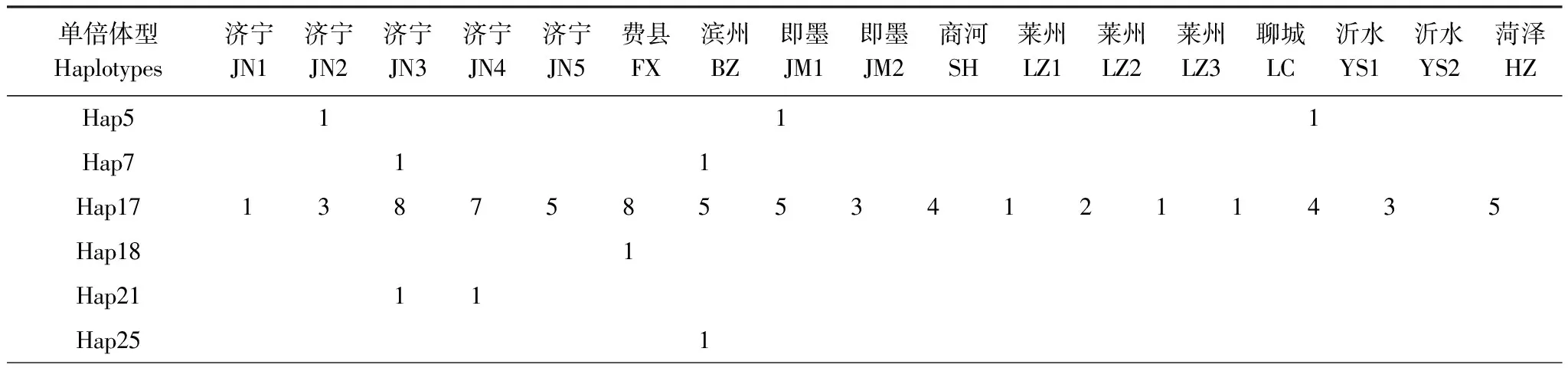
表3 本研究中山东省亚洲玉米螟mtCOII单倍体型分布情况
续表
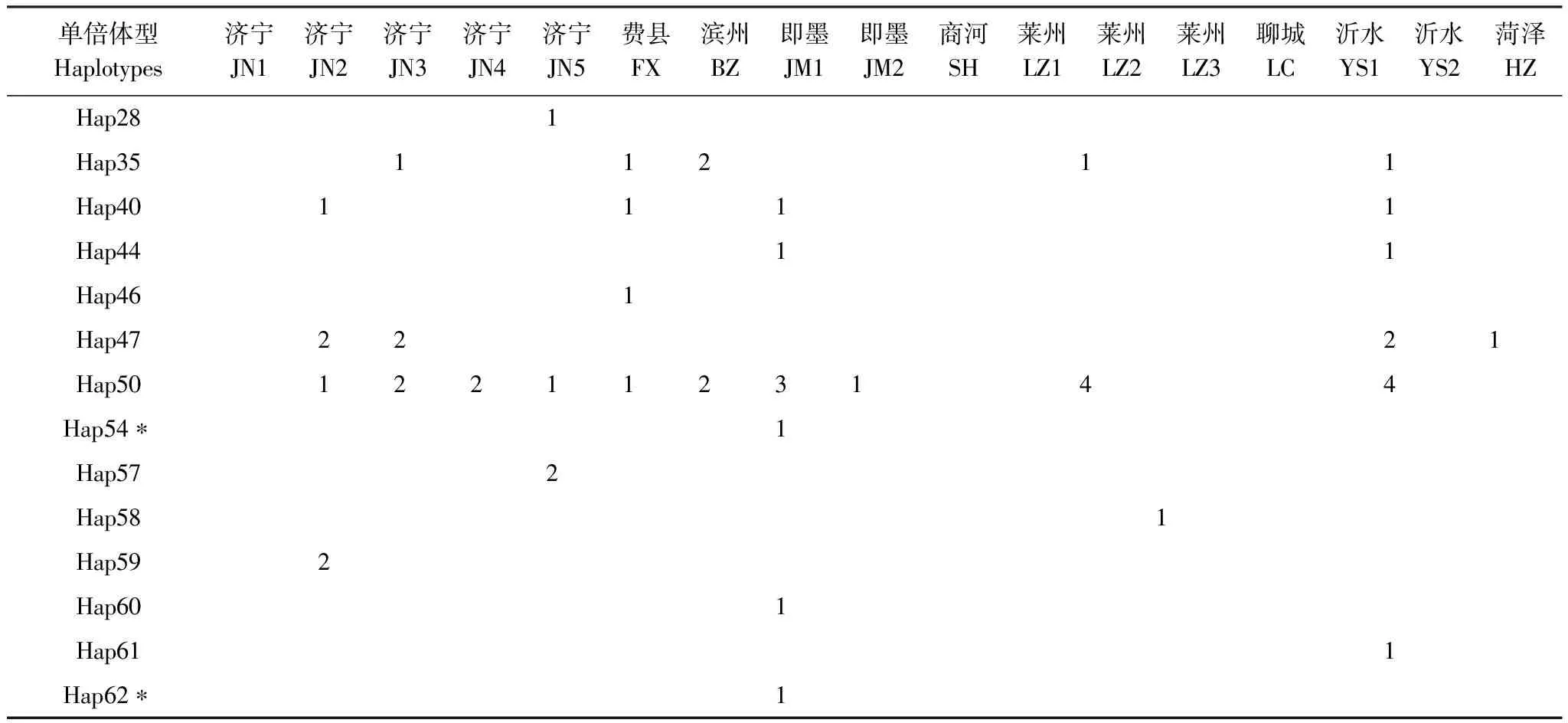
单倍体型Haplotypes济宁JN1济宁JN2济宁JN3济宁JN4济宁JN5费县FX滨州BZ即墨JM1即墨JM2商河SH莱州LZ1莱州LZ2莱州LZ3聊城LC沂水YS1沂水YS2菏泽HZHap281Hap3511211Hap401111Hap4411Hap461Hap472221Hap501221123144Hap54∗1Hap572Hap581Hap592Hap601Hap611Hap62∗1
*属于支系Ⅱ;Grouped into Clade Ⅱ
2.2 mtCOII基因单倍体型系统进化关系分析
对上述亚洲玉米螟mtCOII基因62种单倍体型以最大似然法(ML)构建的系统树(图1;仅显示置信值(Bootstrap)大于50%的分支)表明,所有单倍体型共分为2个支系。其中,57个单倍体型单独聚为一支(置信值为58%);5个单倍体型单独聚为一支(置信值为95%)。邻位法(NJ)(结果未显示)构建的系统树与最大似然法(ML)构建的系统树类似,也分为2个支系。
本实验中只有山东省的JM1种群(即墨)中的2个个体(分别编号为Hap54、Hap62单倍体型)位于第2支系(Clade Ⅱ),山东其他种群均属于第1支系(Clade Ⅰ)。
2.3 山东省亚洲玉米螟不同地理种群遗传多样性分析
基于mtCOII基因对山东省不同种群遗传多样性分析如表4所示。由表4可以看出,所测的玉米螟种群的遗传多样性均较高,例如总体单倍体型多样性指数Hd为0.695;种群内单倍体型多样性指数为0.333—0.889,平均为0.611,其中单倍体型多样度最高的种群为JN2(济宁)种群,最低的为HZ(菏泽)种群。AMOVA分析结果显示(表5),山东省亚洲玉米螟2个支系之间的方差组分为4.78994,占方差比率的79.42%;2个支系之间的方差组分为1.24116,占方差比率的20.58%;这说明山东亚洲玉米螟的遗传变异主要来自2个支系之间,支系间的遗传差异达到极显著水平(P<0.0001)。

表4 基于mtCOII序列对山东省亚洲玉米螟不同种群的遗传多样性分析
续表
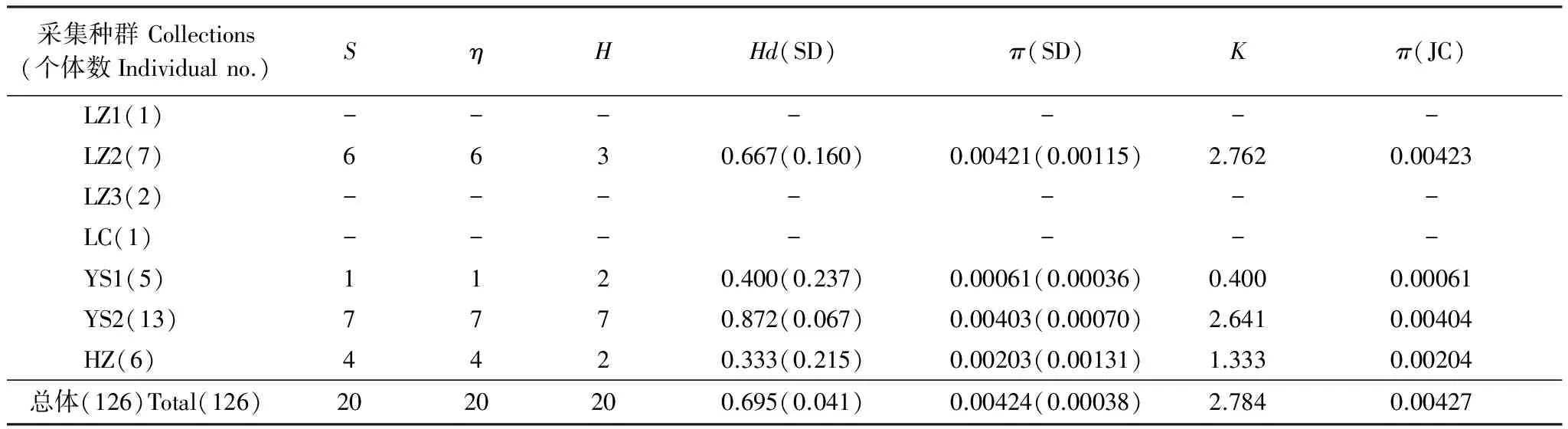
采集种群Collections(个体数Individualno.)SηHHd(SD)π(SD)Kπ(JC)LZ1(1)-------LZ2(7)6630.667(0.160)0.00421(0.00115)2.7620.00423LZ3(2)-------LC(1)-------YS1(5)1120.400(0.237)0.00061(0.00036)0.4000.00061YS2(13)7770.872(0.067)0.00403(0.00070)2.6410.00404HZ(6)4420.333(0.215)0.00203(0.00131)1.3330.00204总体(126)Total(126)2020200.695(0.041)0.00424(0.00038)2.7840.00427
S: 多态位点的个数number of polymorphic(segregating)sites;η: 总的突变位点total number of mutations;H: 单倍体型数量number of haplotypes;Hd: 单倍体型多态性Haplotype diversity;π: 核酸多样性nucleotide diversity;K: 平均核苷酸差异average number of nucleotide differences;π(JC): Jukes 和 Cantor校正的π值;-:未计算

图1 利用最大似然法(ML)构建的亚洲玉米螟不同地理种群COII单倍体型间的系统树
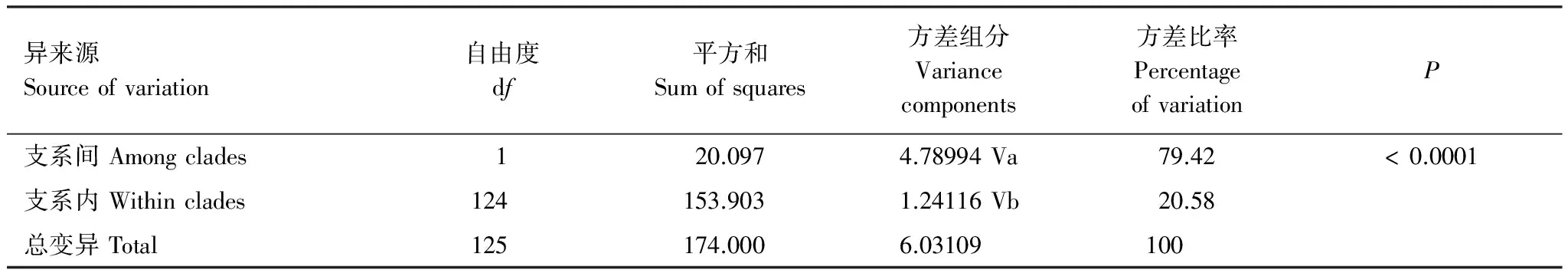
表5 亚洲玉米螟不同支系线粒体基因COII的分子变异分析
固定系数 Fixation index,Fst: 0.79421
2.4 基于PCR-RFLP方法鉴别亚洲玉米螟2个支系

图2 亚洲玉米螟支系Ⅱ的mtCOII基因序列中PspFI酶切位点位置
利用酶切位点在线查询的方法,发现PspFI内切酶(酶切位点为CCCAGC)仅存在于支系Ⅱ中,而支系Ⅰ中不存在该酶切位点(图2)。由AF467260、NC_003368可知,PCR产物片段长度824 bp,酶切位点位于320 bp左右,因此可以推测酶切片段为500 bp与300 bp左右。本研究表明通过PspFI内切酶对山东省支系Ⅰ及支系Ⅱ亚洲玉米螟扩增mtCOII基因PCR产物酶切显示,支系Ⅱ中JM1种群的2个个体酶切后有3条带(分别约800 bp、500 bp、300 bp),其他支系I种群个体只有1条带(约800 bp)(图3)。
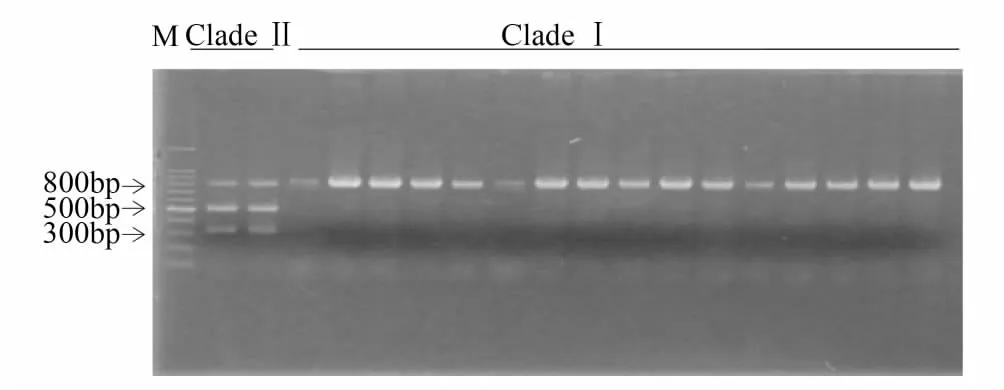
图3 亚洲玉米螟支系Ⅰ与Ⅱ的mtCOII酶切结果
3 讨论
Hoshizaki等[7]基于mtCOII基因发现日本的亚洲玉米螟分为2个支系(支系A和B),其中支系A在日本分布广泛,占绝对优势,在对日本16个采样种群检测中有15个点均含有支系A;在被检测的中国样品中仅发现了支系A;在菲律宾仅发现支系B个体。李菁等[2]利用mtCOII基因发现中国17个地理种群的亚洲玉米螟也存在2个较大的支系。本研究对目前全球亚洲玉米螟分析结果表明:全球的亚洲玉米螟具有2个遗传支系(Clade Ⅰ和Clade Ⅱ),与李菁等[2]结果是一致的;而Hoshizaki等[7]中的支系A和B均在支系Ⅰ(Clade Ⅰ)中,没有明显的遗传分化。近来研究表明,很多物种存在遗传分化,这些分化种群往往对环境的适应能力不同[9-10]。例如Brunner等[14]研究发现,西花蓟马2个遗传支系(G型和L型)对生存环境的适应性存在很大的差异,G型常生活于高温干燥(hot-dry)地区,L型大都生活在低温潮湿(cool-moist)地区。李菁等[2]与本文的研究表明,亚洲玉米螟支系Ⅱ的个体比例较低,这些数据提示不同支系内亚洲玉米螟的生物学、生态学及生理学方面可能存在差异,进而影响该害虫种群的地理分布及其扩散。这些问题有待于进一步研究,相关研究结果对于该害虫的可持续控制具有重要的指导价值。
李菁等[2]研究中分析的山东省亚洲玉米螟种群(1个种群)属于支系Ⅰ(Clade Ⅰ)。本研究中发现山东省亚洲玉米螟单倍体型分布于支系Ⅰ与支系Ⅱ。这表明,样品的数量增加可以发现更多的具有遗传分化的个体。尽管如此,本研究中发现的支系Ⅱ个体在山东省所有样品中的比例很低(1.9%)。同时,这些单倍体型在山东省的分布缺乏明显的地理分布格局,与全国分布格局类似[2]。本研究发现,山东省亚洲玉米螟mtCOII基因存在丰富的单倍体型(20个);在山东省,亚洲玉米螟种群Hd(0.333—0.889)与全国其他种群Hd(0.424—0.862)相似[2]。山东省总群体的单倍体型多样性指数Hd为0.695,略低于全国水平(0.811)[2]。上述结果表明山东省亚洲玉米螟种群线粒体基因具有较高的多态性。其中,JM1(即墨)种群具有较高的遗传多样性,具有多种可能性,尚需进一步的分析。
PspFI内切酶(酶切位点为CCCAGC)对支系Ⅰ与Ⅱ的亚洲玉米螟mtCOII基因的PCR产物酶切结果表明,该酶能够有效鉴别2个支系:支系Ⅱ(JM1种群的2个个体)有3条带(分别约800 bp、500 bp、300 bp),支系Ⅰ个体只有1条带(约800 bp)。然而根据序列分析,支系Ⅱ(JM1种群的2个个体)PCR产物应该被切成2条带(分别约为500 bp、300 bp),而本研究中尚有PCR产物(约800 bp)不能完全切开,其原因有待于进一步分析。尽管如此,利用PspFI内切酶消化mtCOII基因的PCR-RFLP快速鉴别技术为亚洲玉米螟2支系的生物学及生态学进一步研究奠定了基础。
致谢: 美国斯坦福大学Daniel Thomas Rogan帮助修改英文摘要,特此致谢。
[1]Zhou D Y, He K L. Asian Corn Borer and Its Integrated Management. Beijing: Golden Shield Press, 1995: 1-102.
[2]Li J, Zhang Y, Wang Z Y, He K L, Wang Q. Genetic differentiation and gene flow among different geographical populations of the Asian corn borerOstriniafurnacalis(Guenée) (Lepidoptera Crambidae) in China estimated by mitochondrialCOIIgene sequences. Acta Entomologica Sinica, 2010, 53(10): 1135-1143.
[3]Wang Z Y, Lu X, He K L, Zhou D R. Review of history, precent situation and prospect of the Asian maize borer research in China. Journal of Shenyang Agricultural University, 2000, 31(5): 402-412.
[4]The Ministry of Agriculture. Control scheme of corn borer in 2008. Rural Practical Technology, 2008, (5): 1-37.
[5]Chu D, Zhang Y J, Wan F H. Application of molecular marker techniques in invasion ecology. Chinese Journal of Applied Ecology, 2007, 18(6): 1383-1387.
[6]Bu Y, Zheng Z M. Roles and status of cytochrome oxidase II gene in the research of insect molecular systematics. Entomological Knowledge, 2005, 42(1): 18-22.
[7]Hoshizaki S, Washimori R, Kubota S, Ohno S, Huang Y, Tatsuki S, Ishikawa Y. Two mitochondrial lineages occur in the Asian corn borer,Ostriniafurnacalis(Lepidoptera: Crambidae), in Japan. Bulletin of Entomological Research, 2008, 98(5): 519-526.
[8]Li L L, Yu Y, Zhang A S, Zhang S C, Men X Y, Zhang J J. Investigation on the species of overwintering maize pests and parasitoids of over wintering Asian corn borer larvae in Shandong Province. Joumal of Shandong Agricultural Science, 2009, (2): 75-77.
[9]Scheffer S J, Lewis M L. Mitochondrial phylogeography of vegetable pestLiriomyzasativae(Diptera: Agromyzidae): divergent clades and invasive populations. Annals of the Entomological Society of America, 2005, 98(2): 181-186.
[10]Winkler G, Dodson J J, Lee C E. Heterogeneity within the native range: population genetic analyses of sympatric invasive and noninvasive populations of the freshwater invading copepodEurytemoraaffinis. Molecular Ecology, 2008, 17(1): 415-430.
[11]Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011. doi: 10.1093/molbev/msr121.
[12]Librado P, Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data. Bioinformatics, 2009, 25(11): 1451-1452.
[13]Excoffier LG, Laval S, Schneider S. Arlequin ver 3.0: an integrated software package for population genetics data analysis. Evol Bioinformatics, 2005, 1:47-50.
[14]Brunner P C, Frey J E. Habitat-specific population structure in native western flower thripsFrankliniellaoccidentalis(Insecta, Thysanoptera). Journal of Evolutionary Biology, 2010, 23(4): 797-804.
参考文献:
[1]周大荣, 何康来. 玉米螟综合防治. 北京: 金盾出版社, 1995: 1-102.
[2]李菁, 张颖, 王振营, 何康来, 王强. 基于线粒体DNACOII基因的亚洲玉米螟中国不同地理种群遗传分化及基因流研究. 昆虫学报, 2010, 53(10): 1135-1143.
[3]王振营, 鲁新, 何康来, 周大荣. 我国研究亚洲玉米螟历史、现状与展望. 沈阳农业大学学报, 2000, 31(5): 402-412.
[4]农业部. 2008年玉米螟防治方案. 农村实用技术, 2008, (5): 1-37.
[5]褚栋, 张友军, 万方浩. 分子标记技术在入侵生态学研究中的应用. 应用生态学报, 2007, 18(6): 1383-1387.
[6]卜云, 郑哲民. COII基因在昆虫分子系统学研究中的作用和地位. 昆虫知识, 2005, 42(1): 18-22.
[8]李丽莉, 于毅, 张安盛, 张思聪. 山东省玉米越冬害虫种类及亚洲玉米螟越冬幼虫寄生性天敌调查. 山东农业科学, 2009, (2): 75-77.
——以云南墨江自治县为例

