淹水胁迫对乌桕幼苗生长及根系无氧呼吸酶活性的影响
蔡金峰,曹福亮,张往祥
(南京林业大学 森林资源与环境学院,江苏 南京 210037)
淹水胁迫对乌桕幼苗生长及根系无氧呼吸酶活性的影响
蔡金峰,曹福亮,张往祥
(南京林业大学 森林资源与环境学院,江苏 南京 210037)
为研究乌桕的耐涝机制,采用盆栽模拟涝渍环境的实验方法,研究了淹水胁迫对2个乌桕种源1年生实生苗的生长和根系无氧呼吸酶的影响。结果表明:淹水胁迫抑制了浙江种源的高生长和生物量的累积,而福建种源全部死亡,浙江种源较福建种源耐涝性强;淹水胁迫下,浙江种源乙醇脱氢酶和乳酸脱氢酶显著增加,且一直保持在较高水平;耐涝性差的福建种源乙醇脱氢酶显著低于对照,渍水和淹水处理10 d时,乳酸脱氢酶活性分别为对照的4.67倍和4.14倍,然后急剧下降。耐涝性强的种源能够通过自身的调节,维持一定的无氧呼吸代谢途径的强度,为植株的生长提供能量,从而维持一定的生长量。
乌桕; 淹水胁迫; 幼苗生长; 无氧呼吸酶
水分是决定植物生态系统生产率的首要因素,水分过多或过少对植物生长都不利[1]。在降水量大、土壤通透性差和水位波动较大的地区,常常会发生淹水胁迫,对植物的形态和代谢会产生显著影响,导致植物生长受到抑制[2-3]。
土壤淹水造成土壤中氧气偏少,形成厌氧环境,抑制了线粒体的呼吸作用,根系启动无氧呼吸,乳酸脱氢酶(LDH)、乙醇脱氢酶(ADH)和丙酮酸脱羧酶(PDC)活性升高,促进乳酸发酵和乙醇发酵,以促进NAD+再生和维持适当的能荷水平ATP的生成[4]。目前,有关淹水胁迫对林木根系能量代谢酶的影响研究较少,主要集中在黄瓜[5]、水稻[6]、烟草[7]等农作物上。
我国拥有1.8万km的海岸线、众多的河流和面积广阔的大型湖泊,形成了数千公顷的低湿地、季节性积水地[8]。但由于缺乏耐涝性强的种植材料,使得这些地区大部分处于荒芜或半荒芜状态。因此,选育耐水湿的树种,对于这些地区的开发利用以及生态的保护和恢复具有重要的理论和实践意义。
乌桕Sapium sebiferum是我国重要的经济树种,种子可榨取桕脂和桕油;乌桕属速生树种,其木材质地坚、韧、细致,用途广泛;乌桕性凉,味苦,叶、根、皮均可入药,清热解毒,消肿,通便;根、皮、叶及木材的浸出液可作杀虫剂[9],乌桕树冠优美,季相变化丰富, 园林用途广泛[10]。有研究发现,乌桕喜湿润气候环境,能够忍受较长时期的浸泡[11]。Robert等[12]研究了淹水对乌桕苗木生长的影响,认为乌桕耐水的原因是其在淹水胁迫下具有三大形态特征:肥厚的皮孔、不定根的形成和厚的吸收根的产生;Conner等[13]发现乌桕在盐淹胁迫下可以存活6周,在较低盐浓度的胁迫下,并在第2年可以恢复生长,因此乌桕可以作为沿海滩涂或湿地的造林树种;李冬林等[14]利用隶属函数法,对不同种源乌桕对海水浸淹的耐性差异进行了研究。
本研究以2个种源乌桕幼苗为试材,测定淹水胁迫下乌桕幼苗苗高、地径、生物量以及乌桕根系无氧呼吸酶活性,分析淹水胁迫对乌桕幼苗生长、根系代谢状况的影响,对于进一步阐明乌桕的耐涝机理具有重要的理论意义,同时也为乌桕在园林绿化及低湿地等的定向栽培提供理论依据。
1 材料与方法
1.1 试验材料与试验设计
试验材料为1年生乌桕实生苗,分别来自浙江兰溪和福建漳浦。
选择生长相对一致的苗木于2月份进行盆栽(盆口径30 cm,高30 cm),每盆2棵。定植后平茬,生长期间正常管理。6月下旬,挑选生长相对一致的苗木进行淹水处理,将盆放在水槽里,水槽根据设计注水,设3个处理水平:CK水平,土壤含水量为田间持水量的75%左右,这是木本植物生长的最佳含水量,在本试验中作为对照处理;WA水平,土壤含水量完全饱和,模拟自然状态下水渍危害;FL水平,水面高于土面4 cm左右,模拟淹水胁迫。每处理20盆,采用完全随机试验设计。
1.2 测定方法
1.2.1 苗高、地径的测定
在淹水处理第0、10、20、30、40、50 天分别用卷尺和游标卡尺测定苗高和地径。
1.2.2 生物量的测定
淹水处理之前和结束时各测1次。每个处理选取6株(3盆)苗木,用流水将根部泥沙冲洗干净,分为根、茎、叶3部分放入80℃烘箱中烘干至恒质量。生物量增量为试验结束后生物量与试验前生物量之差;根冠比为地下部分生物量与地上部分生物量的比值;相对生长率为生物量增量与试验前生物量的比值乘以100%。
1.2.3 ADH和LDH活性的测定
分别在处理后10、20、30、40和50 d,每个处理选取4株(2盆),完整取出,用水冲洗干净,取根系中部进行无氧呼吸酶的测定,每个处理重复3次。
乙醇脱氢酶(ADH)和乳酸脱氢酶(LDH)活性测定参照Mustroph和Albrecht[15]的方法。以OD340每分钟底物减少1 μmol为一个酶活单位,酶活性以U·g-1表示。
2 结果与分析
2.1 淹水胁迫对乌桕生长的影响
2.1.1 淹水胁迫对乌桕苗高的影响
由图1可知,WA和FL处理显著影响了乌桕幼苗苗高生长(p<0.05)。与对照相比,WA和FL处理下苗高均显著降低,但浙江种源在处理的早期高生长受到的影响较小,直到处理30 d后,生长速度才明显减慢;福建种源在淹水胁迫下高生长则受到显著抑制,胁迫至15~20 d时,生长几乎停滞,至24 d时,FL处理全部死亡,至45 d时,WA处理所有植株死亡。淹水胁迫结束或植株死亡时,浙江种源在各处理下相对生长速率分别为91.16%、71.79%和68.83%,福建种源为116.89%、62.78%和30.83%。
2.1.2 淹水胁迫对乌桕地径的影响
由图2可知,与对照相比,WA和FL处理均显著地促进了浙江种源地径的生长,但WA和FL处理间无显著差异;淹水胁迫则显著抑制了福建种源地径的生长,WA条件下,至处理30 d时地径几乎停止生长,在处理的末期,植株全部死亡,韧皮部和皮层出现腐烂现象。淹水胁迫结束或植株死亡时,浙江种源在各处理下地径相对生长速率分别为80.54%、110.07%和117.87%,福建种源为125.29%、38.75%和11.55%。
2.1.3 淹水胁迫对乌桕生物量及生物量分配的影响
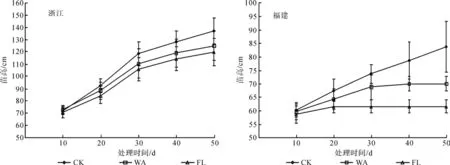
图1 淹水胁迫对苗高的影响Fig.1 Effects of water-logging stress on shoot height

图2 淹水胁迫对地径的影响Fig.2 Effects of water-logging stress on stem basal
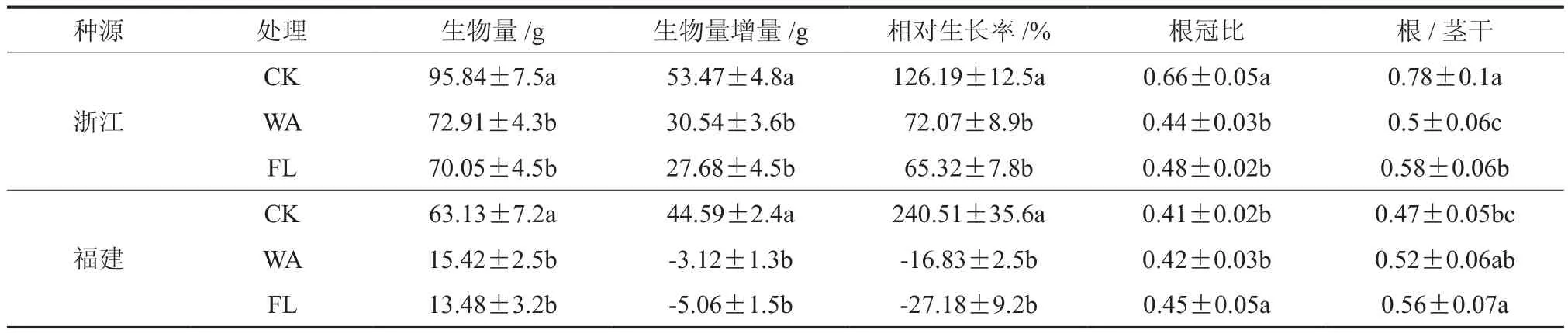
表1 淹水胁迫处理50 d后不同种源乌桕的生物量、生物量增量和根冠比(平均值±标准偏差)†Table 1 Biomass, biomass increment and root shoot ratio after treated 50 days (mean±SD)
由表1可以看出,处理50 d后,WA和FL处理显著影响了2个种源乌桕的生物量(F=12.06,p< 0.05;F=89.05,p< 0.05)和生物量增 量(F=42.36,p<0.05;F=170.45,p<0.05)。与对照相比,WA和FL处理的浙江种源生物量分别下降了23.93%和26.91%,生物量增量分别下降了42.88%和48.23%;福建种源在WA处理下,生物量明显低于对照,分别下降了75.57%和78.77%,在FL处理下,生物量增长量和相对生长率出现负值,可能是绝大部分的初生根系已经腐烂,且苗木落叶严重。
由表1还可以看出,与对照相比,WA和FL处理下,浙江种源根冠比分别降低了33.33%和27.27%;而福建种源根冠比分别比对照增加了2.44%和9.76%。
通过对不同淹水胁迫下2个种源苗高、地径及生物量生长的比较可知,浙江种源乌桕的耐涝性较福建种源强。
2.2 淹水胁迫对乌桕根系无氧呼吸酶的影响
2.2.1 淹水胁迫对乌桕根系ADH活性的影响
由图3可知,在整个处理期间,对照处理的浙江种源根系ADH活性无明显变化,且低于WA和FL处理。在处理的前30 d,WA和FL处理下浙江种源根系ADH活性均呈现先下降后上升的趋势,且2处理间差异不显著;30 d以后,WA处理根系ADH活性继续缓慢升高,FL处理根系ADH活性则呈下降趋势。处理结束时,与对照相比,WA和FL处理下根系ADH活性分别提高了129.36%和57.03%。WA和FL处理下福建种源根系ADH活性显著低于对照,处理10 d以后,由于淹水胁迫对植株造成了极大的伤害,ADH活性几乎检测不出。
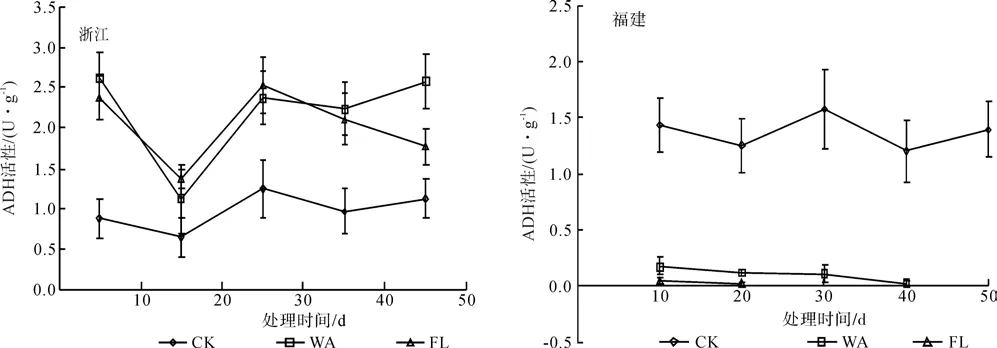
图3 淹水胁迫对ADH活性的影响Fig.3 Effects of water-logging stress on activities of ADH
2.2.2 淹水胁迫对乌桕根系LDH活性的影响
由图4可知,对照处理的浙江种源根系LDH活性变化相对比较平稳,且显著低于WA和FL处理。在处理10 d时,WA和FL处理下LDH活性显著升高,分别为对照的3.29倍和3.03倍,随着处理的持续呈现先下降后上升又缓慢下降的趋势,但一直保持在较高的水平,显著地高于对照;处理结束时,WA和FL处理下根系LDH活性与对照相比分别高206.25%和215.63%。对照处理的福建种源根系LDH活性呈缓慢上升的趋势;同浙江种源一样,在处理10 d时,WA和FL处理下LDH活性分别为对照的4.67倍和4.14倍,然后随着处理的持续急剧下降;30 d以后,WA处理下根系LDH活性均低于对照。

图4 淹水胁迫对LDH活性的影响Fig.4 Effects of water-logging stress on activities of LDH
3 讨 论
3.1 淹水胁迫对乌桕生长的影响
淹水胁迫首先影响林木根系的生理生化变化,进而导致苗木整体的代谢过程,最终导致苗木在形态和生长等方面的变化,因此,苗木生长量的变化直观地反映了耐涝性的强弱。本试验研究结果表明,淹水胁迫整体上影响了乌桕的主干生长,使其苗高生长降低,这与前人在对杨树[16]、鹅掌楸[17]、枫杨[18]、麻栎[19]等苗木上的研究结果一致,且耐涝性强的浙江种源受到的影响较福建种源小。试验中发现,浙江种源在淹水胁迫下,茎基部产生大量白色肥大皮孔,这可能是导致地径增长比对照大的原因。
淹水胁迫显著地抑制了乌桕各器官的生长,阻碍了乌桕苗木生物量的增加,这与前人对杨树[20]、美国山核桃[21]等的研究结果一致。但也有研究发现,涝渍处理对绒毛白蜡的生物量累积有明显的促进作用[22],落羽杉在渍水处理下生物量和生物量增量均高于对照,因此, 树种不同, 对淹水的生长响应存在着一定的差异。
本试验中,淹水胁迫还导致乌桕生物量分配模式的改变,即在淹水和渍水处理下,浙江种源根冠比显著下降,这与前人对杨树[20]、陆地棉[23]、麻栎[19]等的研究结果一致,出现这种结果的可能原因是植物自身通过合理调整生物量分配,增大地上部分(如茎叶)的空间,保障光合作用正常进行以提供足够的光合产物,也为从空气中输送O2到根部提供基础。也有研究表明,淹水导致植物的根冠比升高,如老鼠簕[24]、落羽杉[21]等,主要原因可能是淹水处理下, 更多的光合产物运输到根系,与茎和叶的生物量显著下降相比,根生物量下降少或者没有下降。但在本试验中,福建种源在淹水和渍水处理下,其生长受到极大的抑制,其光合产物的分配几乎可以忽略,所以根冠比的增加应该是茎叶的枯萎凋落导致地上生物量显著下降所造成。
3.2 淹水胁迫对乌桕无氧呼吸酶的影响
低氧胁迫可以引起植物体内LDH、ADH等参与无氧呼吸的酶活性增强,以促进乳酸和乙醇发酵[5],提高NADH的再氧化过程,维持细胞能荷,减少根系细胞的酸化,增强植物对低氧胁迫的抵抗性[25]。研究表明,陆生植物在土壤涝渍和环境缺氧等条件下诱导根组织ADH的大幅度提高。王嘉艳[26]认为在淹水期间ADH活性与樱桃砧木的耐涝性有关,ADH活性跃变期出现的时间越晚越有利于增强砧木对水涝胁迫的忍耐力,而胡晓辉[25]和孙艳军[27]认为在低氧处理的早期ADH活性急剧升高,且一直保持在较高的水平,是对低氧胁迫不敏感的甜瓜和黄瓜品种区别于敏感品种的主要特点。本试验中,在渍水和淹水处理下,耐涝性强的浙江种源ADH活性在处理的10~20 d急剧下降,可能是涝渍胁迫在短期内造成植株体内代谢的紊乱所致,经过乌桕自身调节,产生了能更好地适应低氧环境的不定根,使得ADH活性升高并保持较高的水平,启动乙醇发酵以提供生命活动必需的能量;而耐涝性差的福建种源在渍水和淹水处理下ADH活性只在前期有一定的值,处理中后期一直都很低,甚至检测不到,可能是处理前期产生的乙醇不能被其它代谢途径所消耗,乙醇的过度积累对细胞造成不可逆的伤害,从而抑制了植株的生长。
LDH是乳酸发酵途径的关键酶,有研究指出,乳酸积累可引起细胞质酸化,并引起液泡膜和线粒体结构的破坏,是造成低氧胁迫下细胞伤害的主要原因之一[28]。对黄瓜[25]的研究表明,对低氧敏感的品种在低氧胁迫的早期LDH活性显著上升,而对低氧不敏感的品种则变化缓慢,且活性较低。本试验研究发现,在渍水和淹水处理下,浙江种源LDH活性始终维持在一定的水平上,且高于对照;福建种源在处理的前期显著高于对照,但随着淹水时间的延长而显著下降。这表明2个种源的乌桕在淹水胁迫初期均启动了乳酸代谢途径,以维持根系能量代谢平衡,耐涝性强的浙江种源可能存在其它的代谢途径消耗乳酸代谢产生的乳酸,使乳酸的积累不至于达到伤害细胞的程度,因而根系能始终维持一定的乳酸发酵过程,以提供能量;而耐涝性差的福建种源由于细胞中积累大量乳酸,导致细胞质酸化,线粒体结构受到破坏,进而导致细胞的结构受到伤害,细胞的代谢功能受到抑制,LDH活性也随之下降。
有研究指出,乙醇发酵产生的乙醇可以很快扩散到细胞外而对植株不造成伤害,乳酸发酵产生的乳酸引起细胞质酸化可能是造成低氧胁迫下植株死亡的主要原因。本试验未对根系中乙醇和乳酸的含量变化进行测定,今后将会进一步深入研究。
综上所述,在涝渍胁迫过程中,耐涝性强的浙江种源能够通过自身的调节,维持一定的无氧呼吸代谢途径的强度,为植株的生长提供能量,从而维持一定的生长量;而耐涝性差的福建种源由于淹水胁迫引起的能量亏缺以及乙醇、乙醛、如乳酸等有毒有害物质的积累,植株无法正常生长,直至死亡。
[1] 陈 建, 张光灿, 张淑勇, 等. 辽东惚木光合和蒸腾作用对光照和土壤水分的响应过程[J].应用生态学报,2008,19(6):1155-1190.
[2] Kozlowski T T. Responses of woody plants to flooding and salinity[J]. Tree Physiology Monograph, 1997, 1:1-29.
[3] Jackson M B, Colmer T D. Response and adaptation by plants to flooding stress[J]. Annals of Botany, 2005,96: 501-505.
[4] Ricoult C, EcheverriaL O, CliquetJ B, et al. Characterization of alanine amino transferase multigene family and hypoxic response in young seedlings of the model legume Medicago truncatula[J]. Journal of Experi-mental Botany, 2006,57(12):3079-3089.
[5] 康云艳, 郭世荣, 段九菊. 根际低氧胁迫对黄瓜幼苗根系呼吸代谢的影响[J]. 应用生态学报,2008,19(3):583-587.
[6] Gibbs J, MorrellS, ValdezA, et al. Regulation of alcoholic fermentation in coleoptiles of two rice cultivars differing in tolerance to anoxia[J]. Journal of Experimental Botany, 2000,51(345): 785-796.
[7] Ellis M H, Millar A A, Llew ellyn D J, et al. Transgenic cotton(Gossypium hirsutum) overexpressing alcohol dehydrogenase shows increased ethanol fermentation but no increase in tolerance to oxygen deficiency[J]. Australian Journal of Plant Physiology,2000, 27(11): 1041-1050.
[8] 曹福亮, 方升佐.水分(淹水)胁迫与林木适应性[M]. 北京:中国林业出版社,2003.
[9] 刘东泽, 赵 杰, 刘志诚, 等. 20 种植物提取物对几种昆虫的拒食作用[J]. 农药学学报,2003, 5(3): 89- 91.
[10] 张小红. 乌桕的园林应用与栽培[J]. 中国林业, 2006, 9: 41.
[11] 张克迪, 林一天.中国乌桕[M]. 北京: 中国林业出版社,1994.
[12] Robert H Jones, Rebecca R Sharitz. Effects of root competition and flooding on growth of Chinese tallow tree seedlings[J].Canadian Journal of Forest Research, 1990, 20(5): 573-578.
[13] Conner W H, Mcleod K W, McCarron J K. Flooding and salinity effects on growth and survival of four common forest wetland species[J].Wetlands Ecology and Management,1997,5(2):99-109.
[14] 李冬林, 季永华, 丁晶晶, 等.海水浸淹下乌桕不同种源幼苗的耐性比较[J].中南林业科技大学学报,2012,32(10):63-68.
[15] Mustroph A, Albrecht G. Tolerance of crop plants to oxygen deficiency stress: fermentative activity and photosynthetic capacity of entire seedlings under hypoxia and anoxia[J]. Physiol.Planta., 2003,117:508-520.
[16] 汤玉喜, 刘友全, 吴立勋, 等. 滩地淹水胁迫对杨树生长与木材显微结构的影响[J].中南林学院学报,2005,25(6):29-33.
[17] 张晓平. 不同种源鹅掌揪和杂种鹅掌揪对淹水胁迫的响应[D].南京:南京林业大学,2004.
[18] 李昌晓, 魏 虹, 吕 茜,等.水分胁迫对枫杨幼苗生长及根系草酸与酒石酸含量的影响[J].林业科学,2010,46(11):81-88.
[19] 张晓磊, 马凤云,陈益泰,等.水涝胁迫下不同种源麻栎生长与生理特性变化[J].西南林学院学报,2010,30(3):16-19,33.
[20] 唐罗忠, 徐锡增, 方升佐.土壤涝渍对杨树和柳树苗期生长及生理性状影响的研究[J].应用生态学报,1998,9(5):471-474.
[21] 汪贵斌, 曹福亮, 王 媛.涝渍对3个树种生长、组织孔隙度和渗漏氧的影响[J].植物生态学报,2012, 36 (9): 982-991.
[22] 侯嫦英.水分胁迫对青檀等树种生长及生理特性的影响[D].南京:南京林业大学,2003.
[23] 董合忠, 李维江, 唐 薇, 等. 干旱和淹水对棉苗某些生理特性的影响[J].西北植物学报,2003,23(10):1695-1699.
[24] 张留恩, 廖宝文, 管 伟.模拟潮汐淹浸对红树植物老鼠簕种子萌发及幼苗生长的影响[J].生态学杂志,2011, 30(10):2165-2172.
[25] 胡晓辉, 李 璟, 郭世荣, 等. Ca2+对低氧胁迫下黄瓜幼苗生长和根系无氧呼吸酶的影响[J].西北植物学报, 2005, 25(10):1997-2002.
[26] 王嘉艳. 涝害对樱桃砧木生理生化特性的影响[D]. 泰安: 山东农业大学, 2006.
[27] 孙艳军.根际低氧胁迫对网纹甜瓜幼苗伤害生理的研究[D].南京:南京农业大学,2005.
[28] Chen H J, Qualls R G. Anaerobic metabolism in the roots of seedlings of the invasive exotic Lepidium latifolium[J].Environmental and Experimental Botany, 2003,50: 29-40.
Effects of flooding stress on seedlings growth and anaerobic respiratory enzyme activities of Sapium sebiferum
CAI Jin-feng, CAO Fu-liang, ZHANG Wang-xiang
(College of Forest Resources and Environment, Nanjing Forestry University, Nanjing 210037, Jiangsu, China)
In order to understand the drought-resistant mechanisms of Sapium sebiferum seedlings, The effects of flooding stress on the seedlings growth and anaerobic respiratory enzyme activities of one-year-old S. sebiferum from two provenances were studied by adopting potted simulation experimental method. And three treatments were implemented. The treatments lasted 50 days, the indexes of growth, activities of anaerobic respiratory enzyme were determined for times after different treatments. The results show that compared with well-watered treatments, the flooding stress treatment significantly decreased shoot height and biomass production of Zhejiang provenance, while all seedlings of Fujian provenances died at the condition of hypoxia; the activities of alcohol dehydrogenase(ADH)and lactate dehydrogenase(LDH) in stressed Zhejiang provenance seedlings compared to controls increased and maintained at a higher level; while the activities of ADH of Fujian provenance were significantly lower than the control; at the early period (ten days) of treatment, the activities of LDH under water-logging and flooding were 4.67 times and 4.14 times of the control, but declined rapidly during the later period of treatment. It was suggested that under water-logging and flooding, the tree species with strong flooding stress tolerance had a higher ability to maintain energy-metabolic balance, and thus, its growth could be maintained at a certain level.
Sapium sebiferum; flooding stress; seedling growth; anaerobic respiratory enzyme
S718.43
A
1673-923X(2013)09-0005-06
2013-01-20
国家“十二五”科技支撑计划项目(2011BAD38B01)
蔡金峰(1984-),男,山东临清人,博士研究生,从事森林培育研究;E-mail:caijinfeng1984@126.com
[本文编校:谢荣秀]

