一株拮抗猕猴桃叶枯病的美丽短芽孢杆菌NF2的He-Ne激光诱变育种
付 博,李炎琪,李忠玲,马 齐,徐升运,高平安,段康民
(1.陕西省科学院酶工程研究所、陕西省酶工程技术中心、陕西省酿造发酵产品质量监督检验站,陕西西安 710600;2.西北大学西部资源生物与现代生物技术教育部重点实验室,陕西西安 710069;3.西北大学物理学系,陕西西安 710069)
近年来猕猴桃细菌性叶枯病成为新兴的猕猴桃主要病害,其致病菌为丁香假单胞菌丁香致病变种(Pseudomonas syringae pv.Syringae),该病原菌一般从叶片内部开始侵染,初期在叶片上形成水渍状小斑点,随着病情的加重发展成多角形大病斑,并且病斑的中心逐渐枯死,变为深褐色,病斑的不断扩大造成叶片内部大部分组织枯死,严重影响果树的生长及果实的品质[1-3]。本课题组研究表明,美丽短芽孢杆菌(Brevibacillus formosus)对猕猴桃叶枯病病原菌具有较好的拮抗作用,同时对其他作物常见真菌性病害也具有良好的抗菌作用,这与该菌株可能产生的抗菌肽、胞外蛋白酶和脂肽类抗生素等活性物质有关[4-5]。为了进一步提高生物防治效果,对野生型菌种进行诱变育种,选育拮抗能力更强的菌株具有重要的现实意义。
目前常用的生物育种方法主要有:诱变育种、基因重组育种和基因工程育种[4],He-Ne激光诱变是一种高效的诱变育种新技术,激光具有能量密度高、靶点小、单色性和方向性好的特点,激光诱变当代就可出现遗传性突变。此外低能量的激光还具有促进细胞生长、提高产量、获得遗传性能稳定突变株等优势,因此在微生物育种中得到广泛的应用[5-7]。
本文以美丽短芽孢杆菌NF2为供试菌,采用He-Ne激光诱变技术,选育对猕猴桃叶枯病拮抗能力提高并能稳定遗传的突变株,从而提高菌种的应用效果,为实用、新型、高效的生物菌剂的开发奠定基础。
1 材料和方法
1.1 菌种
美丽短芽孢杆菌(Brevibacillus formosus)NF2(GenBank登陆号KC495120),本实验室分离保藏。猕猴桃叶枯病病原菌,丁香假单胞菌丁香致病变种(编号1336)(Pseudomonas syringae pv.Syringae),购于中国林业科学研究院森林生态环境与保护研究所。
1.2 培养基
牛肉膏蛋白胨培养基,用于菌株的培养[8]。
1.3 主要仪器
He-Ne激光器(功率0~30mW,波长632.8 nm),西北大学物理学系提供。SW-CJ-1F型无菌操作台(苏净集团苏州安泰空气技术有限公司),ZHWY-2102C型摇床(上海智城)。
1.4 美丽短芽孢杆菌NF2生长曲线的测定
将菌株以5%接种量转接到牛肉膏蛋白胨培养液,30℃,200r/min振荡培养,2h为时间间隔,测定发酵液在600 nm处的吸光值,绘制生长曲线。
1.5 He-Ne激光诱变育种
1.5.1 诱变菌龄 根据菌株生长曲线,选择对数生长期末、稳定生长期初的菌体作为诱变对象。
1.5.2 菌悬液的制备 取培养8 h的菌株发酵液,4 000 r/min离心15 min,弃上清,菌体沉淀用无菌生理盐水制备成浓度为108cfu/mL的菌悬液[9]。
1.5.3 激光照射 取0.2 mL的菌悬液置于无菌玻璃小试管(1.0 cm×7.5 cm),小试管置于激光束正下方,按照射时间 5min,10min,15min,20min,照射强度5mW,10mW,15mW,20mW,进行组合诱变,未经照射的作为空白对照。照射后吸取0.1mL进行稀释涂布,每个稀释度3个平行,进行菌落计数。计算存活率:

1.5.4 拮抗能力的检测[9]从不同照射组的平皿中分别随机挑取30个单菌落,以未经照射的原始菌株为对照,按相等的间距将菌种依次接种于含有猕猴桃叶枯病病原菌的培养平板上(每个平板点5个),30℃培养48 h,观察原始菌株及诱变菌株的抑菌圈大小(直径大小分别为Φ1,Φ2),如果Φ2>Φ1则视为正突变株,计算正突变率和拮抗效果提高率:

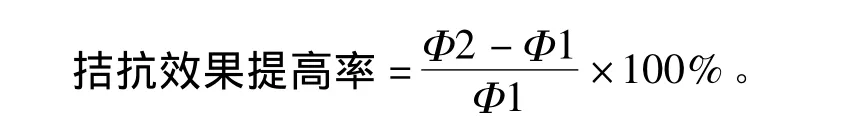
1.5.5 突变株的遗传稳定性[9-10]连续传代培养至第15代,每隔一代记录菌株的抑菌圈直径(4个平行),通过SPSS 16.0软件分析菌株拮抗能力的遗传稳定性。
2 结果
2.1 美丽短芽孢杆菌NF2的生长曲线
美丽短芽孢杆菌的革兰氏染色结果见图1。按1.4所述方法绘制NF2的生长曲线(见图2),8h为对数生长期末、稳定生长期初,细胞数量达到最大值,此时芽孢染色检测发现菌体并未产芽孢,因此选择菌龄为8h的菌体作为He-Ne激光诱变的研究对象。
2.2 He-Ne激光诱变结果
按照射时间 5min,10min,15min,20min,照射强度5mW,10mW,15mW,20mW,进行组合诱变后,菌株的存活率和正突变率的差异较大(见表1),但数据的规律性不强。当照射强度为5mW时,菌株的存活率较高,在70%以上。正突变率也较高,其中5~15 min均为46.7%,20min为16.66%。初步得出结论,低强度激光照射有利于保持菌体活性,而且有利于筛选出正突变率较高的菌株。为了进一步验证,重新设置照射强度为5mW,照射 时 间 10min,15min,20min,25min,30min,35min,40min 进行诱变(由于 5min 照射时间较短,照射误差较大,稳定性较差,所以验证试验中舍去了)。结果显示(见图3),当照射强度为5mW,照射时间为10min时菌株的存活率接近100%,正突变率44%,与第一次实验结果基本一致,确定菌株 NF2的最佳诱变条件为5mW、10min,计算菌株拮抗效果提高了20.63%(见图4)。
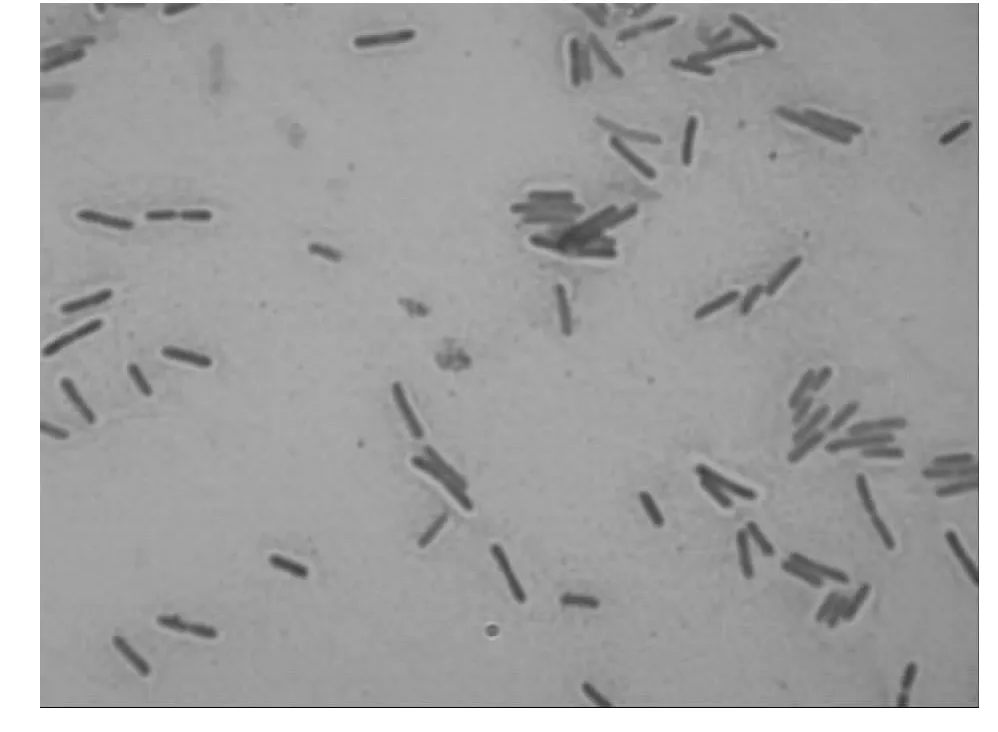
图1 美丽短芽孢杆菌NF2的革兰氏染色Fig.1 Gram staining of Brevibacillus formosus NF2
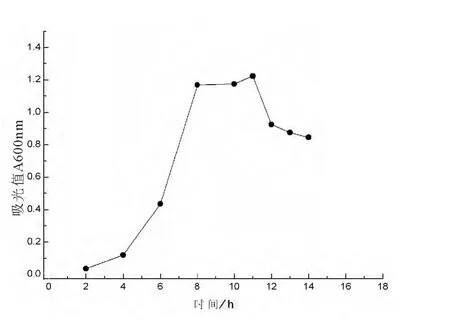
图2 美丽短芽孢杆菌NF2的生长曲线Fig.2 Growth curve of Brevibacillus formosus NF2

表1 He-Ne激光诱变对菌株存活率和正突变率的影响Tab.1 The effect on survival rate and positive mutation rate of strain NF2 by He-Ne laser
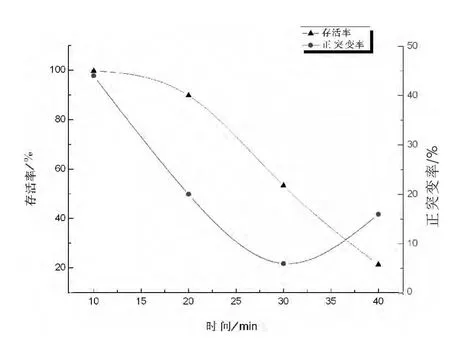
图3 低照射强度对菌株存活率和正突变率的影响Fig.3 The effect on survival rate and positive mutation rate of strain NF2 by low intensity irradiation
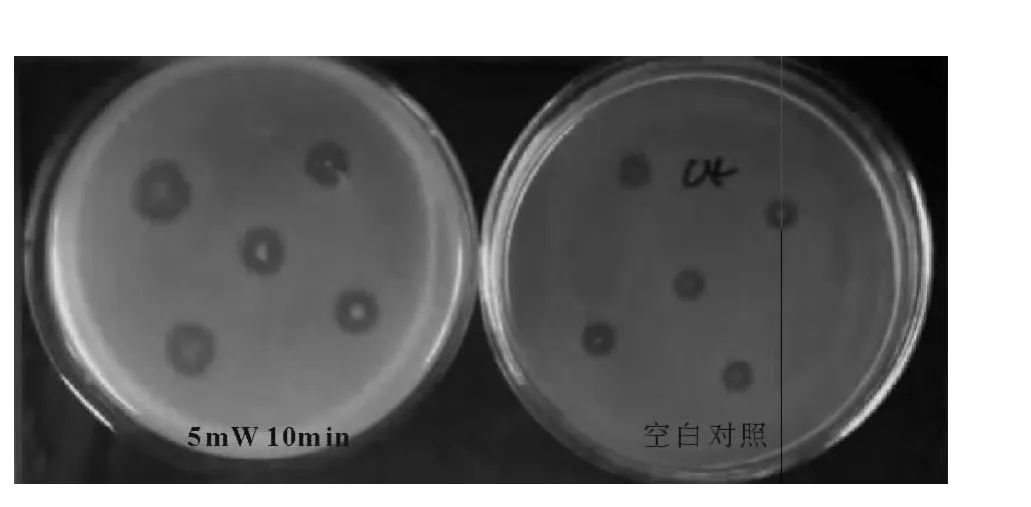
图4 He-Ne激光诱变前后对比图Fig.4 Contrast the difference before and after the He-Ne laser mutation
2.3 诱变后菌株的遗传稳定性分析
菌株在5mW,10min的He-Ne激光诱变条件下,菌体存活率最高且正突变效果最好。选择1株诱变效果较好的菌株连续传代培养至第15代,每隔一代记录菌株的抑菌圈直径,通过SPSS 16.0软件单因素分析菌株拮抗能力的遗传稳定性(见表2),P=1.000(>0.05)统计分析表示总体平均数差异不显著,说明诱变后各代间菌株的拮抗能力没有显著性差异,由此可以证明诱变后正突变菌株的拮抗能力可以稳定遗传。

表2 诱变后菌株遗传稳定性的单因素方差分析Tab.2 One-way ANOVA analysis on genetic stability of mutant strain
3 结论
激光作为一种新的诱变剂,对生物体会产生热、压力、光、电磁场等多种效应,在微生物遗传育种中具有广泛的应用前景[11]。本研究采用He-Ne激光器,对美丽短芽孢杆菌NF2进行诱变,结果显示菌株NF2的最佳诱变条件为5mW,10min,诱变后菌株拮抗效果提高了20.63%,说明低剂量激光辐射更有利于菌株诱变效果的提高,这与黄建新[14]、祖威[7]等人的研究结果一致。推测这可能是由于激光诱变过程产生的光、热、压力和电磁场效应,直接或间接地激活了菌体质粒中携带的抗生素基因、或者激活了菌体产生某种酶的能力[9]。
研究显示,诱变后菌株的拮抗能力可以遗传稳定至少15代,说明He-Ne激光诱变的菌株稳定性较好。但是,实验中发现He-Ne激光器在5mW这样低功率条件下,光束会有一定的能量损失,因此在操作时应提前较长时间对仪器进行预热和光强度稳定性调整。
[1] 宋晓斌,张学武,黄健.猕猴桃细菌性叶枯病病原菌和发生规律研究[J].西北农林科技大学学报(自然科学版),2003,31(5):73-76.
[2] 李娟,陈亮,陈立,等.猕猴桃细菌性叶枯病生防芽孢杆菌筛选及田间防效[J].中国生物防治,2010,26(2):235-239.
[3] 李娟.陕西猕猴桃常见病害生物防治技术及田间应用[D].西安:西北大学,2010.
[4] ZHAO Jing,GUO Li-hua,ZENG Hong-mei,et al.Purification and characterization of a novel antimicrobial peptide from Brevibacillus laterosporus strain A60[J].Peptides,2012,33:206-211.
[5] HUANG Xiao-wei,TIAN Bao-yu,NIU Qiu-hong,et al.An extracellular protease from Brevibacillus laterosporus G4 without parasporal crystals can serve as a pathogenic factor in infection of ematodes[J].Research in Microbiology,2005,156:719-727.
[6] 杨素亮.高效苯酚降解菌的分离纯化及He-Ne激光诱变育种研究[D].天津:天津大学,2005.
[7] 祖威,胡青平.提高枯草芽孢杆菌QM3拮抗能力的He-Ne激光诱变技术[J].中国生物防治,2009,25(1):92-94.
[8] JIANG Yan,WEN Jian-ping,HU Zong-ding.Mutant AFM2 of faecalis for phenol biodegradation using He-Ne laser irradiation [J].Chemosphere,2006,10:1-6.
[9] JIANG Yan,WEN Jian-ping,JIA Xiao-qiang,et al.Mutat ion of Candida tropical is by irradiation with a He-Ne laser to increase its ability to degrade phenol[J].Applied and environmental microbiology,2007,73(1):226-231.
[10]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,2003.
[11]张军.广谱拮抗菌WB3的激光诱变筛选与复合菌肥的生物防治应用[D].西安:西北大学,2009.
[12] HU Qing-ping,XU Jian-guo,SONG Peng,et al.Isolation and identification of a potential biocontrol agent Bacillus subtilis QM3 from Qinghai yak dung in China[J].World journal of microbiology and biotechnology,2008,24(11):2451-2458.
[13]薛正莲,潘文洁,杨超英.采用He-Ne激光诱变选育速生高产茯苓菌[J].食品与发酵工业,2005,31(2):51-54.
[14]黄建新,马艳玲,惠友权,等.He-Ne激光对产ALDC地衣芽孢杆菌的诱变效应[J].光子学报,2001,30(6):680-683.
- 西北大学学报(自然科学版)的其它文章
- 北美独行菜:陕西烟田中的一种新杂草

