湖南崀山森林公园不同植被条件下土壤微生物量及酶活性研究
杨贤均,王业社,段林东,陈立军,晏雪晴
(邵阳学院城市建设系,湖南邵阳422004)
微生物量、酶活性等土壤生物学参数是常用的表征土壤质量变化及其动态的参数。土壤微生物生物量是表征土壤肥力特征和土壤生态系统中物质和能量流动的一个重要参数,是土壤养分的储存库和植物生长可利用养分的重要来源[1-4]。而土壤酶作为土壤组分之一,以稳定蛋白质形态存在于土壤中,是具有蛋白质性质的高分子催化分解有机物,是一类生物催化剂。由于植被类型以及土壤、土层深度的不同,使土壤微生物量、土壤酶活性呈现不一样的变化规律[5-8]。如魏亚伟等[2]、杨成德等[4]报道土壤微生物量随植被类型、土层深度的变化而变化。于方明等[5]、李为等[6]、符裕红等[7]研究结果表明不同植被类型、不同土壤类型及不同土层深度其土壤酶活性表现出不一样的变化特征。
崀山位于湖南省南部跟广西交界的新宁县。目前,该地区因旅游与生态发展矛盾突出,植被恢复成为该地区的首要任务之一[9]。而对不同阶段植物群落的研究主要集中在物种组成及生态位变化上[10-11],有关于崀山森林公园不同恢复阶段植物群落土壤酶活性以及微生物量的研究还尚未报道,因此本研究拟通过对崀山森林公园植物群落的灌木阶段、乔灌阶段和乔木阶段3个不同恢复阶段0~20 cm,20~40 cm土层中的土壤酶活性及微生物量进行研究,以揭示崀山森林公园植物群落恢复过程土壤环境变化、土壤酶活性及微生物量变化规律,为崀山森林公园生态系统植被恢复和重建提供理论依据。
1 材料与方法
1.1 研究区域自然概况
研究区域位于湖南省邵阳市,年平均气温17.1℃,7月最热,月平均气温28.5℃;1月最冷,月平均气温4.7℃,≥10℃年积温为5000~5400℃,无霜期271~309 d。市境内全年日照时数为1350~1670 h,年日照百分率为31% ~38%,太阳年辐射总量为4131~4519 MJ/m2。全市年降雨量1000~1300 mm,年内各月降雨量以5月最多,达200~230 mm,12月最少,为43~53 mm。崀山景区气候属亚热带湿润季风气候[10-11]。
1.2 研究方法
1.2.1 土样的采集与处理 植物群落不同恢复阶段样方概况见表1。本研究于2012年8月进行了实地考察,采用典型取样法选择立地条件基本一致的地段设置样方,植物群落灌木阶段(A)、乔灌阶段(B)和乔木阶段(C)3种类型各设置重复样方5个,每个样方面积为20 m×20 m,每个样方内再设置4个面积为5 m×5 m的小样方,在已建立的标准样地中心与四角为采样点进行采样,分别采集土层深度为0~20 cm(分别标记为A1,B1,C1)、20~40 cm(分别标记为A2,B2,C2)2个层次的土壤,每层采集土样约1 kg,将同一样方内同一土层所采集的土样充分混匀,再利用四分法的方式收集土壤1 kg左右带回实验室。带回实验室后,将一部分新鲜土壤过10目(2.00 mm)筛后存放于-4℃用于土壤酶活性测定;另取一部分土壤经自然风干后,过20目(0.90 mm)、100目(0.15 mm)筛,用密封袋封好后用于土壤理化性质的测定。
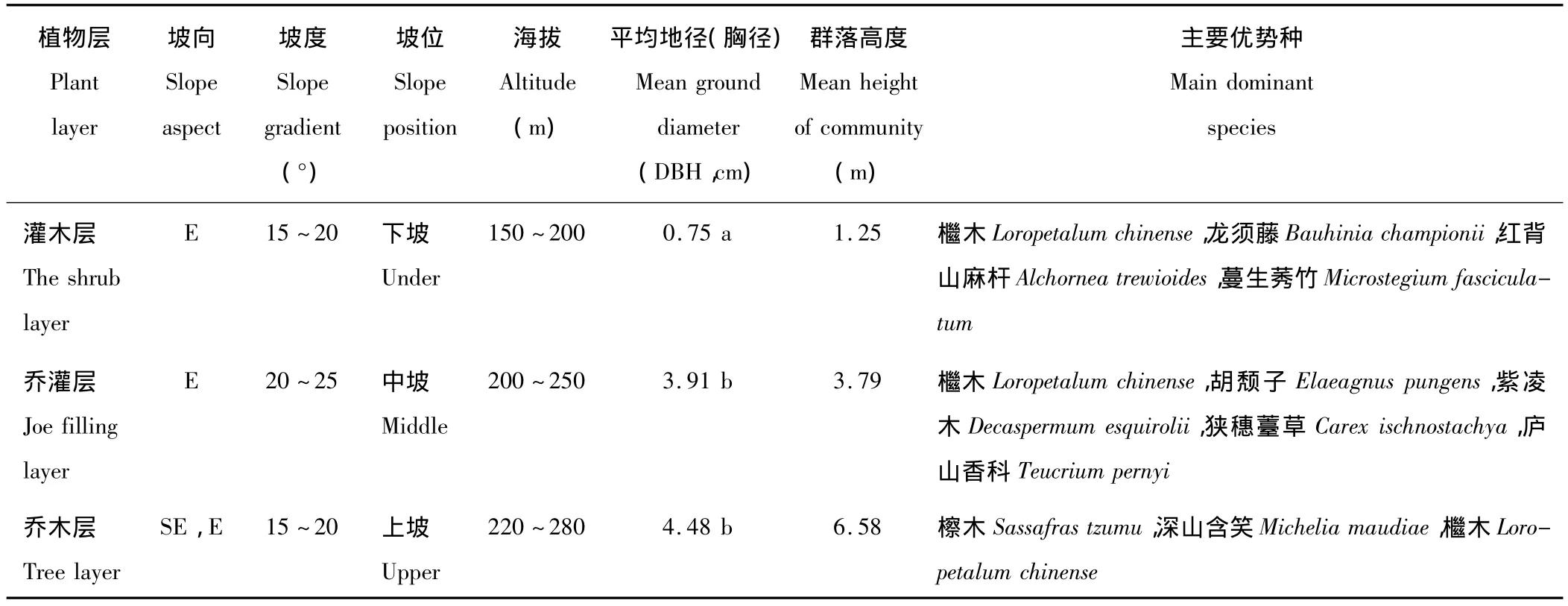
表1 植物群落样方基本情况Table 1 Basic conditions of sampling sites of phytocoenosis communities
1.2.2 土壤基本性质测定 土壤pH值采用中国农业行业标准(NY/T1121.2-2006)的方法[12],水土之比为2.5∶1。土壤中有机碳含量的测定采用K2Cr2O7外加热法[13]。土壤中全磷采用钼锑抗比色法测定[13],土壤全氮用半微量凯氏定氮法测定[13]。
1.2.3 土壤水溶性盐含量的测定 土壤水溶性盐含量的测定采用电导法[3],通过测定待测液电导率的高低即可测出土壤水溶性盐含量。称取过1 mm筛风干土20.00 g,置于250 mL干燥三角瓶中,加入蒸馏水100 mL(水土比5∶1),振荡5 min,过滤于干燥三角瓶中,需得到清壳滤液,吸取土壤浸出液30 mL放在50 mL小烧杯中,测量溶液温度,然后用电导仪测定待测液的电导度。
1.2.4 微生物量测定 微生物量碳、微生物量氮和微生物量磷用氯仿熏蒸浸提法[4]。称取30 g经7 d预培养的土样于100 mL烧杯中,并和盛有50 mL氯仿及50 mL 1 mol/L NaOH的烧杯同时置入干燥器,用真空泵抽至氯仿沸腾并保持5 min后,密封置于25℃恒温箱中熏蒸24 h。待熏蒸结束后,取出氯仿和NaOH,用真空泵反复抽气直至土壤无氯仿气味后用于微生物量的测定。将熏蒸土样用0.5 mol/L K2SO4溶液振荡浸提用于微生物量碳和微生物量氮测定,或用0.5 mol/L NaHCO3(pH 8.5)溶液振荡浸提用于微生物量磷的测定。在进行熏蒸的同时称取同样质量的土样3份立即浸提和测定,以不熏蒸为对照。
1.2.5 土壤酶的测定 脲酶采用苯酚钠比色法[14],脲酶活性以37℃培养24 h后以1 g土壤NH3-N的mg数表示。蔗糖酶采用3,5-二硝基水杨酸比色法,蔗糖酶活性以37℃培养24 h后1 g土壤葡萄糖的mg数表示。过氧化氢酶活性采用0.10 mol/L KMnO4滴定法,过氧化氢酶活性以振荡20 min后,滴定1 g土壤所消耗的KMnO4的mg数表示。磷酸酶活性采用氯代二氯对溴苯醌亚胺比色法,磷酸酶活性以37℃培养24 h后1 g土壤中释放的酚的mg数表示。蛋白酶活性采用茚三酮比色法,蛋白酶活性以30℃培养24 h后1 g土壤NH3-N的mg数表示。
1.3 数据处理
实验结果均为3次实验值的平均值,所得数据采用Excel 2003和SPSS 13.0处理。
2 结果与分析
2.1 不同恢复阶段不同土层土壤基本性质
由表2可知,不同恢复阶段、不同土层土壤的基本理化性质存在一定的差异,其中A、C阶段土壤pH呈中性,而B阶段呈酸性。土壤有机质、全磷、全氮0~20 cm均高于20~40 cm,且0~20 cm土层中有机质和全氮含量均显著高于20~40 cm(P<0.05),在A、B、C三个阶段中,以C阶段的有机质、全磷、全氮含量最高。
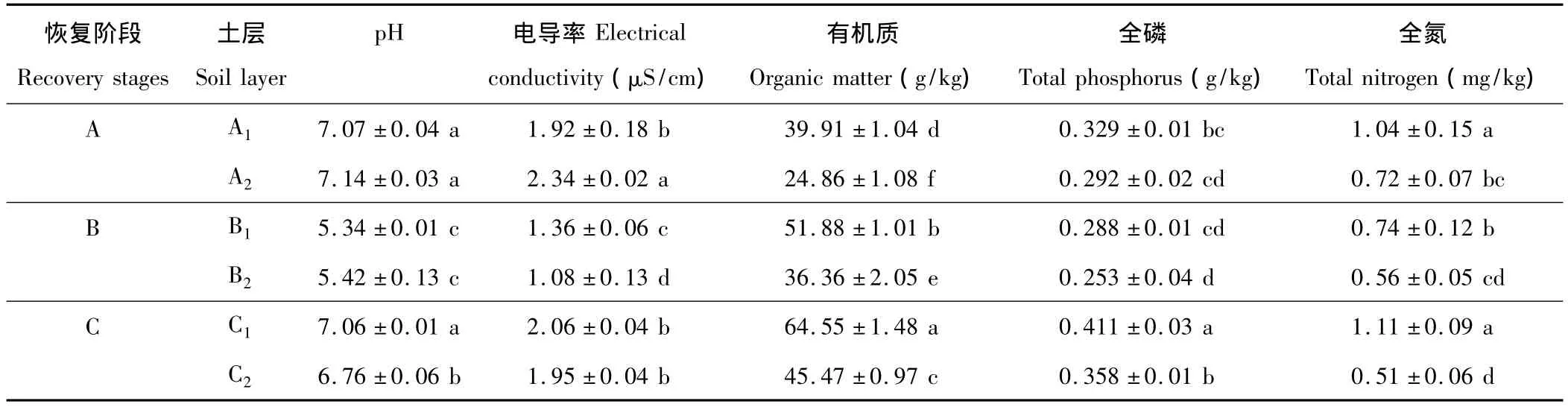
表2 不同恢复阶段土壤基本性质Table 2 Physico-chemical properties of tested soil
2.2 土壤微生物量碳、氮和磷及对土壤营养库的贡献率
从图1中可以看出不同恢复阶段的微生物量碳、微生物量氮、微生物量磷含量均表现为0~20 cm显著高于20~40 cm(P<0.05)。微生物量碳以C阶段最高,且与A、B两阶段差异显著 (P<0.05)。0~20 cm土层中的微生物量氮以B阶段最低,A、C阶段差异不显著 (P>0.05),20~40 cm土层中的微生物量氮在A、B、C三阶段无显著性差异 (P>0.05)。微生物量磷以C阶段含量最高,且在0~20 cm、20~40 cm均表现为C>A>B。微生物量碳、氮、磷对土壤有机质、全氮、全磷的贡献率均表现为0~20 cm大于20~40 cm。从土壤微生物量碳对土壤有机质的贡献率来看,0~20 cm土壤微生物量碳对土壤有机质的贡献率为0.69% ~1.02%,20~40 cm为0.41% ~0.53%,其中C阶段最高,分别达到1.02%和0.53%。相对于微生物量碳来说,微生物量氮的贡献率高于微生物量碳,0~20 cm土壤微生物量氮对土壤全氮的贡献率为1.27% ~1.75%,20~40 cm为0.73% ~0.85%。0~20 cm微生物量磷对全磷的贡献率为2.96% ~3.32%,20~40 cm为1.89% ~2.18%。
2.3 不同恢复阶段土壤酶活性的变化
从表3可以看出,0~20 cm土层中蔗糖酶、脲酶、磷酸酶、蛋白酶、过氧化氢酶活性显著高于20~40 cm(P<0.05)。不同恢复阶段0~20 cm 土层中蔗糖酶活性分别高出20~40 cm 35.69%,15.14%,15.14%;在 A、B、C三阶段中,0~20 cm土层的脲酶活性表现为C>B>A,且差异显著(P<0.05),其中A、B恢复阶段的酶活分别是C的42.93%,84.29%;20~40 cm土层中,A阶段脲酶活性显著小于B、C恢复阶段的活性(P<0.05)。在3个不同恢复阶段中,A恢复阶段蛋白酶活性最高,且显著高于B、C阶段的(P<0.05),分别是B、C阶段的1.244,1.442倍和1.680,1.713倍;中性磷酸酶以B恢复阶段的活性最高,碱性磷酸酶则以A阶段的最高。不同恢复阶段土壤中过氧化氢酶活性在不同土层之间具有一定的差异,0~20 cm层3个不同恢复阶段的过氧化氢酶活性差异不显著(P >0.05),其中20 ~40 cm 土层的酶活是0 ~20 cm 土层的95.48%,92.72%,94.33%。
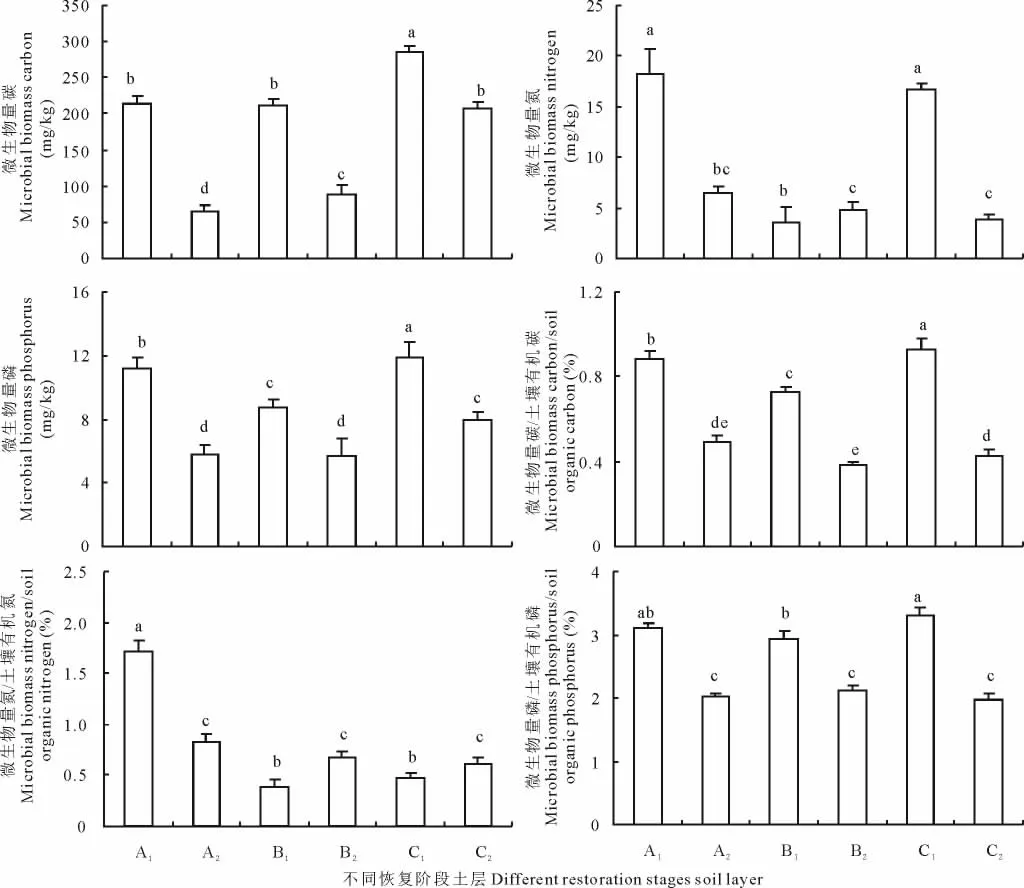
图1 土壤微生物量碳、氮和磷及对土壤营养库的贡献率Fig.1 Changes of the soil soil microbial biomass C,soil microbial biomass N,soil microbial biomass P and the ratios of soil microbial biomass C/soil organic carbon,soil microbial biomass N/soil organic nitrogen,soil microbial biomass P/soil organic phosphorus
3 讨论
土壤微生物量碳作为土壤有机碳中最活跃和最易变化的部分,直接参与养分循环转化等生物化学过程,同时又与土壤中的C、N、P、S等元素生物地化循环密切相关,是反映土壤微生物活性强度及有机质分解过程的重要指标,加之对环境变化敏感性高,常被作为土壤有机碳动态的早期响应指标[15-16]。本研究结果表明,崀山植物群落不同恢复阶段土壤微生物量碳均表现为0~20 cm土层高于20~40 cm土层,这与前人的研究结果一致[17-18],且在乔木阶段显著高于灌木阶段和乔灌阶段,这可能是由于地表覆盖物以及植被类型对土壤微生物量碳的影响较大的原因所致。土壤微生物量P是土壤有机P中最为活跃的部分,是土壤P养分的重要源和库[17],本研究结果表明,微生物量磷以C阶段含量最高,这与从农田到乔木演替各阶段中微生物量P呈上升变化趋势的结果一致[17],表明同一群落类型的不同阶段对微生物量P的影响差异较大,可能归因于土壤环境与植物生长等的复杂交互作用[1]。

表3 不同恢复阶段土壤酶活性的变化Table 3 The activity of soil enzyme in the soil of the three different recovery stages
土壤微生物量对土壤营养库的贡献率反映了土壤单位营养所负载的微生物量。本研究结果表明檵木群落不同恢复阶段的微生物量碳、氮、磷对土壤有机质、全氮、全磷的贡献率分别为0.41% ~1.01%,0.73% ~1.74%,1.89% ~3.32%,且均表现为0~20 cm大于20~40 cm,低于人工种植刺槐林后土壤微生物量碳、氮占有机碳、全氮的比例[19],这可能是由于喀斯特地貌土层发育较浅土壤有机碳和氮素贫瘠,微生物代谢功能期短,要维持植物生长所需要的碳源、氮源和营养物质,则必须提高微生物量在有机碳和全氮中所占比例来维持高的物质代谢能力有关[19]。20~40 cm土层贡献率较0~20 cm虽低,但还是有一定的贡献率,表明20~40 cm的微生物还是具有潜在固定矿物质的能力,是一种潜在的营养库,对生态系统能量流动和物质转化具有一定作用[4,20-22]。
土壤酶是一类能加速土壤生化反应的生物催化剂,在物质循环、能量转化、加速生物化学反应等方面起着非常重要的作用。本研究结果表明,崀山森林公园植物群落不同恢复阶段土壤蔗糖酶、脲酶、磷酸酶(中性和碱性)、蛋白酶和过氧化氢酶的活性,在不同恢复阶段土壤酶活性均表现为0~20 cm土层高于20~40 cm土层。这主要是因为在不同恢复阶段土壤的表层积累了大量枯枝落叶,经过微生物分解形成腐殖质,使得表层土壤中的有机质含量相对较高,再加上土壤表层水热条件和通气性能好,为微生物的生长提供了有利的环境与物质能源,有利于微生物的活动,使得土壤酶活性也较高[20]。而20~40 cm土层酶活性较低,有可能与该区域属于典型的岩溶地区,土壤贫瘠,土层厚度较薄有关。随着土层深度的不断增加,土壤孔隙变小,植物根系不发达,同时土壤的水热条件和通气性能差,不利于微生物的活动,使得土壤酶活性降低。
[1]刘满强,胡锋,何园球,等.退化红壤不同植被恢复下土壤微生物量季节动态及其指示意义[J].土壤学报,2003,40(6):937-944.
[2]魏亚伟,苏以荣,陈香碧,等.人为干扰对桂西北喀斯特生态系统土壤有机碳、氮、磷和微生物量剖面分布的影响[J].水土保持学报,2010,24(3):164-169.
[3]易海燕,宫渊波,伍维翰,等.岷江上游山地森林/干旱河谷交错带植被恢复对土壤微生物量及酶活性的影响[J].水土保持学报,2010,24(3):145-149.
[4]杨成德,龙瑞军,陈秀蓉,等.东祁连山高寒灌丛草地土壤微生物量及土壤酶季节性动态特征[J].草业学报,2011,20(6):135-142.
[5]于方明,刘华,刘可慧,等.川西亚高山暗针叶林恢复初期土壤酶活性研究[J].生态环境学报,2012,21(1):64-68.
[6]李为,余龙江,李涛,等.岩溶生态系统土壤酶活性的时空动态及其与土壤肥力的关系[J].农业环境科学学报,2008,27(1):260-266.
[7]符裕红,黄宗胜,喻理飞.岩溶区典型根系地下生境类型中土壤酶活性研究[J].土壤学报,2012,49(6):1202-1209.
[8]陈余道,蒋亚萍,朱银红.漓江流域典型岩溶生态系统的自然特征差异[J].自然资源学报,2003,18(2):326-332.
[9]李先琨,何成新,唐建生,等.广西岩溶山地生态系统特征与恢复重建[J].广西科学,2008,15(1):80-86,91.
[10]陈生云,刘文杰,叶柏生,等.疏勒河上游地区植被物种多样性和生物量及其与环境因子的关系[J].草业学报,2011,20(3):70-83.
[11]马姜明,吴蒙,占婷婷,等.漓江流域岩溶区檵木群落不同恢复阶段物种组成及多样性变化[J].生态环境学报,2013,22(1):66-71.
[12]Yang Y,Luo Y.Carbon:nitrogen stoichiometry in forest ecosystems during stand development[J].Global Ecology and Biogeography,2011,20:354-361.
[13]鲍士旦.土壤农化分析手册[M].北京:中国农业出版社(第三版),1999:103-105.
[14]汪涵,王果,黄颖颖,等.pH变化对酸性土壤酶活性的影响[J].生态环境,2008,17(6):2401-2406.
[15]罗明,文启凯,纪春燕,等.不同施肥措施对棉田土壤微生物量及其活性的影响[J].土壤,2002,1:53-55.
[16]古丽君,徐秉良,梁巧兰,等.生防木霉对草坪土壤微生物区系的影响及定殖能力研究[J].草业学报,2013,22(3):321-326.
[17]陈小燕,吕家珑,张红,等.子午岭不同植被类型土壤微生物量与有机酸含量[J].干旱地区农业研究,2008,26(3):167-170.
[18]尤孟阳,韩晓增,梁尧.不同植被覆盖下土壤微生物量碳动态变化[J].土壤通报,2012,43(6):1401-1404.
[19]薛萐,刘国彬,戴全厚,等.侵蚀环境生态恢复过程中人工刺槐林(Robinia pseudoacacia)土壤微生物量演变特征[J].生态学报,2007,27(3):909-917.
[20]安韶山,黄懿梅,刘梦云,等.宁南宽谷丘陵区植被恢复中土壤酶活性的响应及其评价[J].水土保持研究,2005,12(3):31-34.
[21]王文,蒋文兰,谢忠奎,等.黄土丘陵地区唐古特白刺根际土壤水分与根系分布研究[J].草业学报,2013,22(1):20-28.
[22]滕泽琴,李旭东,韩会阁,等.土地利用方式对陇中黄土高原土壤磷组分的影响[J].草业学报,2013,22(2):30-37.

