山西白羊草种质资源遗传多样性的ISSR分析
李钰莹,董宽虎
(山西农业大学动物科技学院,山西太谷030801)
白羊草(Bothriochloa ischaemum)是禾本科孔颖草属丛生、具匍匐茎的多年生暖季型牧草,属C4植物,具有高产、抗旱、耐牧等特点,是我国暖性草丛类草地的建群种,主要分布于我国暖温带森林草原区和落叶阔叶林区。白羊草草地是山西中南部地区低山丘陵区的主要草地类型[1]。国外早在20世纪50年代对于白羊草能进行无融合生殖(apomixis)已有报道[2-3],即白羊草可以不经过雌雄性细胞的融合而产生有胚的种子;国内肖辅珍和王景林[4]采用石蜡切片法和苏木精浅染整体透明法观察了北京地区的白羊草生殖过程,观察到不定胚、双胚、多胚囊以及双苗现象,证实了白羊草的无融合生殖现象。白羊草可以进行有性繁殖和无融合生殖[2-3,5-6],而这2种繁殖存在资源的竞争,两者之间的权衡很大程度上受植物生理生化特性和生境条件的影响[7],对于山西省境内不同地域的白羊草自然状态下的生殖特点还罕有报道。约在20世纪早期白羊草作为牧草引入美国[8],白羊草现已广泛分布于美国的中部和南部地区,对于白羊草的研究国内外已做了大量的工作,主要集中在生理生态方面[9-12],利用分子手段对白羊草的研究还罕有报道[13-14]。
简单序列重复区间(inter simple sequence repeat,ISSR)DNA分子标记技术是Zietkiewicz等[15]于1994年提出,在PCR(polymerase chain reaction)中直接使用微卫星序列进行DNA扩增[16],具有操作简单、成本低、快速、灵敏、检测多态性能力强、所需DNA模板的量少而倍受青睐。ISSR标记在雀麦(Bromus)[17]、燕麦(Avena sativa)[18]、扁蓿豆(Melissitus)[19]和苜蓿(Medicago)[20]等牧草种质资源的遗传多样性研究领域得到广泛应用。山西省白羊草野生资源丰富,分布广泛,是较为重要的建群种植物之一。本研究利用ISSR分子标记对山西省内33个自然居群白羊草进行了遗传多样性研究,以期从遗传上鉴定这些材料,为后期的育种和种质资源的收集、保存工作奠定基础,同时从分子层面揭示出山西省内不同地域白羊草的繁殖特点。
1 材料与方法
1.1 材料
参试白羊草种质资源于2010年10月采自山西境内,共33个自然居群,各居群地理信息如表1。2011年6月种植于山西农业大学动物科技学院草业科学实验室,待植株正常生长到50 d后采样。对不同居群,随机收集8株以上[21]的白羊草无污染叶片均匀混合后存于-80℃冰箱备用。
1.2 方法
1.2.1 总DNA的提取与检测 采用改良的CTAB法提取基因组DNA[16],紫外分光光度计检测纯度,核酸分析仪测定DNA浓度。稀释至10 ng/μL,母液于-20℃冰箱中备用[13]。
1.2.2 引物筛选 引物从哥伦比亚大学(University of British Columbia Biotechnology,UBC)提供的96条引物序列中选出25条在禾本科牧草中多态性较高的引物进行筛选,引物由生工生物工程(上海)公司合成,其中23条引物都能扩增出清晰的条带。经过综合考虑其多态性、重复性和稳定性,最终选出10条用于本次试验,引物序列如表2所示。Taq DNA酶、dNTPs、Mg2+和10×PCR Buffer购自宝生物工程(大连)公司。
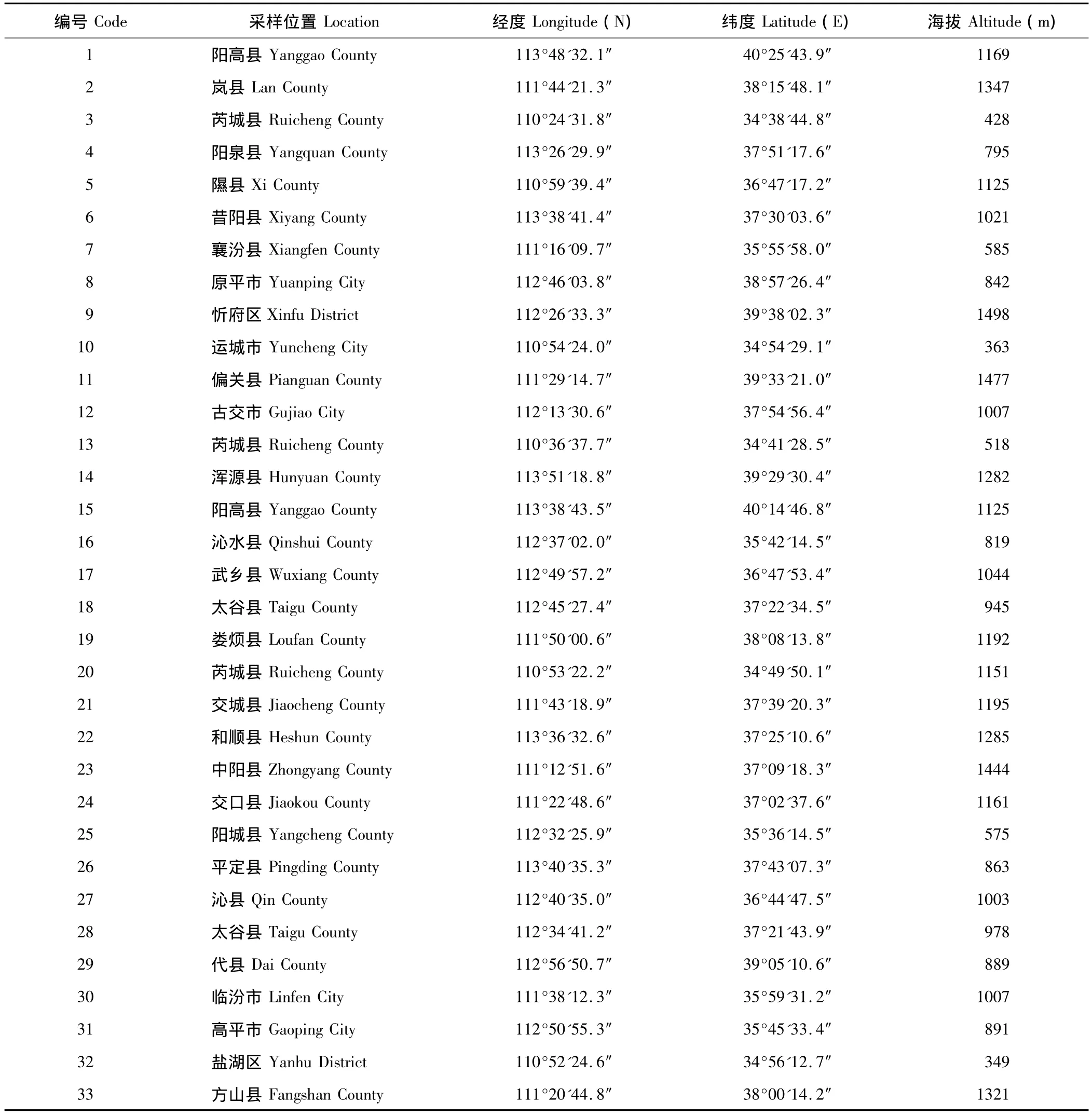
表1 山西白羊草33个种质资源的地理位置Table 1 Geographic location of 33 B.ischaemum germplasm resources in Shanxi
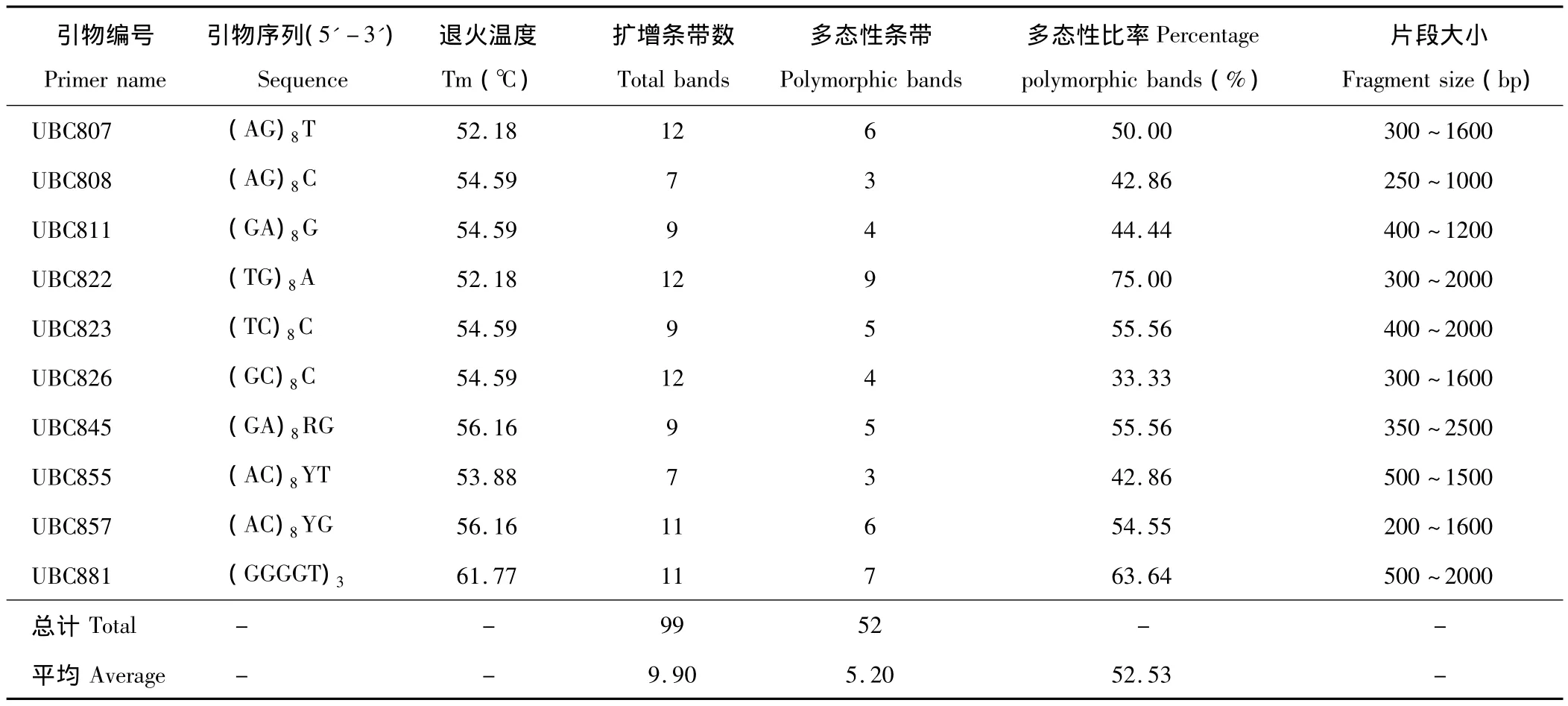
表2 ISSR分析的引物序列及其扩增结果Table 2 Primer sequence used in ISSR analyses and amplified results
1.2.3 PCR扩增及产物的检测[13]采用Eppendorf梯度PCR仪对白羊草进行ISSR-PCR扩增。扩增程序:94℃预变性5 min,94℃变性45 s,50~60℃(温度随引物不同而定)退火60 s,72℃延伸90 s,共35个循环,72℃后延伸5 min,4℃冰箱保存;反应体系:25 μL 体系中 dNTP 0.2 mmol/L、Taq 酶1.0 U、引物0.6 μmol/L、Mg2+2.5 mmol/L、DNA 模板 30 ng、10 × PCR Buffer 2.5 μL。
扩增产物用含有EB的1.5%琼脂糖凝胶电泳分离,90 V电泳1 h左右,用Bio-Rad GelDoc XR凝胶成像系统观察、拍照保存。
1.3 数据统计与分析
用Quantity One软件选取清晰可辨的扩增条带进行统计分析,对于同一引物的扩增产物,迁移率相同的条带记为1个位点,有条带的记为“1”,无带的记为“0”,依次构建原始数据矩阵。采用PopGene 32软件计算居群间等位变异数(Na:Observed number of alleles)、有效等位基因数(Ne:Effective number of alleles)、Nei’s基因多样性(H:Nei’s gene diversity)、Shannon 信息指数(I:Shannon’s information index)、多态位点比率(P:The percentage of polymorphic loci);利用NTSYSpc-2.10c软件计算33个白羊草自然居群间遗传距离(GD)和遗传相似系数(GS),然后用非加权配对算术平均法(UPGMA)构建亲缘关系聚类树状图。
2 结果与分析
2.1 多态性分析
本研究按最适反应体系及程序最终筛选出10条稳定性和重复性好、多态性较高且条带清晰的引物,用于33份白羊草样品的扩增。由表2可知,10条引物中(AC)n、(AG)n、(GA)n各2条,说明白羊草基因中可能存在大量的(AG)二核苷酸重复序列。10条引物共扩增出99条带,大小在200~2500 bp之间(引物UBC823扩增结果见图1),平均每个引物扩增出9.90条带,平均多态性比率(P)为52.53%。其中引物UBC822的扩增条带为12条,多态性比率最高为75.00%;引物UBC826的扩增条带为12条,多态性比率最低为33.33%。33份白羊草材料的遗传变异较稳定,有一定的多态性,ISSR标记能够解释白羊草基因组部分的信息量。
2.2 遗传变异分析
试验利用PopGen 32软件对10条引物分别扩增33份白羊草的99条扩增条带进行了分析,结果表明,等位基因数(Na)为1.5253 ±0.5019,有效等位基因数(Ne)为 1.2941 ±0.3665,Nei’s基因多样性(H)为 0.1723 ±0.1983,Shannon信息指数(I)为0.2590±0.2841,多态性条带比率(P)为52.53%。结果表明,山西境内不同居群的白羊草遗传变异较稳定。用NTSYSpc 1.20c软件计算白羊草自然居群间的遗传距离(GD),其变异为0.0200~0.1988,其中阳高县孤山(1)和忻府区奇村镇(9)之间的遗传距离最小,为0.0200,说明2个居群的白羊草亲缘关系最近;芮城县中条山(20)和运城市盐湖区(32)之间的遗传距离最大,为0.1988,表明2个居群的白羊草之间亲缘关系最远。
2.3 ISSR 聚类分析
利用NTSYSpc 1.20c软件中的SAHN程序和UPGMA算法,根据遗传相似系数(GS)构建33个白羊草种质资源遗传关系聚类图(图2),从图2可以看出,来自不同地域条件下的33份种质资源居群水平的遗传多样性较低,这也与33份材料具有较高的表观相似性一致。如果以0.88作为相似系数分界点,33份材料能分成2类,16和32号分为一类,其余31份材料为一类。沁水县胡底村(16),运城盐湖区(32)为同一类,均来自晋南地区;阳高县孤山(1)、忻府区奇村镇(9)、阳高县重兴镇(15)和娄烦县(19),材料遗传相似度最高,在地理位置上也距离较近都属于晋北地区。
图1 引物UBC823对33份材料DNA的ISSR扩增图Fig.1 The ISSR -PCR amplification electrophoresis of 33 DNA sample by primer UBC822
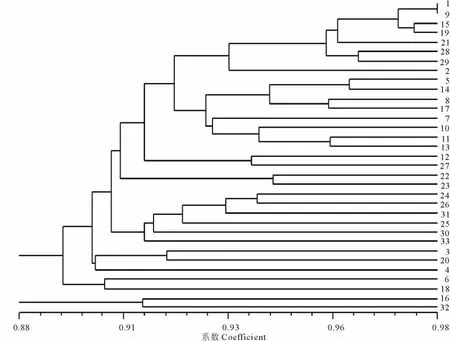
图2 33份白羊草基于ISSR的遗传相似性UPGMA的聚类图Fig.2 UPGMA cluster analysis based on ISSR genetic similarity coefficient among 33 B.ischaemum materials
3 讨论与结论
种质资源遗传变异与地理生态环境之间的关系一直是植物遗传研究中关注的热点。本研究结果显示山西省内白羊草居群间有一定的地域关系,但是遗传距离和地理距离没有显著的相关性。这一方面符合郭敏等[22]、曾亮等[23]的聚类分析呈现一定地域性分布的规律;另一方面也符合孙群等[24]、俞靓等[25]得出的遗传多样性与地域性没有明显关系的规律。
Hamrick和Loveless[26]的研究表明,植物的繁育系统、基因流和种子扩散机制、繁殖方式及自然选择等因素对植物的遗传结构有明显的影响。白羊草既可进行种子繁殖(有性繁殖以及无融合生殖)[2-3,5-6],又可进行营养繁殖[9,27],在天然草地上主要依靠营养繁殖的形式实现种群的补充更新,使其成为群落中的优势种[9,28]。当白羊草进行兼性无融合生殖时,既存在基因的分离和重组,提供了可供自然选择的遗传变异,产生的新的有益基因又可经过无融合生殖迅速占领某个地区,从而补充了因无融合生殖而降低的遗传多样性,提高了种群间的遗传变异水平并降低了种群内的遗传差异。杨艳娟等[29]研究表明高的无融合生殖率可能是造成其种群内遗传多样性较低的原因之一;姚家玲等[30]研究表明专性或高度无融合生殖个体之间,因缺乏有性生殖,没有基因交流。虽然山西省地形较为复杂,境内有山地、丘陵、高原、盆地、台地等多种地貌类型,但是其总面积为15.67 km2,仅占全国总面积的1.6%。风的驱动和人为因素都促进了种子的远距离传播,增大了采样地自然居群间的交配机会,使得山西省内白羊草自然居群间遗传分化较小。
ISSR分子标记是一种基于微卫星序列发展起来的分子标记,具有简便迅速、稳定高效、DNA多态性高,该方法克服了RFLP技术的局限性以及RAPD的假阳性等优点。本研究利用10条ISSR引物对山西省白羊草进行遗传多样性研究,得到52条多态性条带,平均多态性比率(P)52.53%。说明ISSR分子标记法可以区分33个不同居群的白羊草,对其遗传多样性的研究具有一定的意义。本研究利用ISSR分子标记法研究了山西地区33个自然居群的白羊草的遗传多样性,为扩展白羊草的遗传资源,研究、利用白羊草种质资源,发掘新种质,培育白羊草新品种提供了丰富的物质基础。
[1]董宽虎.山西白羊草草地生产性能、种群生态位及草地培育的研究[D].北京:中国农业大学,2004.
[2]Celarier R P.The Cyto-geography of the Bothriochloa ischaemum complex.II.chromosome behavior[J].American Journal of Botany,1957,44(9):729-738.
[3]Brown W V,Emery W H P.Apomixis in the Gramineae,Tribe Andropogoneae:Themeda triandra and Bothriochloa ischaemum[J].Botanical Gazette,1957,118(4):246-253.
[4]肖辅珍,王景林.白羊草无融合生殖现象的研究初报[J].植物学通报,1994,(S1):73.
[5]Ma G H,Huang X L.Cytological and embryological studies on apospory in Bothriochloa ischaemum L.[J].Acta Biologica Hungarica,2007,58(4):421-429.
[6]Wet J M J D,Borgaonkar D S.Aneuploidy and apomixis in Bothriochloa and Dichanthium[J].Botanical Gazette,1963,124(6):437-440.
[7]王洪义,王正文,李凌浩,等.不同生境中克隆植物的繁殖倾向[J].生态学杂志,2005,24(6):670-676.
[8]Gabbard B L,Fowler N L.Wide ecological amplitude of a diversity-reducing invasive grass[J].Biological Invasions,2007,9(2):149-160.
[9]董宽虎,米佳.白羊草种群繁殖的数量特征[J].草地学报,2006,14(3):210-213.
[10]张昌胜,刘国彬,薛萐,等.干旱胁迫和CO2浓度升高条件下白羊草的光合特征[J].应用生态学报,2012,21(11):3009-3015.
[11]袁子成.黄土丘陵沟壑区白羊草群落种多度格局及优势种空间点格局分析[D].杨凌:西北农林科技大学,2012.
[12]徐伟洲,徐炳成,段东平,等.不同水肥条件下白羊草光合生理生态特征研究Ⅲ.叶绿素荧光参数[J].草地学报,2011,19(1):31-37.
[13]李钰莹,董宽虎,王若梦,等.白羊草ISSR-PCR反应体系的建立与优化[J].中国草地学报,2012,34(4):15-20.
[14]Matakis S,Overath R D,Kutil B,et al.Isolation and characterization of microsatellite markers for Bothriochloa ischaemum(Poaceae)[J].American Journal of Botany,2011,98(7):192-194.
[15]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[16]周延清,杨清香,张改娜.生物遗传标记与应用[M].北京:化学工业出版社,2008:3-12.
[17]田青松,韩冰,杨劼,等.96份雀麦属材料遗传多样性的ISSR分析[J].中国草地学报,2010,32(1):18-25.
[18]刘欢,慕平,赵桂琴.燕麦种质资源遗传多样性ISSR研究[J].草业学报,2012,21(4):116-124.
[19]李鸿雁,李志勇,师文贵,等.3种生态型野生扁蓿豆种质资源ISSR与SSR遗传多样性分析[J].草业学报,2012,21(5):107-113.
[20]魏臻武.苜蓿遗传多样性分子标记及其种质资源评价[D].兰州:甘肃农业大学,2003.
[21]刘传虎,周兆喜,周云,等.不同居群龙须草RAPD分析及其分类研究[J].西北植物学报,2006,26(5):915-920.
[22]郭敏,马彦军,李毅.祁连山不同海拔梯度山生柳遗传多样性的SSR分析[J].草业学报,2012,21(5):114-121.
[23]曾亮,袁庆华,王方,等.冰草属植物种质资源遗传多样性的ISSR分析[J].草业学报,2013,22(1):260-267.
[24]孙群,佟汉文,吴波,等.不同种源乌拉尔甘草形态和ISSR遗传多样性研究[J].植物遗传资源学报,2007,8(1):56-63.
[25]俞靓,井赵斌,程积民.陕西省本氏针茅自然种群遗传多样性的ISSR分析[J].草地学报,2012,20(3):512-517.
[26]Hamrick J L,Loveless M D.Associations between the breeding system and the genetic structure of tropical tree populations[J].American Journal of Botany,1987,74(5):642.
[27]国振杰.蒙古高原草原区主要根茎禾草发育及繁殖特性的研究[D].呼和浩特:内蒙古农业大学,2007.
[28]许庆方,董宽虎,史书瑞,等.放牧利用白羊草灌丛草地的植被特征[J].草地学报,2004,12(2):136-139.
[29]杨艳娟,谢世清,孟珍贵,等.濒危药用植物云南黄连传粉生态学研究[J].西北植物学报,2012,32(7):1372-1376.
[30]姚家玲,洪柳,张友德,等.龙须草生态型的划分及其遗传差异的AFLP分析[J].中国农业科学,2004,37(11):1699-1704.

