一种新型长效重组绒毛膜促性腺激素的表达、活性和药代动力学研究
黄 虎, 杨 凡, 吴茂柏, 张玉杰, 钟 翎,3, 侯永敏,
(1. 中山大学药学院,广州 510006; 2. 广州优联康医药科技有限公司, 广州 510006;3. 深圳市药品不良反应监测中心, 深圳 518024)
一种新型长效重组绒毛膜促性腺激素的表达、活性和药代动力学研究
黄 虎1, 杨 凡1, 吴茂柏2, 张玉杰2, 钟 翎1,3, 侯永敏1,2
(1. 中山大学药学院,广州 510006; 2. 广州优联康医药科技有限公司, 广州 510006;3. 深圳市药品不良反应监测中心, 深圳 518024)
目的 构建含有Fc片段的绒毛膜促性腺激素(human chorionic gonadotropin, hCG)新型长效重组hCG-Fc融合蛋白,可显著延长其在血液中的半衰期,有利于提高患者用药依从性。方法 首次将Fc DNA片段有序连接到hCG基因3′端,构建hCG-Fc表达载体并将其稳定表达在哺乳动物细胞,通过无血清悬浮细胞培养和基于亲和层析的蛋白纯化,制备了新型重组hCG-Fc融合蛋白。检测其分子量、ELISA免疫活性和体内生物活性,并测定其在大鼠体内血循环半衰期。结果 重组融合蛋白分子量与理论推断值相当,ELISA活性为2 965 IU/mg,体内生物活性为2 288 IU/mg,消除半衰期为174 h。结论 hCG-Fc融合蛋白构建表达成功,且具有显著的体内外活性,药代动力学分析显示hCG-Fc重组融合蛋白半衰期是重组hCG的近6倍。这种新型长效融合蛋白在临床上可大大减少注射次数,提高患者用药依从性,具有显著的社会和经济效益。
重组绒毛膜促性腺激素(γhCG); Fc融合蛋白; 长效; 药代动力学
绒毛膜促性腺激素(hCG)是一种高度糖基化的蛋白质,由胎盘的滋养层细胞分泌。其结构为异源二聚体,α亚基与LH、FSH和TSH的α亚基相同,β亚基则是其特有的[1~2]。它是一种重要的生殖激素,对于有排卵障碍接受辅助生殖技术(ART)如胚胎移植的女性,可以促使卵泡最后成熟并诱发排卵[3]。其作用机制是:在怀孕早期,hCG与LH/hCG受体结合通过cAMP-磷脂酶C/三磷酸肌醇途径介导的信号通路刺激黄体分泌孕酮,孕酮使子宫形成一根粗血管和微血管(即脐带)以便供养生长中的胎儿[4]。
目前上市的hCG包括尿源hCG和重组hCG,尿源产品具有来源有限、潜在的病毒污染等缺陷,不被欧美等发达国家接受,重组蛋白可克服尿源蛋白产品的上述缺陷,已成为新药开发的重要趋势。重组hCG(Recombinant hCG)于2000年首次在美国上市,是通过哺乳动物细胞发酵技术生产的基因工程产品。但其在人体内的血浆半衰期仅为29 h,当用于治疗无排卵性不育症时,患者必须每日1次肌肉注射hCG,通常需要连续注射5 d,这样导致患者的治疗成本较高同时患者的依从性较差[5]。因此,如何延长hCG在人体内的血浆半衰期,制备长效重组hCG是一个很有价值的课题。
IgG类免疫球蛋白是人类血液中最丰富的蛋白质,它们的血浆半衰期高达21 d,而Fc片段是IgG保持体内较长半衰期的主要原因,同时具有稳定蛋白的作用[6]。
本研究将Fc片段有序连接到hCG羧基端,形成新型hCG-Fc融合蛋白,利用分子生物学技术构建hCG-Fc表达载体,转染到中国仓鼠卵巢细胞(Chinese Hamster Ovary cell, 简称CHO)中并实现其稳定表达,通过无血清悬浮细胞培养和蛋白纯化获得该融合蛋白。动物试验测定结果表明, 本研究中HCG-Fc融合蛋白具有显著的体内生物活性,药物代谢动力学测定其半衰期是重组hCG的近6倍。
1 材料与方法
1.1 材料
1.1.1 实验动物 3周龄雄性SPF级SD大鼠,体质量40~45 g; 8周龄雄性SPF级SD大鼠,体质量200~210 g, 均购自广东省广州市中山大学实验动物中心[SCXK(粤) 2011-0029],在广东省广州市中山大学实验动物中心SPF设施[SYXK(粤)2011-0112]饲养, 并按实验动物使用的3R原则给予人道关怀。
1.1.2 主要试剂、标准品及仪器 各种限制性内切酶、T4 DNA连接酶和DNA Marker均购自TaKaRa公司; LipofectamineTM 2000脂质体购自Invitrogen公司; 预染蛋白marker购自Thermo公司; 福林酚试剂购自北京普博欣公司; 兔抗人hCGαβ多抗(ab54410)购自Abcam公司; HRP标记的抗兔二抗购自ROCKLAND公司; HRP AffiniPure Goat Anti-Human IgG(H+L)(E030170-02)购自EarthOx公司; Protein A购自GE Health公司; HCG ELISA试剂盒(BC-1027)购自BioCheck公司; 《绒毛膜促性腺激素》标准品(批号为150513-200409,规格为60 IU/支)购自国家标准品网。
Bio-Rad蛋白纯化系统;Bio-Rad电泳系统;Tanon 1220型全自动数码凝胶图像分析系统。
1.1.3 载体和细胞 质粒pUC57和真核表达载体pCBAEA3为Invitrogen公司产品; CHO细胞为本实验室保存。
1.2 方法
1.2.1 融合基因hCG-Fc和表达载体的构建 编码单链HCG前导肽和成熟蛋白的基因序列,以及编码柔性肽接头和人IgG Fc区域Fc的基因序列均是人工优化过的CHO细胞偏爱密码子,经化学合成办法获得(上海英骏生物技术有限公司)。限制性酶切各合成的基因片段和中间质粒载体后,T4 DNA连接酶连接构建成中间质粒。从中间质粒中酶切出L-Fc片段和hCG全长片段,T4 DNA连接酶连接至真核载体pCBAEA3的多克隆位点,构成表达载体pCBAEA3-hCG-Fc。
1.2.2 稳定细胞株的构建与表达载体的鉴定 将表达载体pCBAEA3-HCG-Fc转染入DHFR酶缺陷型CHO宿主细胞(CHO朌HFR-), 采用电穿孔方法进行转染, 使用960 μFd电容的Gene Pulser Electroporator(Bio-Rad Laboratories, Hercules, CA),将其电场设置为250 V,在比色杯内的2×107~5×107个细胞中加入10 μg用PvuI线性化的质粒DNA。在转染2 d后,将培养基改成含100 μg/ml Zeocin的生长培养基,并通过递增浓度的MTX进行加压筛选(最高10 μmol/ml)获得稳定的hCG-Fc细胞株。提取质粒并进行NheI/EcoRI双酶切鉴定表达载体,并采用ELISA法检测hCG-Fc的表达。
1.2.3 细胞培养和hCG-Fc融合蛋白纯化 将表达hCG-Fc的CHO细胞接入摇瓶,用无血清基础培养基逐步扩增,每日稀释至密度0.5×106/ml,当体积达到500 ml时, 开始加入浓缩培养基,培养20 d后,细胞离心取上清纯化。
将收集的细胞培养液上清, 上样至磷酸盐缓冲液(PBS)平衡的Protein A柱, 用PBS洗涤该柱, 直至OD280值低于0.01, 再用20 mmol/L、pH为4.0的醋酸钠缓冲液洗脱结合的重组hCG-Fc融合蛋白, 最后用pH10.0的1 mol/L Tris-HCl缓冲液中和活性收集液。洗脱所得样品经超滤将缓冲液换成20 mmol/L PB,pH7.0, 4 ℃保存, 0.22 μm滤膜过滤后分装, -80℃保存。
1.2.4 蛋白分析鉴定 Lowry法测定纯化所得融合蛋白浓度。SDS-PAGE法检测Protein A纯化结果、所得融合蛋白的纯度和表观分子量。分离胶浓度为8%,点样10 μg。Western Blotting鉴定免疫特性。
1.2.5 ELISA活性和体内活性测定 hCG ELISA试剂盒(BC-1027)检测所得hCG-Fc融合蛋白的体外ELISA活性。参考Chorionic Gonadotrophin Assay(EP 7.0)[7]方法检测体内生物活性。3周龄雄性SPF级SD大鼠随机分成标准品组、供试品组和空白组,其中标准品组和供试品组分别设置3个剂量组,总剂量分别为1 IU、2 IU、4 IU, 每组6只。
对各组实验动物进行颈部皮下注射相应的剂量药品,每日同一时间注射一次,每次0.5 ml,连续注射4 d。于最后一次注射后24 h,将动物引颈处死,解剖后取其精囊腺,除去精囊腺周围的脂肪组织等杂物,在滤纸上轻轻吸干表面的水分后在天平上精确称量,记录精囊腺重量。供试品效价测定结果按《中国药典2010版 附录XIV生物检定统计法》量反应平行线测定法,进行可靠性测验。可靠性测验通过后,计算效价和平均可信限率,并计算比活。
1.2.6 大鼠体内半衰期测定和初步药代动力学分析实验动物分组: 将8周龄雄性SPF级SD大鼠分为hCG-Fc样品组和空白组, 各组动物数量分别为3只和1只。给药剂量: hCG-Fc样品组依据前面ELISA方法测试出的活性确定给药剂量为1 000 IU/kg,样品缓冲液为灭菌生理盐水; 空白组注射相同体积的生理盐水。给药方式: 颈部皮下注射, 0.5 ml/100g 体质量。血样采集及处理: hCG-Fc样品组和空白组分别在给药后1 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h、36 h、48 h、60 h、72 h、96 h、144 h、264 h、312 h、384 h、432 h、552 h 采血。每次采血0.3 ml, 室温下静置30 min, 3 000 r/min常温离心10 min,吸取上清液于另一灭菌EP管中,-80 ℃保存待测。血样检测及数据处理: 采用ELISA法(同1.2.5)测定各时间点血液中hCG免疫活性,并使用药代动力学计算软件PKSolver[8]计算药代动力学参数。
2 结果
2.1 融合基因hCG-Fc结构和真核表达载体中hCG-Fc基因序列验证
hCG-Fc全长基因由编码含有前导肽的人hCGβ亚基, 不含前导肽的人hCGα亚基的核苷酸序列,柔性肽接头核苷酸序列和人IgG2恒定区变体Fc的核苷酸序列融合而成。该融合蛋白的基因序列从5′到3′依次是编码含前导肽的人hCGβ亚基,编码不含前导肽的人hCGα亚基,编码肽接头序列L和编码人IgG2恒定区Fc(图1)。

图 1 hCG-Fc融合蛋白的基因序列Figure 1 Gene sequence of hCG-Fc fusion protein
对筛选得到的重组子pCBAEA3-HCG-Fc进行NheI/EcoRI双酶切鉴定,得到1 491bp的产物,大小与预期的相符(图2)。经测序验证hCG-Fc基因序列正确。
2.2 hCG-Fc 融合蛋白在细胞中的表达
hCG-Fc在CHO细胞中的表达和生长状况如图3,在基础无血清培养基扩增8 d后加入浓缩无血清培养基继续培养,细胞密度最高可达1.5×107个/ml,培养20 d,细胞表达量为1.25 g/L。
2.3 hCG-Fc融合蛋白分析鉴定
Lowry法检测出hCG-Fc样品的蛋白浓度为2.64 mg/ml。

图 2 重组质粒pCBAEA3-hCG-Fc的限制性酶切分析Figure 2 Restriction enzyme analysis of recombinant plasmid pCBAEA3-hCG-Fc
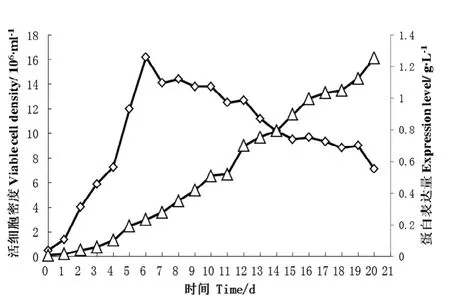
图 3 表达hCG-Fc融合蛋白的CHO细胞生长曲线图Figure 3 Growth curve of CHO cells expressed hCG-Fc fusion protein

图 4 hCGαβ多抗(a)和Fc单抗(b)免疫鉴定hCG-Fc融合蛋白Figure 4 Identification of hCG-Fc protein by Western blotting with anti-hCGαβ polyclonal antibody (a) and anti-Fc monoclonal antibody (b)
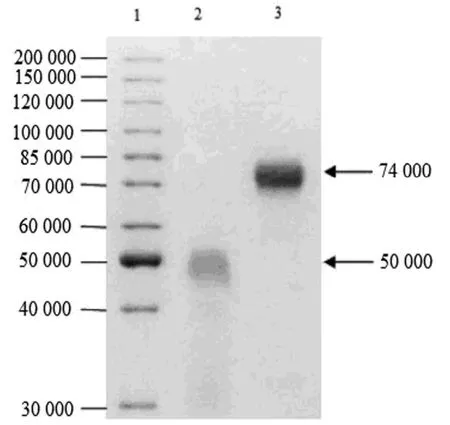
图5 hCG-Fc融合蛋白的SDS-PAGE纯度和分子量分析Figure 5 Analysis of purity and molecular weight of hCG-Fc protein by SDS-PAGE
选用人尿来源hCG(uhCG)为对照,采用兔抗人hCG徕多抗和HRP AffiniPure Goat Anti-Human IgG(H+L)对纯化后的HCG-Fc样品进行Western Blotting分析,结果如图4, uhCG和hCG-Fc样品分别在50 000和74 000显示免疫杂交带,与理论推导值一致,验证表达的蛋白为hCG-Fc融合蛋白。SDS-PAGE进一步分析(图5)表明hCG-Fc融合蛋白分子量为74 000,对照uhCG分子量为50 000。
2.4 体内外活性分析
ELISA测得hCG-Fc融合蛋白的体外活性为7 827 IU/ml。数据结果如图6,首先做出标准曲线-二次回归曲线,然后将样品的OD450值带回回归曲线求出活性回归值,再乘以稀释倍数,即得到体外活性。结合Lowry法测得的浓度采用公式:体外比活性(IU/mg)=实测体外活性(IU/ml)/蛋白样品的浓度(mg/ml)可算出所得的hCG-Fc融合蛋白体外ELISA比活性为2 965 IU/mg。
根据体外活性预估hCG-Fc融合蛋白样品的体内活性为6 990 IU/ml, 精囊腺增重法测得的数据显示标准组和样品组的三个剂量的各个剂量组的精囊腺湿重均有显著性差异, 与空白对照组之间均有显著性差异, 而它们的对应剂量组之间(如标准组的低剂量组与样品组的低剂量组之间等)无显著性差异, 标准组和样品组的精囊腺重曲线见图7。由此说明此次实验所得数据可用作估计活性的准确计算。其方差分析和活性计算结果如图8, 方差分析结果显示检验的各项指标均符合规定,活性计算结果也符合要求, 因此所计算的体内活性即是hCG-Fc融合蛋白样品的准确的体内活性。结合Lowry法测得的浓度采用公式: 体内比活性(IU/mg)=实测体内活性(IU/ml)/蛋白样品的浓度(mg/ml)可算出所得hCG-Fc融合蛋白体内比活性为2 288 IU/mg。
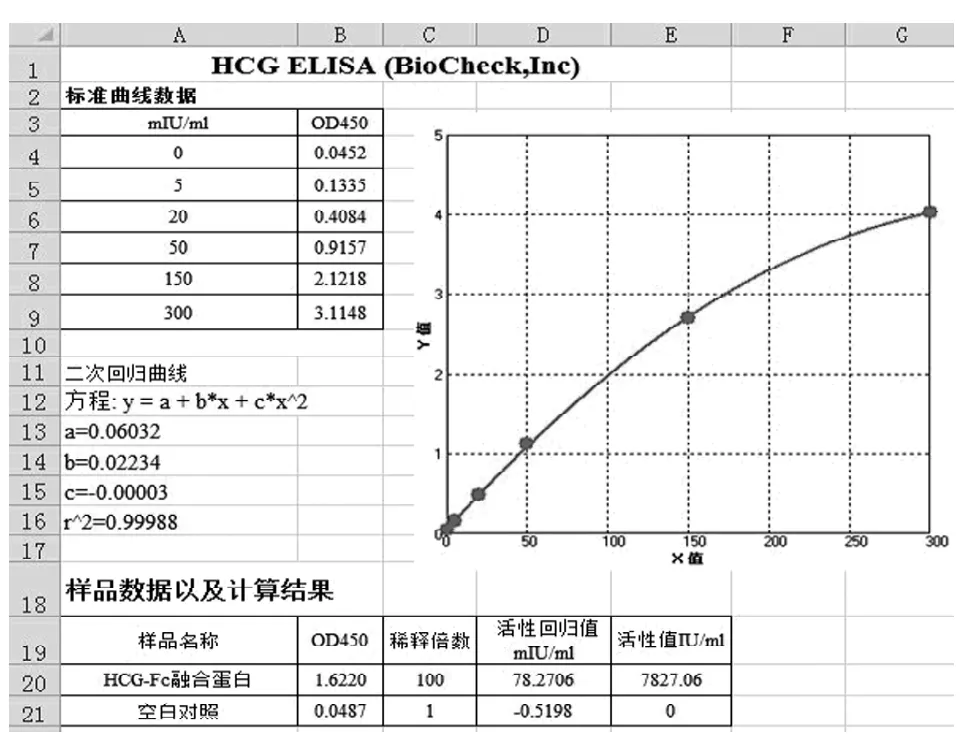
图 6 hCG-Fc融合蛋白的ELISA活性分析Figure 6 ELISA analysis of hCG-Fc fusion protein
2.5 大鼠体内药代动力学初步分析
对大鼠单次皮下注射hCG-Fc融合蛋白,进行血药浓度及药代动力学分析。hCG-Fc融合蛋白组血药浓度-时间曲线如图9, 空白组大鼠在实验期间血药浓度和实验组大鼠在0 h处的血药浓度均为0,表明该实验本底影响极小,可忽略不计。通过PKSolver对血药浓度进行计算,分析结果见表1,显示hCG-Fc消除半衰期为174 h,为已报道重组hCG半衰期(29 h)[9]的6倍。

图 7 hCG-Fc体内活性测试各组精囊腺重曲线Figure 7 Seminal vesicle weight curve of hCG-Fc in vivo activty test

图 8 hCG-Fc体内活性的方差分析和结果估算Figure 8 Anova of in vivo activity of hCG-Fc
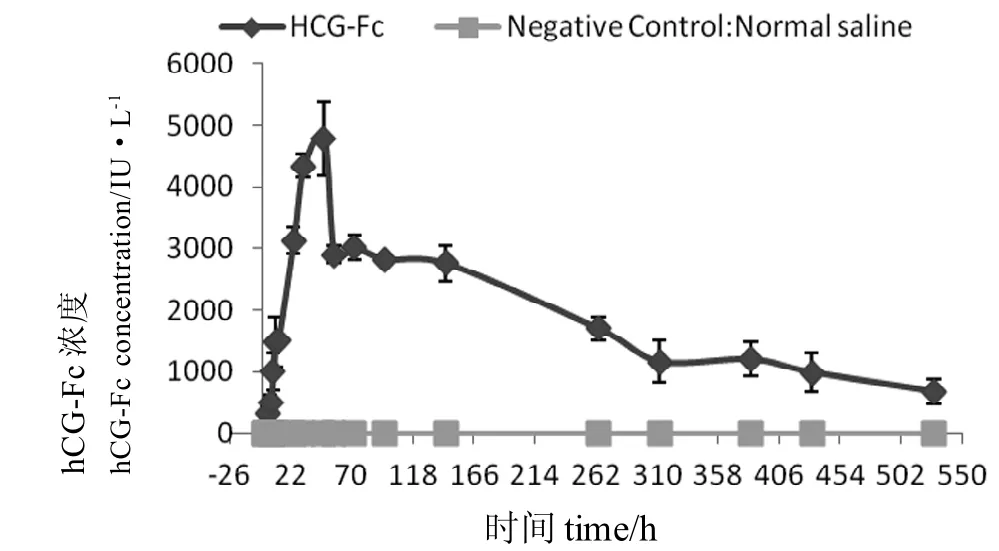
图 9 大鼠皮下单次注射hCG-Fc的药时曲线Figure 9 Concentration-Time curve of hCG-Fc protein by single-subcutaneous injection into rats
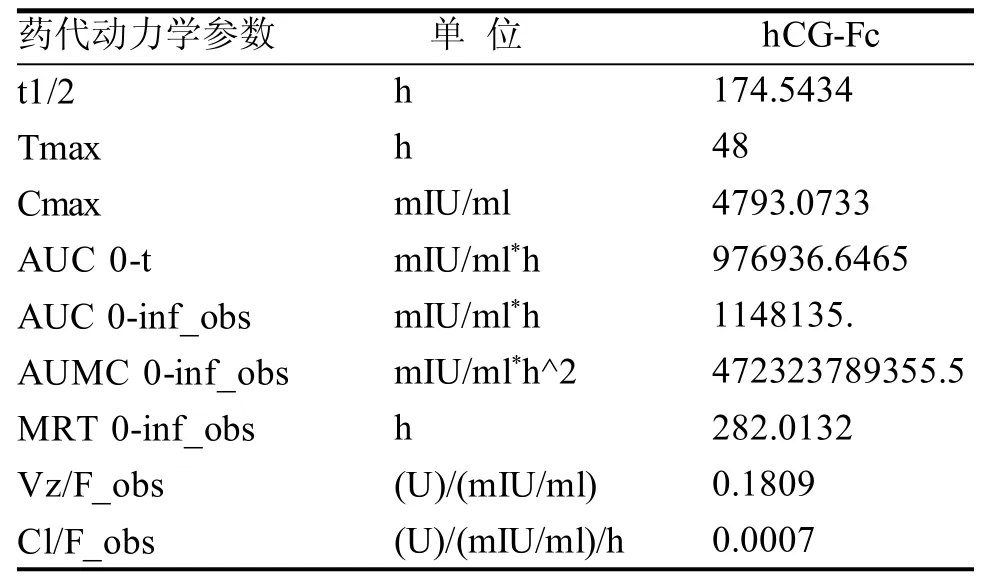
表 1 大鼠皮下单次注射hCG-Fc后的药代动力学分析Table 1 Pharmacokinetic analysis of hCG-Fc by single-subcutaneous injection into rats
3 讨论
绒毛膜促性腺激素已广泛应用于不孕不育的治疗,目前临床上应用的hCG主要分为两大类:尿来源hCG和重组hCG。无论是尿来源hCG还是重组hCG,病人在接收治疗时需要频繁注射。因此为了减少给药次数和频繁注射疼痛,提高患者依从性,有必要进行蛋白质药物的长效化研究。
重组蛋白质药物的长效化研究正是生物制药的一个重要领域[10]。已有研究表明IgG中Fc片段可延长其融合蛋白的半衰期,提高Fc融合蛋白的稳定性。Israel等提出,血液中免疫球蛋白之所以能长时间存在,FcRn发挥了重要作用,FcRn能保护IgG不被组织细胞中的溶酶体降解[11]。大量研究表明Fc融合蛋白体内半衰期都有不同程度的延长,如 rhEPO-L-Fc[12]和 FIX-Fc[13]等。
本研究目的是制备一种新型的长效hCG产品,以克服现有hCG产品的缺陷。如能将IgG的Fc区域与hCG进行有序的结合并形成有功效的融合蛋白,理论上该hCG-Fc融合蛋白便可在一定程度上延长半衰期。另一方面,Fc片段也可能会不同程度影响目标蛋白的生物活性甚至使目标蛋白完全失去活性,作者的预实验表明,有的Fc融合蛋白完全没有体内外活性。因此, 如何形成有功效的Fc融合蛋白需要解决以下几个关键问题: (1)hCG两个亚基与Fc的有序融合: 我们和研究表明, hCG-Fc融合蛋白的氨基酸序列从N端到C端依次包含hCGβ亚基、hCGα亚基、肽接头和人IgG2 Fc片段,通过合适的肽接头进行有序的连接,可使融合蛋白高级结构具有正确的构型; (2)人IgG Fc种类的选择:我们希望Fc片段的插入不会影响hCG活性,在四种人IgG同种型(IgG1、IgG2、IgG3、IgG4)中,人IgG2与FcγRs几乎不结合,其Fc区域介导不良效应子功能最小化,因此Fc片段是无活性的,从而不影响目标蛋白hCG活性; (3)Fc片段在目标蛋白中的插入位置: 考虑到目前国内外批准的Fc融合蛋白生物药均为Fc位于目标蛋白的羧基端,本研究将Fc片段通过肽接头连接到hCG羧基端; (4)重组目标蛋白的表达系统: 由于hCG为糖蛋白,糖基化对hCG的体内活性是必需的,因此我们选择哺乳动物CHO细胞表达重组蛋白,众所周知,CHO细胞是当今表达生产生物药最为FDA接受的表达系统。
本研究所得HCG-Fc融合蛋白的体外ELISA比活性和体内比活性均较uhCG的低。其具体原因可能有以下几点: ①本研究中使用的体内活性检测方法是直接采用欧洲药典中uhCG的检测方法,给药和取材的间隔时间仅为24 h,而根据本研究中药代动力学实验的结果,hCG-Fc融合蛋白的半衰期比文献报道的hCG半衰期提高了5倍,因此,直接采用该方法进行活性测定可能并不准确,也许只检测到其实际活性中的小部分。在后续的研究中,我们将进一步开展体内活性的方法学研究,以得到HCG-Fc融合蛋白尽量客观的活性。②hCG-Fc融合蛋白的分子量约为uhCG的1.5倍,因此相同的蛋白量下hCG-Fc融合蛋白含有活性中心(即hCG)的摩尔数仅为uhCG的2/3,如果从相同摩尔数的角度来计算,hCG-Fc融合蛋白的比活性是高于uhCG的比活性的; ③细胞培养和纯化工艺还有待进一步完善,需要通过优化表达细胞株和纯化方法来提高其高活性成分的含量以提高效价。
综上所述, 本研究首次在哺乳动物细胞稳定表达了有功能的新型重组hCG-Fc融合蛋白。该融合蛋白具有较高生物活性且大鼠体内半衰期延长达到了174 h, 比文献报道的uhCG半衰期29 h提高了5倍, hCG-Fc能长期地有效地在体内发挥药效, 达到长效药物的目的。今后的研究方向主要包括按照生物药申报程序进行动物药效药理试验,完成临床研究,推进其产业化和上市步伐。这种新型长效融合蛋白在临床上可大大减少注射次数和病人痛苦, 提高患者用药依从性,具有显著的社会和经济效益。
[1] Głodek A, Kubiczak M, Urbaniak P, et al. Human chorionic gonadotropin-a well-known hormone with unknown functions [J]. Ginekol Pol, 2012, 83(10):766-771.
[2] Fiddes JC, Goodman HM. Isolation, cloning and sequence analysis of the cDNA for the alpha subunit of human chorionic gonadotropin [J]. Nature, 1979, 281(5730):351-356.
[3] Weedon-Fekjćr MS, Taskén K. Review: Spatiotemporal dynamics of hCG/cAMP signaling and regulation of placental function [J]. Placenta, 2012, 33(Suppl):S87-91.
[4] 马从顺, 邢福祺. 人绒毛膜促性腺激素在辅助生殖技术中的研究进展[J]. 国际生殖健康/ 计划生育杂志, 2011, 30(2):111-114.
[5] Chang P, Kenley S, Burns T, et al. Recombinant human chorionic gonadotropin (rhCG) in assisted reproductive technology: Results of a clinical trial comparing two doses of rhCG (Ovidrel) to urinary hCG (Profasi) for induction of final follicular maturation in in vitro fertilization-embryo transfer [J]. Fertil Steril, 2001, 76(1):67-74.
[6] Olafsen T. Fc engineering: serum half-life modulation through FcRn binding [J]. Methods Mol Biol, 2012,90(7):537-556.
[7] Council of Europe Strasbourg. European Pharmacopoeia seventh edition [S]. 2011, Vol I:0498.
[8] Yong Zhang, Meirong Huo, Jianping, Zhou et al. PKSolver:An add-in program for pharmacokinetic and pharmacodynamic data analysis in Microsoft Excel [J]. Comput Methods Programs Biomed, 2010, 99(11):306-314.
[9] Kwang SS, Jin WY, Kyu HN, et al. Evaluation of process efficiency and bioequivalence of biosimilar recombinant human chorionic gonadotropin (rhCG) [J]. Bio Drugs, 2011,26(2):115-127.
[10] 边雷, 石屹峰. 蛋白质药物长效化技术的现状与进展[J].中国生物工程杂志, 2009, 29(1):114-118.
[11] Israel EJ, Wilsker DF, Hayes KC, et al. Increased clearance of IgG in mice that lack beta 2-microglobulin: possible protective role of FcRn [J]. Immunology,1996, 89(4):573-578.
[12] Zhu Q, Huang Z, Huang Y, et al. Expression of rhEPO-L-Fc fusion protein and analysis of its bioactivity and pharmacokinetics [J]. Sheng Wu Gong Cheng Xue Bao, 2008, 24(11):1874-1879.
[13] Peter RT, Low SC, Kamphaus GD, et al. Prolonged activity of factor IX as a monomeric Fc fusion protein [J]. Blood,2010, 115(10):2057-2064.
Expression, Activity and Pharmacokinetic Study of A Novel Long-Acting Recombinant Human Chorionic Gonadotropin
HUANG Hu1, YANG Fan1, WU Mao-bo2, ZHANG Yu-jie2, ZHONG Ling1,3, HOU Yong-min1,2
(1. School of Pharmaceutical Sciences, Sun Yat-Sen University, Guangzhou 510006, China;2. Unicomed Pharma Ltd. Guangzhou 510006, China;3. Shenzhen Drug Administration, Shenzhen 518024, China)
ObjectiveTo make a novel long-acting hCG-Fc fusion protein that could prolong hCG’s serum half-life and improve the patients’ compliance.MethodsThe expression vector was constructed by the gene engineering that contains the gene encoding hCG-Fc which Fc fragment was fused into the 3’ end of hCG gene. The expression vector was transfected into CHO cells and stable clones were selected to express hCG-Fc fusion protein specifically. The serum free culture medium of cells grown was collected for protein purification using affinity based chromatography. The analysis of purified protein was performed as follow: molecular weight by SDS-PAGE, protein identity by Western blotting,activity in vitro by ELISA, activity in vivo by seminal vesicle weight gain assay, and serum half-life by single-subcutaneous injection into rats.ResultsThe molecular weight of hCG-Fc fusion protein is similar to the theoretical size. The ELISA activity of hCG-Fc protein is 2 965 IU/mg and in vivo activity is 2 288 IU/mg. The serum half-life in rats is 174 h.ConclusionshCG-Fc fusion protein is active and functional based on its in vitro activity and in vivo activity. Pharmacokinetic study shows that its serum half-life is almost six times of the recombinant hCG’s. This novel long-acting fusion protein can significantly reduce the times of injection and improve the patients’ compliance of medicine, and also could have huge social and economic benefits.
Recombinant human chorionic gonadotropin (rhCG); Fc fusion protein; Long Acting;Pharmacokinetics
Q819 Q95-33
A
1674-5817(2014)02-0113-07
10.3969/j.issn.1674-5817.2014.02.007
2014-01-09
广州市创业领军人才创业启动基金项目(LCY201305)
黄 虎, 男(1987-), 硕士研究生, 研究方向: 微生物与生化药学。E-mail: edghu@sina.com
钟 翎(1963-), 女, 教授, 博士, 研究方向: 生物化学与分子生物学。
E-mail: lsszhl@mail.sysu.edu.cn
侯永敏(1965-), 男, 教授, 博士, 研究方向: 医药生化与分子生物学。E-mail:ray091609@163.com

