广州蛇根草化学成分及其抗菌活性的研究
李维峰,宋启示,项 伟,王娅玲
1云南热带作物职业学院,普洱 665000;2 中国科学院西双版纳热带植物园,昆明 650223
广州蛇根草为茜草科Rubiaceae 蛇根草属植物Ophiorrhiza cantoniensis Hance 的全草,主要分布于云南、广州、海南、广西、贵州等地。《中药大辞典》记载:蛇根草(日本蛇根草)具有“活血化淤。治疗治咳嗽、劳伤吐血,跌打,月经不调”的功效。目前对于蛇根草属植物化学成分的研究比较少,国内仅见有对蛇根草、日本蛇根草等化学成分研究的报道[1-4],研究发现该属植物含有主要药用成分为喜树碱、10-甲氧基喜树碱、谷甾醇和麦角甾醇等化合物[5]。
为了探明广州蛇根草有效成分及其抗菌活性,笔者对其全草进行了化学成分研究,从中分离到了3 个化合物,分别鉴定为:β-谷甾醇(1)、β-胡萝卜苷(2)、喜果苷(3)。其中化合物1、2、3 均为首次从该植物中得到;并且采用滤纸片法对广州蛇根草乙醇提取物的不同极性萃取部分和上述三种化合物进行了抗菌试验,发现其乙醇提取物的石油醚萃取部分和氯仿萃取部分具有较强的抗菌活性。
1 材料与方法
1.1 材料
广州蛇根草样品采集于云南省勐腊县勐仑镇,经中国科学院西双版纳热带植物园植物标本室鉴定为茜草科植物广州蛇根草(Ophiorrhiza cantoniensis Hance)带花全草。样品标本保存于中国科学院西双版纳热带植物园民族药与功能食品组。
1.2 仪器
熔点在SGW X-4 显微熔点仪上测定(温度计未校正);核磁共振谱用Bruker AM-400、DRX-500 测定,TMS 为内标;质谱用英国VG 公司VG-AutoSpec-3000 型测定;柱层析硅胶(200~300 目)、薄层硅胶板(50 mm×100 mm)均为青岛海洋化工厂生产;大孔树脂DM-130 由山东鲁抗医药股份有限公司生产;反向材料使用MCI。无菌操作台(上海凌初环保仪器有限公司公司),智能光照培养箱(宁波东南仪器有限公司),压力蒸汽灭菌器(上海医用核子仪器厂),纯水机(北京普析)。
1.3 菌种与培养基
供试菌株包括真菌和细菌两大类,其中细菌有枯草芽孢杆菌(Bacillus subtlis)、藤黄微球菌(Micrococcus luteus)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、藤黄八叠球菌(Sarcina ureae);真菌有白色念珠菌(Candida albicans)、黑曲霉(Aspergillus niger)、清酒酵母菌(Saccharomyces sake)(购自中国药品生物制品检定所)。
真菌用马铃薯培养基(PDA 培养基)培养,细菌用牛肉膏蛋白胨培养基培养。
PDA 培养基:用去皮马铃薯200 g 切成薄片煮沸30 min,然后用纱布过滤,再加葡萄糖20 g 及琼脂15 g,补水至1000 mL。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1000 mL,琼脂15 g,混合后调PH 值至7.0~7.2。
1.4 蛇根草化学成分的提取与分离
广州蛇根草全草2.85 kg,粉碎后采用浸渍法用95%乙醇于室温下提取3 次,每次浸泡24 h。合并提取液,过滤,减压浓缩、蒸干得到乙醇浸膏285.5 g,浸膏用5 倍量的水分散均匀后依次用石油醚、氯仿、正丁醇萃取,每种溶剂各萃取4 次,得到石油醚萃取物42 g,氯仿萃取物27.9 g,正丁醇萃取物140 g,此外还有剩余的水溶部分。石油醚部分以三倍量硅胶(100 目)拌样后以1.2 kg(200~300)目硅胶柱层析,石油醚-丙酮混合溶剂梯度洗脱(1∶0,9∶1,8∶2,7∶3,5∶5,3∶7,0∶1),从而得到化合物1(3.2 g)。
氯仿萃取物以三倍量硅胶(100 目)拌样以后以900 g 硅胶(200~300 目)柱层析,石油醚-丙酮混合溶剂梯度洗脱(1∶0,9∶1,8∶2,7∶3,5∶5,3∶7,0∶1),从而得到化合物2(0.15 g)。
正丁醇萃取物用水溶解之后上大孔树脂柱分段,水-甲醇混合溶剂梯度洗脱(8∶2,7∶3,0∶1);其中水:甲醇=7:3 洗脱剂冲下部分上反向MCI 进行柱层析。从而得到化合物3(0.35 g)。
2 结果与分析
2.1 化学成分鉴定
化合物1 C29H50O,M414,无色片状结晶(丙酮),mp.137~139 ℃,Lieberman-Buchard 反应(醋酐-浓硫酸反应)显紫红色后迅速变为绿色,Salkowski 反应(浓硫酸-氯仿反应)呈阳性;1H NMR(500 MHz,CDCl3)谱显示有δ5.28(1H,d,J=5.1 Hz,6-H)烯氢信号和δ3.45(1H,m,3-αH)连氧碳上的氢信号,δ0.94(3H,s,19CH3)和δ0.61(3H,s,18CH3)为角甲基上的氢信号,δ0.85(3H,d,J=6.3 Hz),δ0.78(3H,t,J=6.8 Hz),δ0.77(3H,d,J=6.6 Hz)为甲基上的信号;该化合物与β-谷甾醇对照品共进行薄层层析,石油醚:乙酸乙酯(4∶1)和石油醚:乙醚(2∶1)展开,Rf值一致,以上信息及数据与参考文献报导一致[6,7],确定该化合物为β-谷甾醇(β-sitosterol)。
化合物2 C35H60O6,M576,白色无定形粉末(MeOH),mp.281~282 ℃,Lieberman-Buchard 反应(醋酐-浓硫酸反应)阳性,Molish 反应阳性,1H NMR(500 MHz,DMSO)谱有δ5.29(1H,brs,6-H)烯氢信号,δ4.18(1H,d,J=7.2 Hz)糖基端上氢信号,呈β构型,δ:2.84~δ4.20 范围内存在糖基上的多个质子。δ:0.99 (3H,s,19CH3)和δ:0.63 (3H,s,18CH3)为角甲基上的氢信号,δ:0.88(3H,d,J=6.3 Hz),δ:0.86 (3H,t,J=6.0 Hz),δ:0.81(3H,d,J=5.4 Hz)和δ:0.79 (3H,d,J=6.0 Hz)为甲基上的氢信号;13C NMR(500 MHz,DMSO)δ:27.94(t,C-2),73.46(d,C-3),42.3(t,C-4),140.46(s,C-5),121.16(d,C-6),31.42(t,C-7),31.42(d,C-8),49.62(d,C-9),36.51(s,C-10),20.59(t,C-11),39.85(t,C-12),41.85(s,C-13),56.18(d,C-14),24.33(t,C-15),29.26(t,C-16),55.45(d,C-17),11.65(q,C-18),19.07(q,C-19),36.15(d,C-20),18.61(q,C-21),33.94(t,C-22),25.42(t,C-23),45.85(d,C-24),29.16(d,C-25),18.93(q,C-26),19.68(q,C-27),22.51(t,C-28),11.77(q,C-29),100.82(d,C-1'),76.98(d,C-2'),76.77(d,C-3'),76.71(d,C-4'),73.46(d,C-5'),61.10(t,C-6')。以上光谱数据与文献[8]报道对照,确定该化合物为β-胡萝卜苷(daucosterol)。
化合物3 C26H30N2O8,M498,无色针状结晶(MeOH),mp.201~202 ℃,1H NMR(C5D5N,400 MHz)δ:7.55(1H,d,J=7.9 Hz,H-9),7.28(1H,m,H-17),7.24(1H,d,J=7.9 Hz,H-12),4.71(1H,d,J=7.9 Hz,H-1'),2.71(2H,m,H-20),2.33(1H,dt,J=13.2,3.8 Hz,H-14b),2.86(2H,m,H-6a,b),13C NMR(C5D5N,400 MHz)δ:170.34(s,C-22),150.68(d,C-17),135.55(s,C-2),133.78(d,C-19),133.54(s,C-13),125.98(s,C-8),122.00(d,C-11),119.96(d,C-10),117.61(d,C-9),116.21(t,C-18),111.33(s,C-7),110.09(d,C-12),105.74(s,C-16),98.92(d,C-1'),94.58(d,C-21),77.18(d,C-3'),76.58(d,C-5'),72.95(d,C-2'),69.69(d,C-4'),60.91(t,C-6'),48.96(d,C-3),43.34(d,C-20),40.05(t,C-5),34.72(t,C-14),31.10(d,C-15),19.36(t,C-6)。以上光谱数据与文献[9-11]报道对照,确定该化合物为喜果苷(长春苷内酰胺,vincoside-lactam,VCS-LT)。
2.2 抗菌活性测定
抗菌试验采用滤纸片法。预先把各种供试菌用牛肉膏蛋白胨培养基、PDA 斜面培养基分别对细菌和真菌进行菌种活化,培养2~3 d 后各加入3 mL无菌水制成菌悬液备用。
将三张定性滤纸叠放,用打孔器打成若干直径约为5.5 mm 的圆形滤纸片,灭菌后备用。
配制固体培养基,灭菌,待其温度降至约50 ℃时,加入菌悬液,摇匀,倒平板,待平板凝固后用灭菌镊子夹取滤纸片浸取待试样品的二甲亚砜溶液贴在上述各种含菌培养基上,滤纸片在每个平板内间隔一定距离,每个平板内设浸有二甲基亚砜的滤纸片一枚作空白对照,用浸有1 U/mL(1U 单位,0.6 μg为1U 单位)、100 U/mL 两种浓度的青霉素钠溶液的滤纸片作阳性对照,然后将各平板放入适宜的温度培养(细菌于37 ℃,真菌于28 ℃),24 h 后取出,用十字交叉法测量抑菌圈直径,取其平均值作为试验结果。
广州蛇根草样品乙醇提取物的氯仿萃取部分对大肠杆菌和枯草芽孢杆菌具有较弱的抑菌活性,石油醚萃取部分对金黄色葡萄球菌具有较弱的抑菌活性,水提物则无明显抑菌活性,说明其不含抑菌活性成分。化合物1(β-谷甾醇)对大肠杆菌和枯草芽孢杆菌具有中等抑制活性,但化合物2(β-胡萝卜苷)、3(vincoside-lactam)则无明显抑菌活性(表1)。供试样品及对照试剂对真菌类供试菌均未显示出抗菌活性。
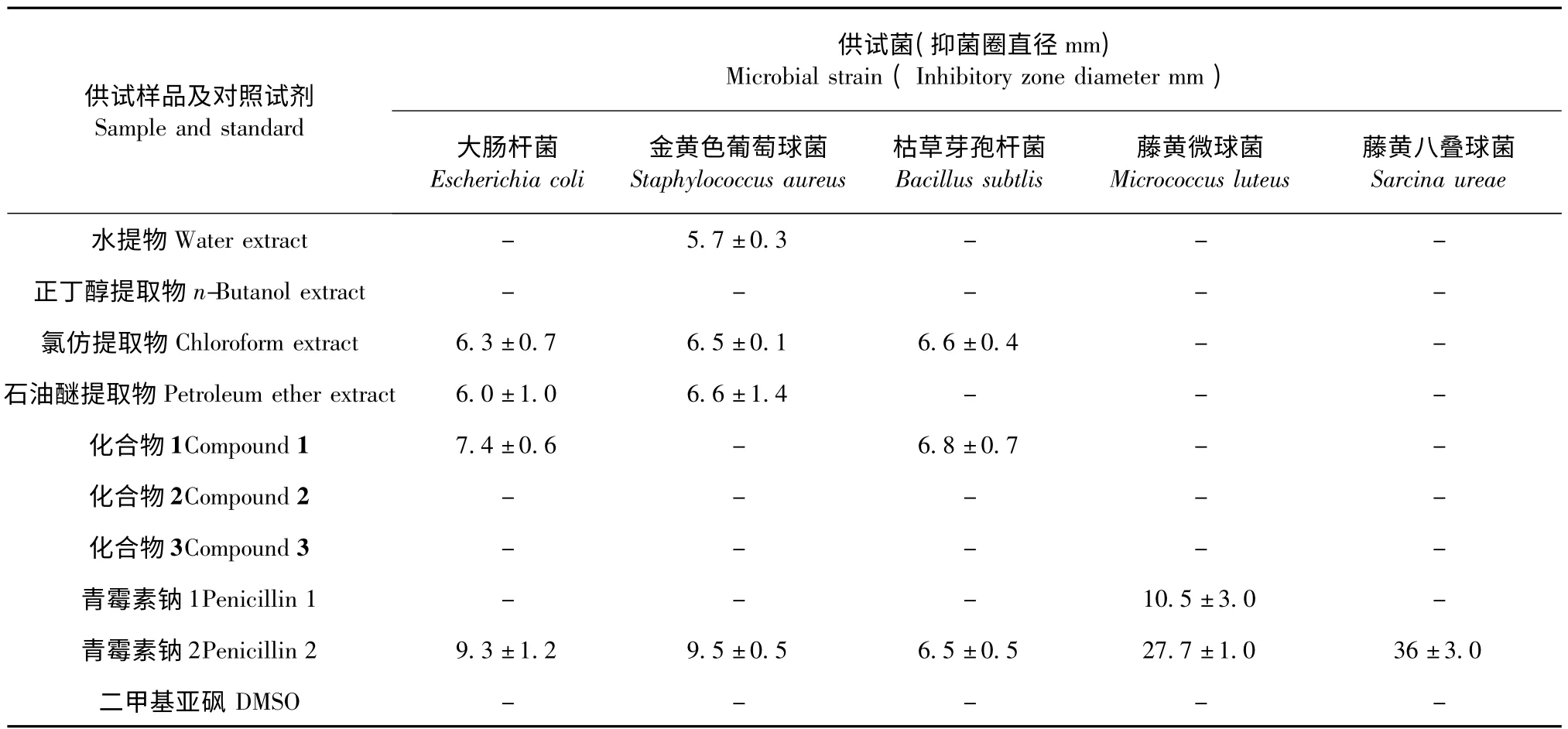
表1 广州蛇根草各萃取物及单体化合物对细菌抑制试验结果(n=3)Table 1 Inhibition of substances of Ophiorrhiza cantoniensis to bacteria
3 讨论
从广州蛇根草中得到的三种化合物,并在初提物中分离到大量的无机盐。其中化合物3 为喜果苷(长春苷内酰胺,vincoside-lactam,VCS-LT),且得到的量较大(0.35 g),研究表明喜树碱类化合物和喜果苷均具有显著抗白血病和抑制肿瘤活性[1];前人报道中均为从喜树的果实等部位提取喜果苷,笔者首次从广州蛇根草中分离得到喜果苷,发现了新的喜果苷来源,对于开拓新的抗癌药物资源具有重要意义。
另外试验中还得到了大量的β-谷甾醇(3.2 g)和胡萝卜苷(0.15 g),说明该种植物的主要药效成分可能为喜果苷和β-谷甾醇等化合物[5]。
本试验从抑菌方面证实,广州蛇根草氯仿部分和石油醚部分均含有抑菌活性物质,而β-谷甾醇由石油醚萃取物中得到且量很大(3.2 g),β-谷甾醇具有较强的抗菌活性[12],则说明该甾醇化合物可能为广州蛇根草中主要的抑菌活性物质,此化合物为脂溶性化合物,在水溶部分中含量极微或者不含该化合物,所以水溶部分显示无抗菌活性。
1 Wall ME,Wani MC,Cook CE,et al.Antihumor agent I.The isolation and structure of Campto-thecin,a novel alkaloidal leukemia and tumor inhibitor form Camptotheca acuminate.Amer Chem Soc,1966,88:3888.
2 Kitajima M,Nakamura M,Takayama H,et al.Constituents of regenerated plants of Ophiorrhiza pumila;formation of a new glycocamptothecin and predominant formation of(3R)-deoxypumiloside over(3S)-congener.Tetrahedron Letters,1997,38:8997.
3 Hsiang YH,Hertzberg R,Hecht S et al.Camptothecin induces protein-linked DNA breaks via manmalian DNA topoisomerase I.Bio Chem,1985,260:14873.
4 Rowe PM.Camptothecin:new enthusiasm for an old drug.Lancet,1995,3:892.
5 Luo XR(罗献瑞).Taxonomic revision of the chinese species of ophiorrhiza(rubiaceae).Bulletin of botanical research(植物研究),1990,10(2):1.
6 Tian J(田军),Wu FE(吴凤锷),Qiu MH(丘明华).Chemical constituents of Pterocephalus Hook-eri.Nat Prod Res Dev(天然产物研究与开发),2000,12(1):35.
7 He MF(何明芳),Meng ZM(孟正木),Wo LQ(沃联群).Study on constituents of Centella asiatica(L.)Urb .J China Pharm Univ(中国药科大学学报),2000,31:91.
8 Kojima H,Sato N,Hatano A,et al.Steroid glucosides from Prunella vulgaris.Phytochemistry,1990,29:2351.
9 Aimi N,Shito T,Fukushima K,et al.Studies on plant containing indole alkaloids.Ⅷindole alkaloid glycosides and other constituents of the leaves of Uncaria rhynchophylla Mio.Chem Pharm Bull,1982,30:4046.
10 Takayama H,Ohmori O,Subhadhirasakul S,et al.Deeper insights into the stereostructure of strictosamide tetraacetate and methylisoalangiside tetraacetate,the key reference molecules in monoterpenoid indole and isoquinoline glucoalkaloids.Chem Pharm Bull,1997,45:1231.
11 Erdelmeier CA,Wright A D,Orjala J,et al.New indole alkaloid glycosides from Nauclea orientalis.Planta Medica,1991,57:149.
12 Wuhanqimuge(乌汉其木格).Studies on Extraction and Characteristic Analysis of β-sitosterol in Bare Oat Bran.Huhehaote:Inner Mongolia Agricultural University(内蒙古农业大学),PhD.2007.

