壶瓶枣干燥预处理及提取工艺对其多糖得率的影响
张耀雷,黄立新,2*,张彩虹,谢普军,游 凤
1 中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,南京 210042;2 中国林业科学院林业新技术研究所,北京 100091
壶瓶枣(Ziziphus jujube Mill.cv.Hupingzao)是鼠李科枣属植物枣树的果实,为中国十大名枣之一,主要产地为山西太谷等地,有2000 多年的栽培历史,是一种提取红枣多糖的较好原料。我国红枣总量占世界资源的90%以上[1],其富含糖类、维生素、氨基酸、矿物质、粗纤维等营养成分,鲜枣和干枣含糖量分别为20%、60%~80%[2],既可以食用也可以入药,研究发现多糖为红枣的主要功能性成分[3]。为了延长红枣的货架期,需对其进行干燥处理。干燥方式有很多,如喷雾干燥、冷冻干燥、真空干燥、微波干燥、热泵干燥等[4],不同的干燥方式会对红枣中生物活性物质产生影响,因而有必要对其干燥方式进行研究。目前,国内外关于红枣多糖提取方法的报道主要集中于超声提取法、微波提取法、传统热浸提法和碱液提取法等,而暂无减压内部沸腾法提取红枣多糖的相关报道。与传统工艺相比,减压内部沸腾法具有低温、低压等特点,更有利于壶瓶枣中生物活性物质的保存。多糖中难分离的杂质主要是蛋白质[5],其所带电荷可吸附大量其它杂质,给多糖的分离纯化带来很大困难,且蛋白质会影响多糖的活性[6],因此有必要监控提取过程中蛋白质的得率。
本文研究了减压内部沸腾法提取壶瓶枣多糖的工艺参数,在优化工艺的基础上,研究比较了真空冷冻干燥和烘箱干燥两种干燥方式对壶瓶枣多糖得率的影响,以期为红枣多糖的工业化生产提供帮助。
1 材料与仪器
1.1 材料
壶瓶枣,产地为山西太谷,购于南京市锁金村农贸市场。
1.2 试剂
葡萄糖、浓硫酸、蒽酮、牛血清白蛋白(BSA)、考马斯亮蓝G-250、磷酸、氢氧化钠、乙醇、3,5-二硝基水杨酸、酒石酸钾钠、结晶钠、芦丁,均为分析纯。
1.3 仪器设备
JM 型胶体磨,温州市康而达实业有限公司;DHG-9070A 型电热恒温鼓风干燥箱,上海索谱仪器有限公司;Wizard 2.0 型真空冷冻干燥机,美国Vir-Tis 公司;WSC-S 测色色差计,上海精密科学仪器有限公司物理光学仪器厂;MB45 型卤素水分测定仪及分析天平,美国奥豪斯公司;SHZ-D(III)循环水式真空泵和RE-5299 型旋转蒸发仪,上海东玺制冷仪器有限公司;HH-4 数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;UV-2102PC 紫外可见分光光度仪,上海尤尼科光谱设备有限公司
2 实验方法
2.1 壶瓶枣的干燥预处理

图1 真空冷冻干燥在线监控曲线Fig.1 On-line monitoring curve of vacuum freeze drying process
壶瓶枣经脱皮、去核后,用胶体磨将其制浆,分别采用烘箱干燥和真空冷冻干燥对其干燥处理。烘箱干燥工艺参数为温度60 ℃,干燥时间为100 h。真空冷冻干燥工艺参数为-40 ℃下预冻4 h 后,在真空度320 mtorr、冷凝温度-55 ℃下干燥100 h,冷冻温度设置如图1 所示。
2.2 壶瓶枣多糖的提取
准确称量2.0 g 枣粉于250 mL 三口烧瓶中,加入适量的沸石及一定体积的蒸馏水,放置于一定温度的水浴锅中,从冷凝管抽真空至提取液沸腾,通过放气阀调节防止爆沸,回流提取一定时间。提取液趁热抽滤,滤液定容至250 mL,得溶液A,测总糖、还原糖和蛋白质含量。将溶液A 浓缩至50 mL,加200 mL 无水乙醇冷藏静置过夜,过滤所得沉淀用一定量无水乙醇洗涤,复溶后定容至250 mL,得溶液B,测多糖含量。根据单因素实验设计,研究不同真空度、冷凝管长度、温度、液料比和时间对壶瓶枣多糖及蛋白质得率的影响。
2.3 测定方法
2.3.1 壶瓶枣粉含水量及色差的测定
采用卤素水分测定仪测定干燥粉末的含水量,每个样品都测量3 次,每次测量取1 g,测量温度设定为100 ℃,测量时间为20 min,取3 个值的平均值为最终含水量;采用测色色差计测量壶瓶枣粉的L*、a*、b* 值,每个样品测量值取3 次的平均值。
2.3.2 壶瓶枣中各成分含量的测定
以葡萄糖为标准品,总糖及多糖含量测定采用蒽酮-硫酸法[7],标准曲线为c=0.0901A-0.0014(R2=0.9959);以葡萄糖为标准品,还原糖含量测定采用DNS 法[8],标准曲线为c=1.069A +0.0118(R2=0.9996);以牛血清白蛋白(BSA)为标准品,可溶性蛋白质含量测定采用考马斯亮蓝法[9],标准曲线为c=0.1232A-0.0065(R2=0.9862)。

式中:n 为稀释倍数;VA为溶液A 体积,mL;VB为溶液B 体积,mL;M 为枣粉质量,g;c 为溶液中各物质浓度,mg/mL。
3 结果与分析
3.1 干燥预处理结果分析
3.1.1 干燥预处理对壶瓶枣含水量的影响
含水量是检验红枣干燥效果的重要指标,关系到红枣的储存条件和保质期限,含水量过高会增加红枣保存的难度。在本实验条件下,烘箱干燥和真空冷冻干燥所得壶瓶枣含水量分别为4.00% 和6.87%。结果表明在100 h 的干燥时间下,烘箱干燥的干燥能力较强。
3.1.2 干燥预处理对壶瓶枣色差的影响
不同干燥方式所得壶瓶枣粉末的颜色不同,而色泽是考察干燥方式优劣的重要指标,因此需对其进行分析比较。采用色差计进行测量,参照物为白板,其明度L 为92.92,偏红a 为-0.90,偏黄b 为0.54,其色差△E 为0。在本实验条件下,烘箱干燥和真空冷冻干燥所得壶瓶枣粉末的色差分别为65.26 和53.18,表明低温真空环境能够更好的保持物料的色泽。这是因为壶瓶枣中发生了美拉德反应[10],导致烘箱干燥的壶瓶枣粉末色差较大,这也使所得多糖色素含量过高。
由于烘箱干燥的壶瓶枣粉色差较大,色素含量高,而两种干燥预处理的枣粉含水量无显著区别,因此本文选用真空冷冻干燥的壶瓶枣粉研究提取工艺。
3.2 提取条件对壶瓶枣多糖得率的影响
3.2.1 真空度的选择
将提取工艺设定为体系内温度50 ℃,液料比40∶1(mL∶g),提取时间30 min,考察不同真空度对壶瓶枣多糖和蛋白质得率的影响,结果见图2。由图2 可知,当真空度小于87 kPa 时(体系未沸腾),不同真空度对蛋白质和多糖得率影响较小;当真空度达到87 kPa 时(体系沸腾),多糖和蛋白质得率均有显著提高。这是由于沸腾时的翻腾效应可加速壶瓶枣多糖和蛋白质在水中扩散,提高了得率[11]。因此,沸腾时蛋白质和多糖的得率才能得到显著提高。沸腾时,水蒸气不断冷凝回流至体系中导致体系内外温度相差较大,实验中体系内外温度与真空度的关系见图3。由图3 可知,沸腾时,体系内外温度差为10 ℃,并可将温度与真空度整合为一个因素。由于体系内温度为实际提取温度,因此本文确定以该温度为实验因素。
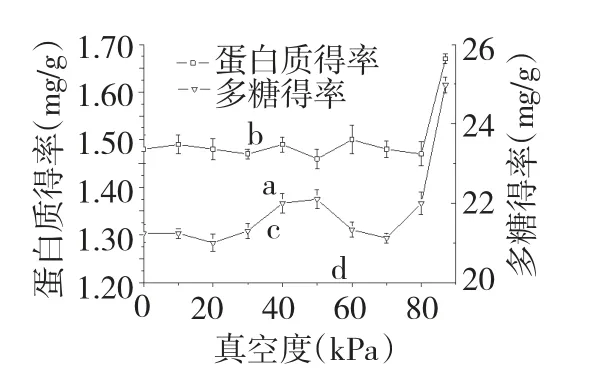
图2 真空度对蛋白质及多糖得率的影响Fig.2 Effect of vacuum degree on the protein and polysaccharides yields
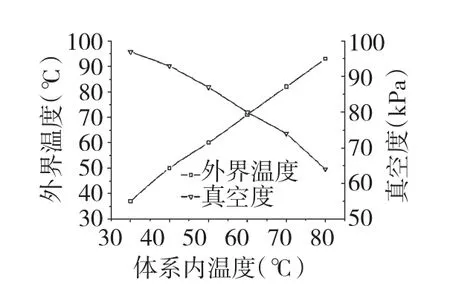
图3 体系内外温度与真空度的关系Fig.3 Relationship between temperature and vacuum degree
3.2.2 温度的选择
将提取工艺设定为液料比40∶1(mL∶g),提取时间30 min,考察不同温度对壶瓶枣多糖和蛋白质得率的影响,结果见图4。由图4 可知,当温度达到60 ℃时,壶瓶枣多糖得率达到最大值;当温度小于60 ℃时,多糖得率呈增大趋势;当温度大于60 ℃时,多糖得率呈减少趋势,这是因为多糖的热稳定性较差,高温条件容易导致其降解。由于温度达到60℃时多糖得率最高且蛋白质得率随温度的增高而增大,因此温度选择60 ℃较为合适。

图4 温度对蛋白质及多糖得率的影响Fig.4 Effect of temperature on the protein and polysaccharides yields
3.2.3 液料比的选择
将提取工艺设定为温度60 ℃,提取时间30 min,考察不同液料比对壶瓶枣多糖及蛋白质得率的影响,结果见图5。由图5 可知,当液料比值达到50时,壶瓶枣多糖得率达到最大值,当达到60 时,蛋白质得率达到最大值;当液料比值继续增大时,多糖及蛋白质得率均呈减小趋势。综合考虑,液料比选择50∶1(mL∶g)较为合适。
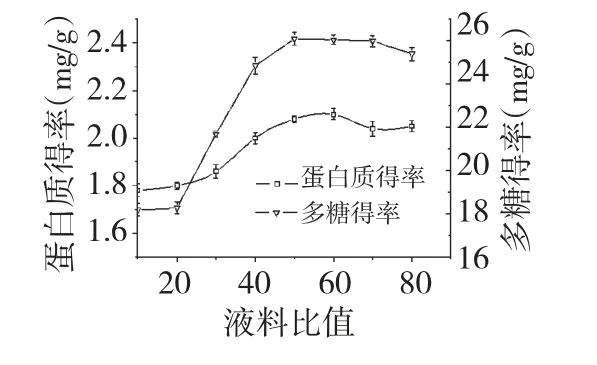
图5 液料比对蛋白质及多糖得率的影响Fig.5 Effect of water/solid ratio on the protein and polysaccharides yields
3.2.4 提取时间的选择
将提取工艺设定为温度60 ℃,液料比50∶1(mL∶g),考察不同提取时间对壶瓶枣多糖及蛋白质得率的影响,结果见图6。由图6 可知,当提取时间达到30 min 时,多糖及蛋白质得率达到最大值;当提取时间大于30 min 时,延长提取时间对多糖及蛋白质得率无显著影响。从节能方面考虑,提取时间选择30 min 较为合适。
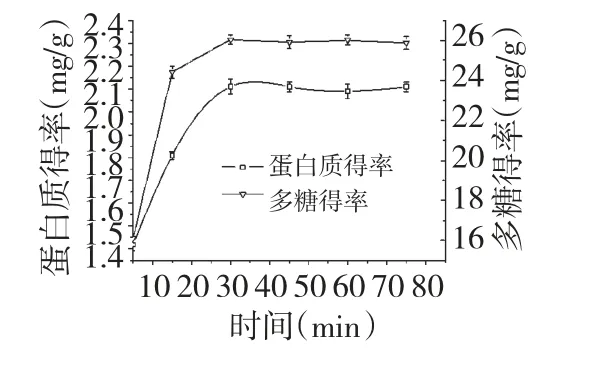
图6 提取时间对蛋白质及多糖得率的影响Fig.6 Effect of extraction time on the protein and polysaccharides yields
3.2.5 冷凝管长度的选择
提取过程中挥发的水蒸气若不能及时冷凝回流会导致体系中液料比的改变,继而影响多糖及蛋白质的得率。冷凝管过短必然会导致水蒸气冷凝不充分,因此有必要对冷凝管的长度进行选择。将提取工艺设定为温度60 ℃,液料比50∶1(mL∶g),提取时间30 min,分别比较单个冷凝管(40 cm)和两个串联冷凝管(80 cm)对得率的影响,结果见表1。由表1 可知,实验所选冷凝管长度对得率影响较小,说明40 cm 冷凝管即可以达到充分冷凝,从装置的简易性考虑,选择40 cm 较好。
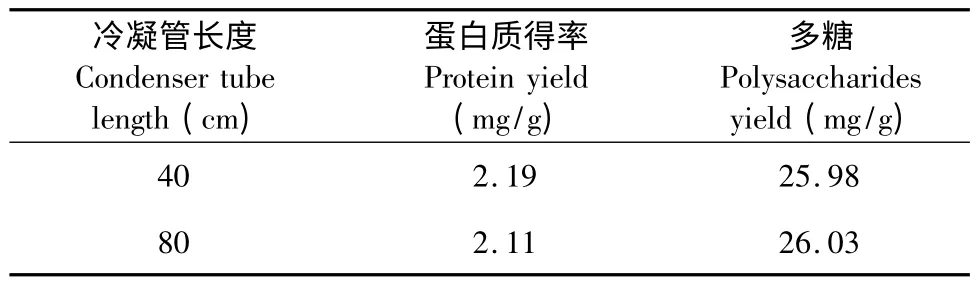
表1 冷凝管长度对蛋白质及多糖得率的影响Table 1 Effect of condenser tube length on the protein and polysaccharides yields
3.3 验证实验
单因素优化后工艺参数为温度60 ℃,液料比50∶1(mL∶g),提取时间30 min,此时外界温度为71℃,真空度为80 kPa,按工艺重复3 组实验,结果见表2,蛋白质得率为2.14 mg/g,RSD=1.43%,多糖得率为26.05 mg/g,RSD=0.21%,说明本工艺重复稳定性较好。

表2 验证实验Table 2 Confirmatory experiment
3.4 不同提取方法的比较
将单因素优化后的减压内部沸腾法与传统热浸提比较,后者工艺参数设定为温度60 ℃,液料比50∶1(mL∶g),提取时间30 min,按步骤2.2 测蛋白质与多糖得率分别为1.57 和22.33 mg/g,减压内部沸腾法分别提高了36.31%和16.66%。
3.5 干燥预处理对壶瓶枣多糖提取得率的影响
采用经优化后的减压内部沸腾法提取壶瓶枣中各成分,此条件下各成分含量见表3。由表3 可知,真空冷冻干燥的枣粉中总糖及多糖含量较高,说明真空冷冻干燥能够更好保存壶瓶枣中原有的糖类物质,而烘箱干燥的高温环境容易导致多糖的降解。还原糖会与氨基酸发生美拉德反应,导致产品变质,缩短货架期[12],因此需对其含量进行测定,结果表明烘箱干燥的枣粉中还原糖含量较高,可能原因是壶瓶枣中淀粉等多糖发生降解后生成了还原糖。真空冷冻干燥所得壶瓶枣中蛋白质含量较低,这是由于真空冷冻干燥过程的冻结、冻融、干燥等过程使蛋白质发生了变性[13],这也是反复冻融法脱蛋白的原理。综合考虑,真空冷冻干燥是壶瓶枣干燥的一种较佳方式。

表3 干燥预处理对得率的影响(以干重计)Table 3 Effect of drying pretreatments on the yields (by dry weight meter)
4 结论与讨论
在100 h 的干燥时间下,烘箱干燥的干燥能力较强;美拉德反应造成烘箱干燥的壶瓶枣粉色差较大,导致其多糖色素含量偏高,会给多糖的后续分离纯化工作带来很大困难。真空冷冻干燥所得壶瓶枣粉的多糖含量高于烘箱干燥,且蛋白质含量较低,说明低温真空的环境可以更好的保存红枣多糖且多糖纯度更高。综合考虑,真空冷冻干燥技术的干燥效果较佳,是壶瓶枣干燥预处理的较佳选择。
以真空冷冻干燥的壶瓶枣粉为原料,采用减压内部沸腾法提取壶瓶枣多糖,研究不同真空度、冷凝管长度、温度、液料比和提取时间对壶瓶枣多糖得率的影响。真空度与温度存在着对应关系,故将两者整合为一个因素考察。单因素结果表明温度、液料比和提取时间对多糖及蛋白质的得率有较大影响,冷凝管长度对其影响较小,优化后的工艺参数为体系内温度60 ℃,液料比50∶1(mL∶g),提取时间30 min,此时外界温度为71 ℃,真空度为80 kPa,此条件下蛋白质及多糖得率分别为2.14 mg/g 和26.05 mg/g。与传统热浸提相比,蛋白质和多糖得率分别提高了36.31%和16.66%。
1 Li JW(李进伟),Fan LP(范柳萍),Ding XL(丁霄霖),et al.Isolation,purification and composition of polysaccharide ZP3c from Zizyphus jujuba cv.Jinsixiaozao.Nat Prod Res Dev(天然产物研究与开发),2009,21:984-987.
2 Li J(李杰),Liang CX(梁长利),Mi F(米芳).Study on the extraction conditions of water-soluble polysaccharides from jujube.Food Res Dev (食品研究与开发),2009,30(9):58-60.
3 Wang J(王军),Zhang BS(张宝善),Chen JP(陈锦屏).Study on the nutritional ingredients and functions of jujube.Food Res Dev (食品研究与开发),2003,24(2):68-72.
4 Zhang CH(张彩虹),Huang LX(黄立新),Liu W(刘伟),et al.Research on properties of Ginkgo Biloba powder by different drying methods.Biomass Chem Eng(生物质化学工程),2009,43(6):27-30.
5 Xie HQ(谢红旗),Zhou CH(周春山).Separation of protein from lentinan by anion exchange resin.Chem Res Appl (化学研究与应用),2006,18:211-213.
6 Xing XH(邢小黑),Wu MZ(吴明忠),Zhu SJ(朱述均),et al.Research on polysaccharide chemistry of Ganoderma lucidum.Edible Fungi China(中国食用菌),1996,15(3):14-15.
7 Zhuang YL(庄永亮),Sun LP(孙丽平),Shang XL(尚小丽).Extraction and antioxidant activities of polvsaccharides from pileus of Dictyophora rubrovalv.Chem Ind Forest Prod(林产化学与工业),2011,31(3):45-49.
8 Zhang YQ(张永勤),Wang ZP(王哲平),Song YM(宋雨梅),et al.Comparative study on the determination of reducing sugar.Sci Technol Food Ind(食品工业科技),2010,31:321-323.
9 Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,1976,72:248-254.
10 Wu HL(吴惠玲),Wang ZQ(王志强),Han C(韩春),et al.Factors affecting the maillard reaction.Modern Food Sci Technol (现代食品科技),2010,26:440-444.
11 Xie PJ(谢普军),Zhang CH(张彩虹),Huang LX(黄立新),et al.Boiling extraction of oleuropein at low temperature and reduced pressure.China J Chin Mater Med(中国中药杂志),2012,37:1946-1951.
12 Deng L(邓丽).The study of maillard reative mechanism of soy sauce at shelf life.China Food Add(中国食品添加剂),2012,3:148-152.
13 Sun DP(孙东坡),Hu YQ(胡一桥).Stabilizing excipients in the freeze-dried protein formulations and their protective Mechanisms.Prog Pharm Sci (药学进展),2003,27:201-205.

