制何首乌提取物及主要单体成分体外对酪氨酸酶活性的影响
石璐缘,李登科,崔宝弟,付 莹,冯光远,赵 晨,孙震晓
北京中医药大学中药学院生物制药系,北京 100102
何首乌始载于《开宝本草》,为蓼科植物何首乌(Polygonum multiflorum Thunb.)的干燥块根,根据炮制与否其功效大有不同,生用可解毒、消痈、润肠通便,制何首乌则具有补肝肾、益精血、乌须发等功效[1]。制何首乌作为一种传统的乌发良品广为人知,《本草纲目》赞其“养血益肝,固精益肾,健筋骨,乌髭发,为滋补良药”,且在八宝丹、神仙乌云丹等乌发古方中均有收录。然而制何首乌功善乌发的作用机制目前尚不明确。
白发的病因与发病机理复杂,现代医学研究认为,可能与遗传、衰老、疾病等导致的黑素干细胞衰老、黑素细胞减少等有关,机制包括bcl-2 基因缺失、氧化损伤、氧化应激、微量元素缺乏等,其中,酪氨酸酶(tyrosinase)表达量减少或活性降低是一个重要的因素[2,3]。酪氨酸酶是体内黑素合成的主要限速酶,酪氨酸酶活性降低将使体内黑素合成的反应进行得十分缓慢[4]。目前研究表明,何首乌的主要成分有蒽醌类化合物、二苯乙烯苷类化合物、磷脂和微量元素等[5],本实验选用制何首乌不同分离部位及其所含主要单体成分进行实验,考察制何首乌是否是通过某种分离部位或有效单体成分直接激活酪氨酸酶的催化活性从而促进黑素的合成,为进一步研究制何首乌乌发机制提供参考。
1 材料与方法
1.1 材料和仪器
制何首乌药材购自北京同仁堂饮片有限责任公司,批号701001037,产地为湖北,由北京中医药大学中药学院中药生药系张贵君教授鉴定;蘑菇酪氨酸酶(tyrosinase),L-多巴,均购自美国Sigma 公司;丙二醇,乙酸乙酯试剂均为分析纯;2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(2,3,5,4'-tetrahydroxystilbene-2-O-β-D-glucoside ;THSG),大黄素(Emodin),大黄素甲醚(Physcion),大黄素-8-O-β-D-葡萄糖苷(Emodin-8-O-β-D-glucoside)为标准品,购自中国药品生物制品检定所。
酶标仪(Spectra Max190,美国分子仪器公司)。
1.2 方法
1.2.1 制何首乌提取分离物制备方法
参照文献[6],取制何首乌饮片200 g,用70%乙醇(V/V)提取2 次,第1 次加10 倍量溶剂,提取2 h,第2 次加8 倍量溶剂,提取1.5 h,合并2 次乙醇提取液,回收溶剂至无醇味,加水分散,通过AB-8型大孔树脂吸附,依次用水、50%乙醇、95%乙醇洗脱至洗脱液无色,分别收集各洗脱液,减压回收溶剂至干,残留物减压干燥,分别得到制何首乌水洗脱物(water eluted extract of processed Polygonum multiflorum,PW),50%乙醇洗脱物(50% ethanol eluted extract of processed Polygonum multiflorum,P50),95%乙醇洗脱物(95% ethanol eluted extract of processed Polygonum multiflorum,P95)。另制何首乌饮片200 g,水煎煮提取,第1 次加10 倍量水,提取2 h,第2次加8 倍量水,提取1.5 h,合并两次水煎液,水浴蒸干,减压干燥,得制何首乌水提物(water extract of processed Polygonum multiflorum,PWE)。
1.2.2 制何首乌提取物及受试单体溶液配制
根据提取物及受试单体成分溶解性不同溶解方式及测定体系有所不同。水溶性成分如制何首乌水提物(PWE),制何首乌水洗脱物(PW),制何首乌50%乙醇洗脱物(P50),2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(THSG)用去离子水溶解至受试浓度。脂溶性成分如制何首乌95% 乙醇洗脱物(P95),大黄素,大黄素甲醚,大黄素-8-O-β-D-葡萄糖苷需以混合溶剂(V丙二醇:V乙酸乙酯=9∶1)溶解至受试浓度。
1.2.3 测定方法
1.2.3.1 制何首乌中各水溶性成分对酪氨酸酶活性影响测定
[7],采用蘑菇酪氨酸酶多巴速率氧化法测定酪氨酸酶活性。取96 孔板酶标板,反应物共0.2 mL,37 ℃孵育10 min 后,加0.15% L-多巴0.1 mL,再孵育2 min,用酶标仪于475 nm 处测定吸光度A 值(A475)。每种药物浓度实验均重复至少三次。
每种药物均分为4 组,其中
a 组为:PH6.8 磷酸盐缓冲液0.19 mL,蘑菇酪氨酸酶0.01 mL(200 u/mL)。
b 组为:PH6.8 磷酸盐缓冲液0.2 mL。
c 组为:PH6.8 磷酸盐缓冲液0.18 mL,蘑菇酪氨酸酶0.01 mL(200 u/mL),药物0.01 mL。
d 组为:PH6.8 磷酸盐缓冲液0.19 mL,药物0.01 mL。
按以下公式计算药物对酪氨酸酶的激活率。

其中ABCD 分别为abcd 四组的吸光度值。
1.2.3.2 制何首乌中脂溶性成分对酪氨酸酶活性影响测定
参考文献[8],取96 孔板酶标板,反应物共0.15 mL,室温孵育10 min 后,加0.15% L-多巴0.07 mL,室温孵育15 min,用酶标仪于490 nm 处测定吸光度A 值(A490)。每种药物浓度实验均至少重复三次。
每种药物均分为4 组,其中
a 组为:PH6.8 磷酸盐缓冲液0.13 mL,蘑菇酪氨酸酶0.01 mL(200 u/mL),混合溶剂0.01 mL(V丙二醇:V乙酸乙酯=9∶1)。
b 组为:PH6.8 磷酸盐缓冲液0.14 mL,混合溶剂0.01 mL(V丙二醇:V乙酸乙酯=9∶1)。
c 组为:PH6.8 磷酸盐缓冲液0.13 mL,蘑菇酪氨酸酶0.01 mL(200 u/mL),药物0.01 mL。
d 组为:PH6.8 磷酸盐缓冲液0.14 mL,药物0.01 mL。
按以下公式计算药物对酪氨酸酶的激活率。
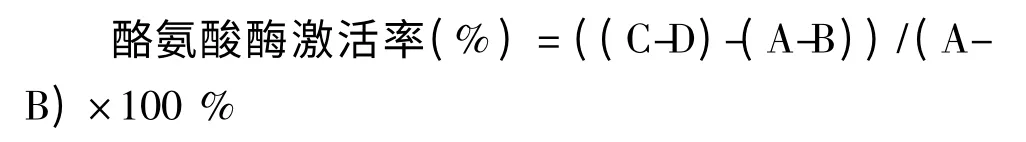
其中ABCD 分别为abcd 四组的吸光度值。
2 结果与讨论
2.1 制何首乌水溶性成分对酪氨酸酶活性的影响
按1.2.3.1 方法进行酪氨酸酶活性影响测定,结果如表1 所示。其中,每1 g 制何首乌水提物(PWE)相当于6.272 g 生药,1 g 制何首乌水洗脱物(PW)相当于18.0 g 生药,1 g 制何首乌50%乙醇洗脱物(P50)相当于21.6 g 生药。表1 中药物浓度均为实用受试药物浓度。
表1 制何首乌水溶性成分对酪氨酸酶活性的激活率(,n≥3)Table 1 The activation rate of water-soluble extracts from processed Polygonum multiflorum on tyrosinase activity
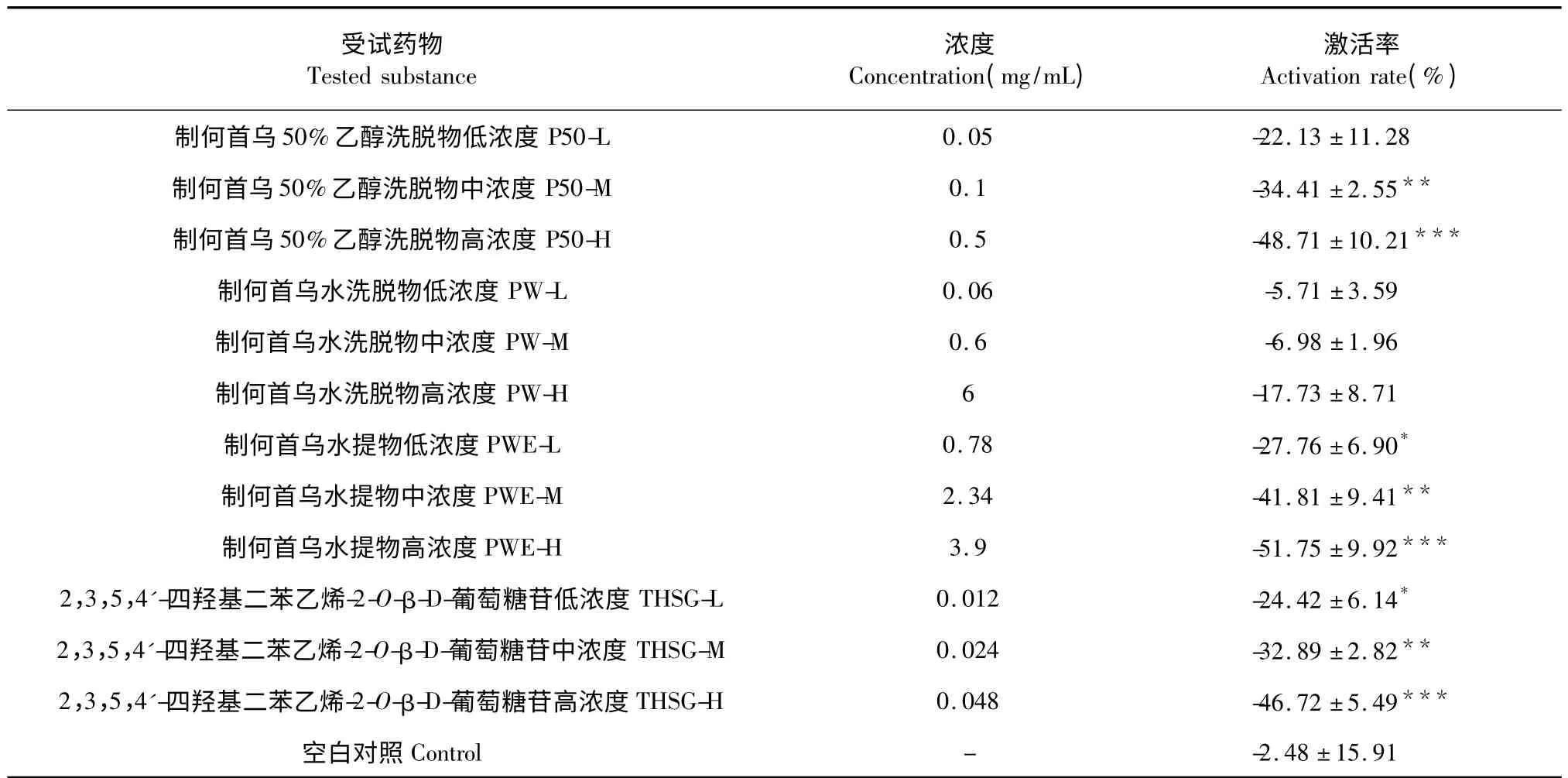
表1 制何首乌水溶性成分对酪氨酸酶活性的激活率(,n≥3)Table 1 The activation rate of water-soluble extracts from processed Polygonum multiflorum on tyrosinase activity
注:与空白对照组比较,* P <0.05;**P <0.01;***P <0.001。Note:Compare with control,* P <0.05;**P <0.01;***P <0.001.
由表1 中可见,制何首乌各水溶性成分激活率结果均为负值,说明制何首乌各水溶性成分对酪氨酸酶无激活作用,反而不同程度浓度呈依赖性地抑制酪氨酸酶活性,其中,制何首乌50%乙醇洗脱物(P50),制何首乌水提物(PWE),2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(THSG)在高浓度水平下均对酪氨酸酶产生了显著的抑制效果,如P50 在0.5 mg/mL 浓度下,对酪氨酸酶活性抑制率为48.71 ±10.21%,PWE 在3.9 mg/mL 浓度下,对酪氨酸酶活性抑制率为51.75 ±9.92%,而THSG 在48 μg/mL 浓度下,对酪氨酸酶活性抑制率可达46.72±5.49%,但PW 在最高实验浓度6 mg/mL 下对酪氨酸酶活性却无明显影响。
2.2 制何首乌脂溶性成分对酪氨酸酶活性影响结果
按1.2.3.2 方法进行酪氨酸酶活性影响测定,结果如表2 所示。其中,每1 g 制何首乌95%乙醇洗脱物(P95)相当于909.1 g 生药。表2 中药物浓度均为实用受试药物浓度。
表2 制何首乌脂溶性成分对酪氨酸酶活性的激活率(,n≥3)Table 2 The activation rate of liposoluble components from processed Polygonum multiflorum on tyrosinase activity
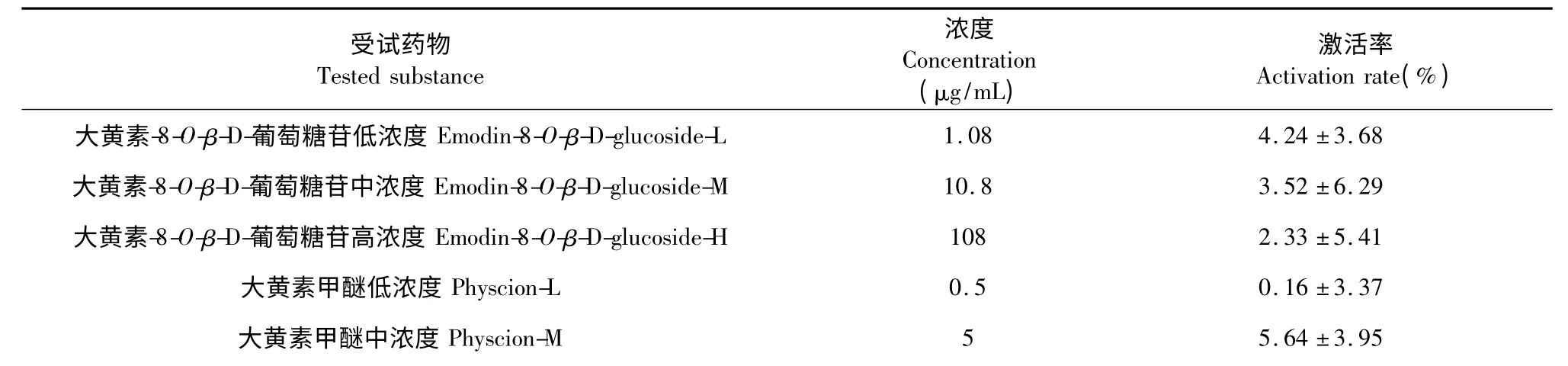
表2 制何首乌脂溶性成分对酪氨酸酶活性的激活率(,n≥3)Table 2 The activation rate of liposoluble components from processed Polygonum multiflorum on tyrosinase activity

注:与空白对照组比较,* P <0.05;**P <0.01;***P <0.001。Note:Compare with control,* P <0.05;**P <0.01;***P <0.001.
由表2 可见,在制何首乌脂溶性各成分中,无体外条件下有效激活酪氨酸酶活性的成分,大黄素-8-O-β-D-葡萄糖苷与大黄素甲醚对酪氨酸酶活性均无明显影响,但0.5 mg/mL 的大黄素对酪氨酸酶有26.93 ±17.91%的显著抑制作用,3.65 mg/mL 的制何首乌95% 乙醇洗脱物对酪氨酸酶有37.89 ±9.94%的极显著抑制作用,且抑制作用呈明显的浓度依赖性。
2.3 讨论
在人体内,黑素的合成主要先由酪氨酸羟化生成多巴,多巴氧化生成多巴醌,二羟基吲哚转化生成吲哚醌,这些反应步骤均需酪氨酸酶参与[4]。酪氨酸酶是黑素生成的主要限速酶,在黑色素生成过程中起着至关重要的作用,其化学结构为铜结合糖蛋白。有研究认为何首乌的蒽醌衍生物对酪氨酸酶活性存在显著的促进作用[9],2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷能够有效激活黑色素瘤细胞内酪氨酸酶的活性及酪氨酸酶相关基因的表达[10],这些皆可能为何首乌乌发的作用机制。本实验结果表明,大黄素,大黄素甲醚,大黄素-8-O-β-D-葡萄糖苷,2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷等制何首乌主要单体成分及制何首乌各分离部位在体外条件下均无酪氨酸酶激活作用,而制何首乌水提物、制何首乌乙醇提取物的50%乙醇洗脱物及95%乙醇洗脱物、2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷、大黄素等皆表现出了一定的酪氨酸酶抑制活性。由结果看来,制何首乌脂溶性成分中大黄素可能起到了主要的抑制作用。何冰芳[11]等的研究也显示,大黄素对酪氨酸酶有显著的竞争性抑制作用,50%抑制率的药物浓度为36.6 μg/mL,与本实验的研究结果一致。目前已报道的何首乌乌发机制研究多从酪氨酸酶活性及表达量等切入,如姜泽群[12]等人研究认为,何首乌可通过上调B16 黑素瘤细胞内的酪氨酸酶表达量及酪氨酸酶活性促进黑素的生成,但根据对制何首乌各成分体外对酪氨酸酶活性影响的实验结果,并未筛到激活酪氨酸酶活性成分。虽然我们目前的体外研究数据不支持制何首乌可以通过激活酪氨酸酶活性发挥乌发作用,制何首乌及其体内代谢物作用于黑素细胞后对酪氨酸酶活性的影响尚待进一步研究确定。制何首乌是否可能通过其他途径促进黑素细胞中黑素的生成,或通过抗氧化损伤保护黑素干细胞以及黑素细胞从而保证黑素的正常合成,抑或通过其他机制产生乌发效果还有待进一步研究。
值得一提的是,酪氨酸酶的活性研究同样是美白制剂研发的重点,酪氨酸酶活性降低可减少肌肤产生的黑色素,从而达到美白的效果[13]。本实验发现,在体外条件下,2,3,5,4'-四羟基二苯乙烯-2-Oβ-D-葡萄糖苷在48 μg/mL 极低浓度下即可产生46.72 ±5.49%的酪氨酸酶抑制效果,达到极显著水平,可见其具有美白的潜在功效。目前常用于皮肤美白添加剂的有曲酸及其衍生物,果酸,维生素C等,这些美白添加剂各自都存在一定的副作用,如曲酸及其衍生物稳定性差且长期使用仍有细胞毒性,果酸中的主要成分α-羟基酸则易导致晒伤甚至皮肤癌,维生素C 皮肤吸收性差且不稳定。开发稳定、低毒的天然酪氨酸酶抑制剂美白产品具有广阔的前景。2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷为植物源的纯天然提取物,水溶性强,细胞毒性小(未发表结果),且班翊[14]等对其稳定性进行研究发现二苯乙烯苷在中性及弱碱性水溶液中30 d 含量无明显变化,稳定性好,另外,吕丽爽等[15]采用聚酰胺柱层析系统及溶剂结晶技术,开发出了工艺简单,成本低,可工业化分离二苯乙烯苷的方法,纯度可达99% 以上,这些都为2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷在美白领域的研发奠定了基础,值得重视。
参考文献
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol Ⅰ,195-197.
2 Fu QX(付庆霞),Wang HP(王海苹).Research situation of the etiology and pathogenesis of poliosis.Guangming J Chin Med(光明中医),2009,24:375-377.
3 Ken I,Takahiro A,Nguyen TB,et al.Genotoxic stress abrogates renewalof Melanocyte stem cells by triggering their differentiation.Cell,2009,137:1088-1099.
4 Prota G.Progress in the chemistry of melanin and related metabolites.Med Res Rev,1988,8:525-556.
5 Zhang C(张超),Sun ZX(孙震晓).Advance in studies on the chemical constituent of Polygonum multiflorum and its metabolism in vivo.Mianyang:The biochemical and biotech drugs academic convention(全国生化与生物技术药物学术年会),2010:130.
6 Zhang RC(张瑞晨),Liu B(刘斌),Sun ZX(孙震晓),et al.Effects of extract of Polygonummultiflorum on cell cycle arrest and apoptosis of human liver cell line L02.J Chin Integrative Med(中西医结合学报),2010,8:554-561.
7 Lou CX(楼彩霞),Pu XL(朴香兰).The reaction system for the study of forsythia suspensa on tyrosinase inhibitory effect.Lishizhen Med Mater Med(时珍国医国药),2011,22:2580-2582.
8 Zhou Z(周中),Wang JG(王建国),Zhou L(周蕾),et al.A testing method for evaluation of inhibitory performance of oil soluble lighteners against tyrosinase.Chin Surfactant Detergent & Cosmetics(日用化学工业),2003,33:326-328.
9 Yang TC(杨同成).Preliminary Explore of the Extraction and Anti-white Hair Mechanism of Anthraquinone Derivative of Polygonum multiflorum Thumb.J Fujian Normal Univ(福建师范大学学报),1993,9(2):66-69.
10 Jiang ZQ,Xu JM,Long MH,et al.2,3,5,4'-tetrahydroxystilbene-2-O-β-D-glucoside(THSG)induces melanogenesis in B16 cells by MAP kinase activation and tyrosinase upregulation.Life Sci,2009,85:345-350.
11 He BF(何冰芳),Chen QH(陈琼华).Inhibitory effects of anthraquinone derivatives of Chinese Rhub Arb on tyrosinase.Biochem J(生物化学杂志),1989,5:154-158.
12 Jiang ZQ(姜泽群),Wu Q(吴琼),Xu JM(徐继敏),et al.Promotion of melanin production by Radix Polygoni Multiflori:pA Study of Its Mechanism.J Nanjing Univ Trad Chin Med(南京中医药大学学报),2010,26:190-192.
13 Guan XL(官兴丽),Luo LY(罗理勇),Zeng L(曾亮),Advances at the research on the skin lightening effect and mechanism of natural products.Sci Tech Food Ind(食品工业科技),2011,32:432-436.
14 Ban Y(班翊),Liu QL(刘其礼),Jin Y(金悠),et al.Determination of stilbene-glucoside and investigation on its stability.Chin Tradit Herb Drugs(中草药),2004,35:1235-1237.
15 Lu LS(吕丽爽),Tang J(汤坚),He QT(何其傥).Preparation and antioxidation mechanism of stilibene glycoside from Polygonum multiflorum Thunb.Wuxi:Jiangnan University(江南大学),PhD.2006.

