源自胃癌的转移性卵巢肿瘤的MRI研究
李海明 强金伟 赵书会 马凤华 蔡宋琪 夏凎林 冯 峰 傅爱燕
转移性卵巢肿瘤常见,约占卵巢恶性肿瘤的10%~30%,实际上6%~7%的附件区肿块是转移性肿瘤[1,2],这一事实常被影像科医师所忽视,导致误诊为原发性卵巢癌,直接影响了患者的临床治疗和预后。胃癌为最常见的转移来源,源自胃癌的卵巢转移性肿瘤(secondary ovarian tumors from gastric carcinoma, SOTGC)在亚洲国家尤其是日本相对高发,预后较差,平均生存时间约10个月[3]。虽然国外已有SOTGC的影像学研究,但结果并不一致[4-7];国内还未见相关报道,故SOTGC的影像学表现还需进一步研究。我们对12例SOTGC的MRI表现进行回顾性分析,并与33例原发性卵巢癌(primary ovarian cancer,POC)对照,旨在探讨SOTGC的特异性MRI征象,提高MRI对其的鉴别能力。
方 法
1.病例资料
2010年2月至2013年10月期间行MRI检查、并经手术和病理证实的SOTGC 12例(印戒细胞癌8例,低分化腺癌3例,黏液腺癌1例)和POC 33例(浆液性囊腺癌21例,子宫内膜样腺癌4例,黏液性囊腺癌1例,透明细胞癌1例,未分型腺癌3例,混合型腺癌3例)。转移瘤组年龄28~68岁,平均44±13岁;原发瘤组年龄36~78岁,平均54±10岁;两组年龄差异具有统计学意义(P=0.026)。
2.扫描方法
采用1.5T MR超导扫描仪(Espree,Siemens,Germany),使用相控阵体线圈。扫描范围从髂动脉分叉到耻骨联合,病灶巨大时扩大范围。平扫行横轴位T1WI(重复时间/回波时间(TR/TE):117ms/4.76ms)、T2WI(3800ms/108ms)或T2WI抑脂(8000ms/83ms)序列,冠状位和矢状位T2WI抑脂序列(TR/TE分别为:3600ms/33ms和3600ms/73ms)。层厚4~6 mm、层距1mm。45例患者另行三维快速容积动态增强扫描(5.58ms/2.38ms,层厚3mm,无层距),对比剂为钆喷酸葡胺(马根维显),注射流率为2.0ml/s,剂量25ml。注药开始后20s、48s、68s、88s、108s行横轴位、矢状位及冠状位扫描。
3.图像分析
由2名从事腹部影像的放射科医师共同阅片,意见不同时讨论达成一致。观察内容:①肿瘤单或双侧,大小(横轴位最大径),边缘(光滑/模糊),形态(卵或圆形/分叶/不规则)。②肿块类型:囊性/囊实性/实性,实性成分内边界清晰的囊样信号。③信号强度:T2WI上测量肿瘤实性区的信号强度值,以子宫外肌层为参照,计算两者之间的信号强度比(SIR)。④实性成分强化程度:分为明显(等于或高于子宫外肌层),中等(高于子宫结合带低于子宫外肌层),轻度强化(低于子宫结合带)。⑤腹水量:分为无、少量及中至大量腹水。
4.统计学方法
采用SPSS16.0统计分析软件包,两独立样本t检验比较两组肿瘤年龄、肿块大小、SIR值间的差异;采用Pearson χ2检验、Fisher精确检验比较肿块的部位、边缘、形态、实性区内边界清晰的囊样信号、强化程度、腹膜种植及腹水的差异。P<0.05为差异有统计学意义。
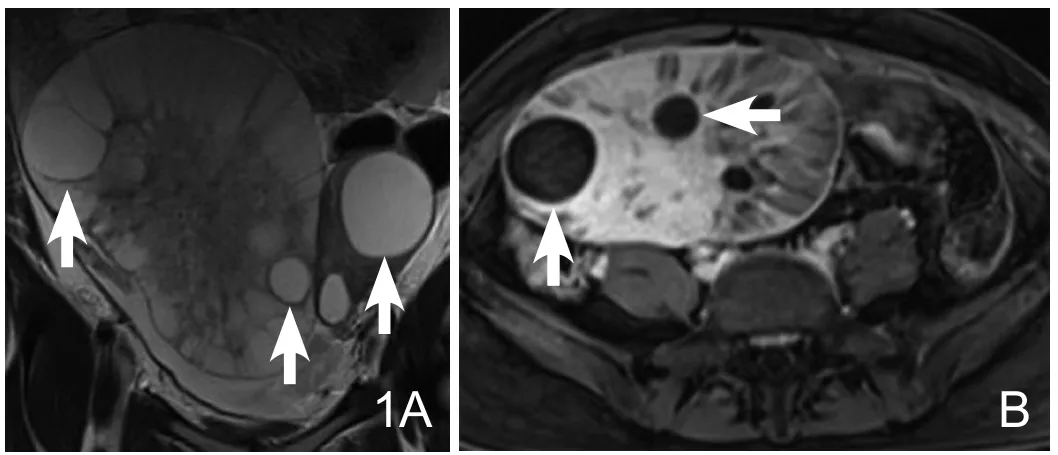
图1 28岁患者,胃癌双侧卵巢转移。双侧卵巢见分叶状囊实性肿块,以右侧为著,边界清晰,冠状位T2WI(A)实性区为不均匀高信号,内见多个边界清晰的囊肿样信号(白箭);横轴位T1WI抑脂增强(B)显示实性部分和囊壁明显强化(箭)。
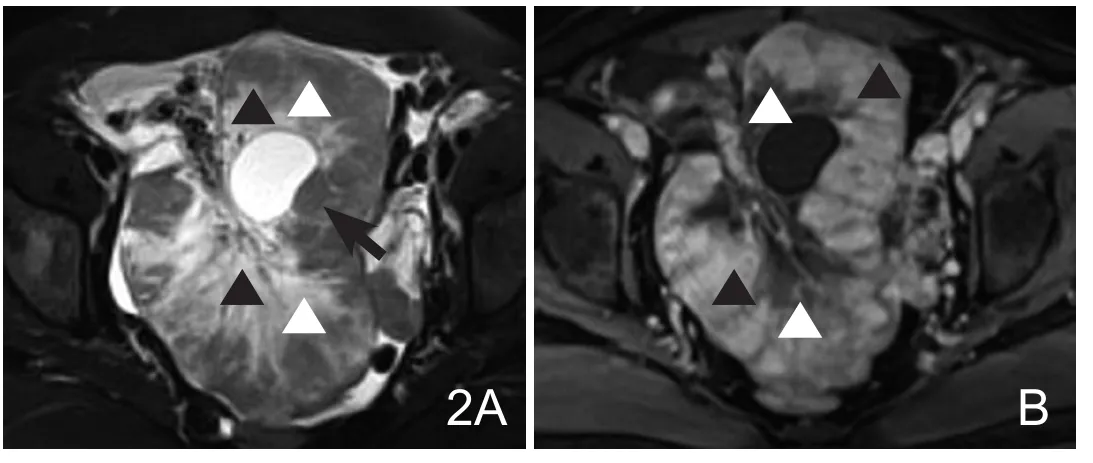
图2 47岁患者,胃黏液性腺癌双侧卵巢转移。横轴位T2WI抑脂(A)见肿块呈实性,不均匀的低(白箭头)及高信号(黑箭头),内见边界清晰的囊肿样信号(黑箭),SIR左=1.26,SIR右=1.37;T1WI抑脂增强(B)显示明显不均匀性强化,T2WI高信号区强化弱提示为瘤内水肿(白箭头),低信号区强化明显(黑箭头)。
结 果
MRI发现全部69个肿瘤。SOTGC 12例共22个肿瘤,位于双侧卵巢10例,左、右单侧卵巢各1例;呈(卵)圆形4个,分叶形17个,不规则形1个。最大径3.6cm~16.7cm,平均8.7±3.8cm。POC 33例共47个肿瘤,双侧14例,左侧11例,右侧8例;呈(卵)圆形11个,分叶形10个,不规则形26个。最大径2.5~17.0cm,平均8.7±3.5cm,两组肿瘤大小无统计学差异(F=0.032,t=-0.360,P=0.997)。
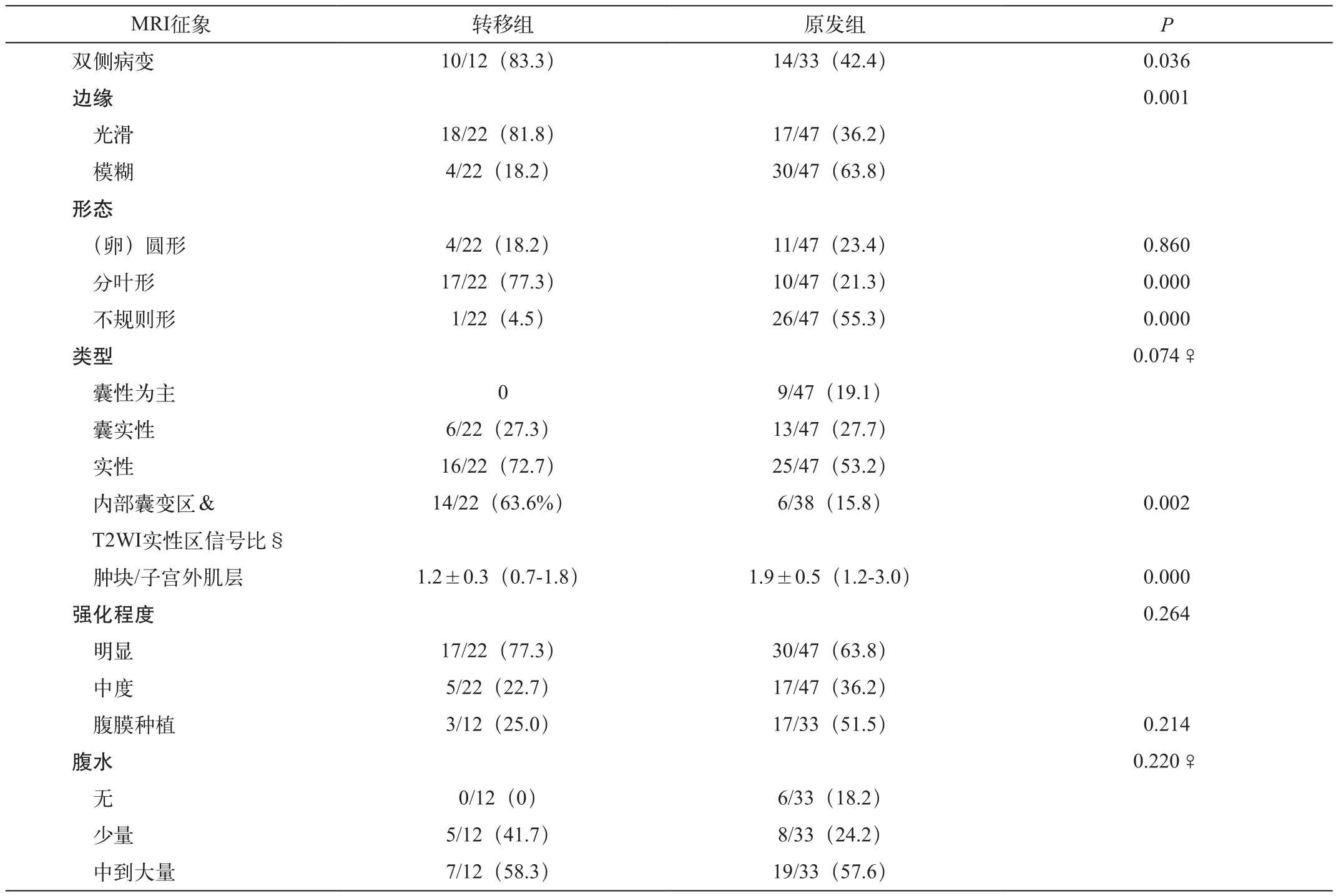
表1 胃癌卵巢转移性肿廇与原发性卵巢癌的MRI形态学征象比较

图3 54岁患者,胃印戒细胞癌双侧卵巢转移。横轴位T2WI抑脂(A)见双侧卵巢肿块呈分叶状、实性,不均匀的低(白箭)及少量高信号(黑箭),SIR左=1.06,SIR右=1.17;T1WI抑脂增强(B)显示明显强化(黑箭),与子宫肌层强化程度相仿,T2WI高信号区强化弱,提示为瘤内水肿(白箭)。

图4 29岁患者,胃印戒细胞癌左侧卵巢转移。横轴位T2WI抑脂(A)见左侧卵巢肿块呈囊实性,内见边界清晰的囊样信号(白箭),囊边缘见条片状高信号区(黑箭);T1WI抑脂增强(B)实性区及囊壁明显强化(白箭),T2WI高信号区强化弱,提示为瘤内黏液成分(黑箭)。

图5 41岁患者,右侧卵巢低级别浆液性腺癌。冠状位T2WI扫描(A)见右侧卵巢肿块呈实性,其内见囊状明显高信号,形态不规则,肿块实性区呈高信号(黑箭),SIR=1.91;T1WI抑脂增强(B)实性区明显强化(黑箭),边界欠清。
SOTGC与POC的MRI形态学征象比较见表1。双侧病变、边缘光滑、分叶形肿块、实性区内边界清晰的囊样信号四个MRI征象在SOTGC中均较POC多见,差异有统计学意义(图1~5),对SOTGC的诊断敏感性和特异性分别为83.3%和57.6%、81.8%和63.8%、77.3%和78.7%、63.6%和84.2%。SOTGC和POC的平均SIR值分别为1.2±0.3和1.9±0.5(P=0.000),当SIR值取1.4时,鉴别SOTGC和POC的敏感性、特异性分别为81.8%和88.4%。两组肿瘤肿块类型、强化程度、腹膜种植及腹水量均无统计学差异。当肿瘤实性区内出现边界清晰的囊样信号、SIR值<1.4两个征象之一时,诊断SOTGC的敏感性、特异性和准确性分别为90.9%、76.6%和81.2%。
讨 论
绝大多数SOTGC是形态学上典型的Krukenberg瘤。1989年,WHO定义了Krukenberg瘤的组织学诊断标准:肿瘤生长在卵巢内;镜下富含黏液及印戒样细胞;卵巢间质伴有肉瘤样浸润。Krukenberg瘤通常源自胃肠道,约76%来源于胃[8],也可来源于乳腺及阑尾等少见部位。有研究显示平均诊断年龄为40~46岁,其中35%~45%小于40岁[9]。本组平均年龄为44岁,5/12(42%)小于40岁,与文献报道一致。此现象的原因可能为绝经前的卵巢功能旺盛,血供丰富,同时又是多种内分泌激素作用的靶点,为癌细胞转移、生长提供良好的环境。青春期胃肠道恶性肿瘤中黏液腺癌所占比例为中老年人的3~5倍,而黏液腺癌的转移比例高于其他组织学类型,这也是转移性卵巢癌患者发病年龄轻的一个原因。有学者研究显示年龄是SOTGC的预后因素之一,特别是年龄小于50岁提示预后较差[10],我们未对所有患者进行生存时间的随访。
病理特征:SOTGC常发生在进展期胃癌,组织学类型多为低分化腺癌及印戒细胞癌。卵巢肿块被膜多完整,表面光滑,多表现为双侧不对称性的实性肿块,也可为海绵状或凝胶状改变,取决于肿瘤的水肿程度、间质中黏液分泌量或含间质细胞的数量以及间质纤维化程度,卵巢实质或表面出现多发大结节时具有特征性[8]。肿块切面常为灰白及灰黄色质硬组织伴黄褐色或暗紫红色灶样变性,可合并广泛的出血,也可见不同数目的囊变区,内含清亮的浆液、黏液或者血性液体。镜下肿瘤由上皮组织和间质成分构成,前者主要为富含黏液的印戒细胞,后者常为肉瘤样外观,由梭形细胞的纤维结缔组织组成。
双侧性是非生殖道源性卵巢转移瘤的重要特征之一,据报道60%~80%的SOTGC为双侧卵巢不对称性肿块[4,11,12]。在POC中,浆液性囊腺癌、内膜样腺癌及未分化腺癌易双侧发病,黏液性囊腺癌极少数为双侧性[4,13]。我们资料中10/12(83.3%)的SOTGC为双侧病变,明显高于原发癌的14/33(42.4%)。
SOTGC常呈分叶状,边缘光滑,境界清晰。其原因可能为肿瘤有一层厚的包膜,瘤细胞在包膜内卵巢髓质中生长而很少累及表面的缘故。卵巢常保持原形态,呈肾形或分叶形,表面呈多结节状隆起。
本组所有SOTGC均为囊实性(27.3%)或实性(72.7%),未见囊性为主肿块;POC中囊性为主肿块占19.1%,其余为囊实性(27.7%)和实性(53.2%);但两组肿块类型差异未见统计学意义。另外,我们也未发现SOTGC肿块的类型与胃癌病理类型的相关性。Brown等[14]的多中心研究发现转移性卵巢癌以实性或囊实性肿瘤为主,而POC多呈混合多房囊性。也有研究发现SOTGC表现为囊性为主的肿块可占30.8%[15],原因是由于肿瘤生长过程中发生囊变、坏死或出血。
Kim等[5]研究显示实性肿瘤内伴边界清晰的囊样信号可提示Krukenberg瘤的诊断。我们的结果与Kim等的相仿:63.6%的SOTGC实性区内可见边界清晰的囊变区,明显高于POC的15.8%,SOTGC中的囊壁71.4%呈显著性均匀强化,而POC中的囊壁多呈不规则增厚或伴壁结节形成。病理上SOTGC的囊变区为不同类型的腺体扩张形成,内含浆液、黏液或血性液体,呈现不同的信号类型;囊壁为肿瘤细胞相对密集区域,其周围常为少肿瘤细胞的水肿区或疏松的间质反应。
肿瘤实性区在T2WI上常表现为低至高的不均匀信号强度,Ha等[6]研究认为出现肿瘤实性区T2WI低信号有助于Krukenberg瘤的诊断。我们比较了两组肿瘤实性区与子宫外肌层的T2WI信号强度比(SIR),显示SOTGC SIR值为1.2±0.3(0.7~1.8),显著低于POC的1.9±0.5(1.2~3.0),当SIR值<1.4时,诊断SOTGC的敏感性和特异性分别为81.8%和88.4%。组织病理学上,实性区的T2WI低信号与密集的胶原间质反应相对应,增强后常表现为显著均匀性强化,也可呈多结节状强化,与其浸润生长方式相对应。此外,T2WI上肿瘤内的高信号区,与瘤内结缔组织水肿以及黏液分泌量均有关,这种高信号区常位于肿瘤的中央或者实性成分内,增强后无强化或仅轻微强化。
综上所述,SOTGC具有一定的MR形态学特征,如双侧发生、边缘光滑、分叶形、实性区内边界清晰的囊变区、以及T2WI实性区较低的SIR值,结合病史将有助于与POC鉴别。
[1] Antila R, Jalkanen J, Heikinheimo O. Comparison of secondary and primary ovarian malignancies reveals differences in their pre- and perioperative characteristics. Gynecol Oncol, 2006, 101: 97-101.
[2] Moore R, Chung M, Cornelius G, et al. Incidence of metastasis to the ovaries from nongenital tract primary tumors. Gynecol Oncol,2004, 93: 87-91.
[3] Qiu L, Yang T, Shan XH, et al. Metastatic factors for Krukenberg tumor: a clinical study on 102 cases. Med Oncol, 2011, 28: 1514-1519.
[4] Koyama T, Mikami Y, Saga K, et al. Secondary ovarian tumors:spectrum of CT and MR features with pathologic correlation.Abdom Imaging, 2007, 32: 784-795.
[5] Kim SH, Kim WH, Park KJ, et al. CT and MR findings of Krukenberg tumors: comparison with primary ovarian tumors. J Comput Assist Tomogr, 1996, 20: 393-398.
[6] Ha HK, Baek SY, Kim SH, et al. Krukenberg's tumor of the ovary:MR imaging features. AJR, 1995, 164: 1435-1439.
[7] Khashper A, Addley HC, Abourokbah N, et al. T2-hypointense adnexal lesions: an imaging algorithm. Radiographics, 2012, 32:1047-1064.
[8] Young RH. From Krukenberg to today: the ever present problems posed by metastatic tumors in the ovary. Part I. Historical perspective, general principles, mucinous tumors including the krukenberg tumor. Adv Anat Pathol, 2006, 13: 205-227. Review.
[9] Kiyokawa T, Young RH, Scully RE, et al. Krukenberg tumors of the ovary: a clinicopathologic analysis of 120 cases with emphasis on their variable pathologic manifestations. Am J Surg Pathol, 2006,30: 277-299.
[10] 马晋平,吴恺明,陈剑辉,等. Krukenberg瘤27例临床特点和预后分析. 中华普通外科学文献:电子版,2011,5:124-129.
[11] Willmott F, Allouni KA, Rockall A, et al. Radiological manifestations of metastasis to the ovary. J Clin Pathol, 2012, 65:585-590.
[12] McCluggage WG, Wilkinson N. Metastatic neoplasms involving the ovary: a review with an emphasis on morphological and immunohistochemical features. Histopathology, 2005, 47: 231-247.
[13] Seidman JD, Kurman RJ, Ronnett BM, et al. Primary and metastatic mucinous adenocarcinomas in the ovaries: incidence in routine practice with a new approach to improve intraoperative diagnosis.Am J Surg Pathol, 2003, 27: 985-993.
[14] Brown DL, Zou KH, Tempany CM, et al. Primary versus secondary ovarian malignancy: imaging findings of adnexal masses in the Radiology Diagnostic Oncology Group Study. Radiology, 2001,219: 213-218.
[15] Choi HJ, Lee JH, Kang S, et al. Contrast-enhanced CT for differentiation of ovarian metastasis from gastrointestinal tract cancer:stomach cancer versus colon cancer. AJR, 2006, 187: 741-745.

